Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "БОЛЬ В НИЖНЕЙ ЧАСТИ СПИНЫ: ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА, ЛЕЧЕНИЕ"
Автор: В.В. Поворознюк, Т.В. Орлик
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Кардиология, Неврология, Ревматология, Семейная медицина/Терапия
Просмотров: 3 754
Дата проведения: с 01.06.2015 по 01.06.2016
Дефиниции и классификации
 Одним из наиболее распространенных симптомов заболеваний костно-мышечной системы является боль, в частности, боль в спине.
Одним из наиболее распространенных симптомов заболеваний костно-мышечной системы является боль, в частности, боль в спине.
В 1986 году Международной ассоциацией по изучению боли (International Association for the Study of Pain, IASP) была издана І Классификация хронической боли. В 1994 году данная классификация была пересмотрена и опубликовано ее ІІ издание, которое до настоящего времени является базовым и принято за основу в Международной классификации болезней X пересмотра (МКБ-10).
Согласно ІІ изданию Классификации боли IASP, пересмотренному в 2011-2012 гг., болевые синдромы, связанные с заболеваниями костно-мышечной системы, классифицируют и кодируют согласно следующим принципам:
І ― по локализации в области тела (в частности, боль в области шеи (Сervical region; код 100), боль в области грудной клетки (Тhoracic region; код 300), боль в области поясницы (Lower back, Lumbar spine; код 500);
II ― по системе поражения (в частности, костно-мышечная система и соединительная ткань, код 30);
III ― по временным характеристикам боли: структура события (боль отсутствует, однократный эпизод боли с ограниченным сроком, непрерывная или почти непрерывная, периодическая нерегулярная или регулярная, пароксизмальная, стойкая, другие комбинации);
IV ― по оценке пациентом интенсивности (слабая, средняя, выраженная) и продолжительности боли с момента ее появления (до 1 мес., от 1 до 6 мес., более 6 мес.)*;
V ― по этиологии (в частности, травма, дегенеративные процессы, механическая, дисфункциональная боль, психологического происхождения).
 Следует отметить, что распространенная до недавнего времени классификация боли по продолжительности (*острая – до 6 нед, подострая – 6-12 нед, хроническая – более 12 нед) не используется. Согласно ІІ изданию Классификации боли IASP (2011-2012) различают острую боль (длительность эпизода боли менее 1 мес.) и хроническую (суммарная длительность эпизодов боли 3 и более мес. за последние 6 мес.).
Следует отметить, что распространенная до недавнего времени классификация боли по продолжительности (*острая – до 6 нед, подострая – 6-12 нед, хроническая – более 12 нед) не используется. Согласно ІІ изданию Классификации боли IASP (2011-2012) различают острую боль (длительность эпизода боли менее 1 мес.) и хроническую (суммарная длительность эпизодов боли 3 и более мес. за последние 6 мес.).
В рубрике «А. Относительно обобщенные синдромы» ІІ издания Классификации боли выделяют болевой синдром при остеоартрите (Osteoarthritis, X38.X6a) и остеопорозе (Osteoporosis, X32.X5d). Под термином «остеоартит» в зарубежной медицине, а также во всех международных классификациях, понимают, принятые в странах постсоветского пространства, такие заболевания как «остеоартроз» и «остеохондроз».
По определению, представленному в рубрике «С. Вертебральные и радикулярные болевые синдромы» ІІ Классификации боли (IASP), болевой синдром в спине и симптомы связаны с ним (Spinal Pain and Related Phenomena) определяются как боль, которая ощущается как возникающая в позвоночнике или его дополнительных структурах. Она может локализоваться в одном из пяти сегментов позвоночника: шейном, грудном, поясничном, крестцовом и копчиковом, или в нескольких одновременно.
Боль в шейном отделе (Cervical Spinal Pain) ― боль, которая ощущается в пределах области, ограниченной сверху затылочной линией, снизу условной поперечной линией, проходящей через край первого грудного остистого отростка, а по бокам ― в сагиттальных плоскостях боковых границ шеи.
Боль в грудном отделе (Thoracic Spinal Pain) ― боль, которая ощущается в пределах области, ограниченной сверху условной поперечной линией, проходящей через край первого грудного остистого отростка, снизу от условной поперечной линии, проходящей через край последнего грудного остистого отростка, а по бокам по вертикали ― по краю мышцы, выпрямляющей спину (muscle erectores spinae).
Боль в поясничном отделе (Lumbar Spinal Pain) ― боль, ощущается в пределах области, ограниченной сверху условной поперечной линией, проходящей через край последнего грудного остистого отростка, снизу от условной поперечной линии, проходящей через край первого крестцового остистого отростка, а по бокам по вертикали ― по краю мышцы, выпрямляющей спину (muscle erectores spinae).
 В той же рубрике ІІ Классификации боли (IASP) даны определения таких болевых синдромов:
В той же рубрике ІІ Классификации боли (IASP) даны определения таких болевых синдромов:
― отраженная боль ― боль, которая ощущается в области тела топографически отдаленной от фактического источника боли, то есть проявляется в участках или отдаленных, или непосредственно смежных с источником боли, но эти зоны имеют разную иннервацию.
― корешковая боль ― боль, которая ощущается как возникающая в конечностях или боковых поверхностях туловища, и вызвана эктопической активацией ноцицептивных афферентных волокн спинных нервов или их корешков, имеет невропатический механизм. Может возникать в результате механической деформации спинного ганглия, механического раздражения ранее поврежденных нервных корешков, воспаления в задних ганглиях, и, возможно, ишемического повреждения в ганглиях задних корешков.
― радикулопатия ― потеря сенсорной и/или моторной функции в результате блока проводимости в аксоне спинно-мозгового нерва или его корешков. Субъективные ощущения онемения и слабости, должны быть подтверждены объективно неврологическим обследованием и/или рентгенологическим методами. Радикулопатия может развиваться изолированно или сочетаться с корешковой, отраженной болью или болью в спине.
На основании различных патофизиологических механизмов выделяют также ноцицептивную, невропатическую и психогенную боль.
Ноцицептивная боль связана с активацией болевых рецепторов – ноцицепторов. Она, как правило, острая, соответствует степени тканевого повреждения и длительности действия повреждающих факторов. Ноцицептивные болевые синдромы возникают в результате активации ноцицепторов при травме, воспалении, ишемии, чрезмерном растяжении тканей. Наиболее часто острая боль в спине является ноцицептивной.
Невропатическая боль связана с повреждением корешка вследствие его компрессии, отёка, ишемии и формирования интраневрального воспаления. Острая невропатическая боль в шее и спине обычно связана с поражением корешков при формировании грыжи межпозвоночного диска. Она может возникать при стенозе позвоночного канала, спондилолистезе, компрессии корешков спинномозговых нервов остеофитами и гипертрофированными фасеточными суставами. Как правило, боли иррадиируют в конечности и сопровождаются другими симптомами поражения корешков. В ряде случаев дифференциальный диагноз необходимо проводить с невриномами и другими опухолями, вовлекающими корешки спинномозговых нервов. Невропатические болевые синдромы обычно сопровождаются изменениями поверхностной чувствительности. Характерно наличие двигательных нарушений, изменений сухожильных рефлексов, симптомов натяжения, возможно формирование трофических расстройств.
Психогенная боль в спине обычно хроническая и изолированно встречается редко. Она очень трудна для диагностики, так как наличие у пациента психических нарушений не исключает скелетно-мышечных и неврологических расстройств, которые могут стать причиной имеющейся симптоматики.
Кроме того, в указанных разделах выделяют и отдельно классифицируют:
― боль, связанную с артритом (остеохондрозом), которая обоснованно может быть интерпретирована как источник боли (Spinal Pain Attributable to Arthritis);
― боль, возникающая у пациента с историей травмы, подтверждается рентгенографическими или другими визуализационными методами исследования наличием перелома, который обоснованно может быть интерпретирован как причина боли (Spinal Pain Attributable to a Fracture);
― боль, связанная с метаболическим заболеванием костей (остеопороз), резонно можно интерпретировать как источник боли, что должно быть подтверждено инструментальными или иными доказательствами метаболического заболевания костей, или соответствующими серологическими или биохимическими исследованиями и/или гистологически при биопсии (Spinal Pain Attributable to Metabolic Bone Disease).
Стандартам подавляющего большинства развитых стран утвержден по-синдромный подход к диагностике и лечению заболеваний, в частности, боли в спине. Поэтому, в Международной классификации болезней Х пересмотра в рубрике «Болезни костно-мышечной системы и соединительной ткани» (М.00-М.99) в разделе «Дорсалгия» отдельно выделяются «Цервикалгия» (M.54.2), «Боль в нижней части спины» (M.54.5) и «Боль в грудном отделе позвоночника» (M.54.6), на ряду с такими точными диагнозами, как «Остеохондроз позвоночника у взрослых» (М.42), «Остеопороз с патологическим переломом» (М.80) и «Остеопороз без патологического перелома» (М.81).
В зарубежной литературе, соответственно и в практической медицине, в основном применяются термины «боль в спине» (Spinal Pain), «боль в шее» (Neck pain), «боль в грудном отделе» (Thoracic or Midl pain) и «боль в нижней части спины» (Lumbar or Lower back pain).
Наиболее распространенной причиной обращения к врачам разных специальностей является боль в нижней части спины (БНС) ― боль, локализующаяся между XII парой ребер и ягодичными складками.
Медико-социальное значение проблемы
По данным экспертов Всемирной организации здравоохранения, в развитых странах БНС достигает размеров пандемии и является серьезной медицинской и социально-экономической проблемой. БНС является второй по частоте после респираторных заболеваний причиной обращения к врачу и третьей — госпитализации.
Распространенность БНС в течение жизни составляет 11-84%, 1 года ― 22-65%, 6-ти месяцев ― 40-64,6% и 3-х месяцев ― 26,4%. БНС чаще развивается у трудоспособного населения в возрасте от 20 до 60 лет, при этом среди женщин распространенность БНС достигает 19–67% от всей популяции, а пик болевых ощущений приходится на возраст 50–64 года, а у мужчин – в 35-45 лет. В возрастном периоде от 20 до 64 лет от боли в спине страдают 24% мужчин и 32% женщин.
Более чем у 50% пациентов с БНС выраженность боли снижается через 1 неделю, а в 40% случаев улучшение наступает через 8 недель. Оставшиеся 7–10 % больных продолжают испытывать боль на протяжении более 6 месяцев. У 70–90% пациентов болевые ощущения в пояснице через какое-то время повторяються, что существенно влияет на трудоспособность работающего населения.
Механизмы развития болевого синдрома
Важность проблемы боли в спине подтверждается деятельностью международных организаций по ее изучению и отражением ее синдромов в Международной классификации болезней. Кроме того, разнообразие классификаций, определений и терминов по боли в спине обусловлены недостаточным изучением механизмов развития данного патологического состояния.
Среди современных представлений особое место занимает теория воротного контроля боли. В соответствии с этой теорией, нейронный механизм, находящийся в задних рогах спинного мозга, работает как ворота, которые могут увеличивать или уменьшать поток нервных импульсов, идущих от периферических волокон в центральную нервную систему. Степень увеличения или уменьшения передачи импульса определяется соотношением активности волокон большого (Аb) и малого (Аd, С) диаметров, а также нисходящим влиянием головного мозга. Когда количество информации, которая прошла через ворота, превышает критический уровень, возбуждаются нейронные области, принимающие участие в возникновении ощущения боли и соответствующей реакции на нее.
Установлено, что болевая импульсация способствует выработке Р-вещества — «болевой субстанции», которую считают специфическим медиатором боли. По своему составу это нейропептид, который образуется в невральных ганглиях, переносится потоком аксоплазмы по первичным афферентным волокнам и на уровне «ворот» проводит болевые ощущения. Известно, что болевые импульсы одновременно активируют альфа- и гамма-мотонейроны передних рогов спинного мозга. Активация передних мотонейронов приводит к спазму мышц, иннервируемых данным сегментом спинного мозга, и способствует стимуляции ноцицепторов самой мышцы. В спазмированных мышцах развивается локальная ишемия, что вызывает вазомоторные и нейро-дистрофические изменения в тканях и усиливает активацию ноцицепторов мышечного волокна, т. е. мышцы становятся дополнительным источником патологической афферентации.
Ноцицептивная информация поступает в ретикулярную формацию, имеющую связи с гипоталамусом, базальными ядрами и лимбической системой. Это обеспечивает реализацию нейро-эндокринных и эмоционально-аффективных проявлений боли. Связи ретикулярной формации с корой головного мозга формируют ощущение боли и ее психологическую оценку.
Информацию о локализации боли и ее интенсивности формирует таламус. Его ядра участвуют в оценке такой информации, осуществляют ее раскодировку, различая болевые стимулы по продолжительности и интенсивности. Специфичность ноцицептивных систем наиболее выражена в периферическом отделе нервной системы и наименее — в коре головного мозга. Механизмы контроля боли реализуются через антиноцицептивные системы, основные структуры которых — нейроны задних рогов спинного мозга, дугообразное ядро гипоталамуса, перивентрикулярное и периакведуктальное серое вещество, ядра шва. Трансмиттерами этих структур являются эндорфины, энкефалины, норадреналин, серотонин, уровень которых значительно изменяется в постменопаузальном периоде. Отмечено, что у женщин более низкие болевые пороги, они чаще страдают от ночной и хронической боли. Вместе с тем есть болевые синдромы, встречающиеся преимущественно у мужчин: кластерная головная боль, постгерпетические невралгии, брахиальная плексопатия и др.
В настоящее время большое значение в патогенезе БНС придают миофасциальному синдрому. Миофасциальные болевые синдромы проявляются не только спазмом мышц, но и наличием в напряженных мышцах болезненных уплотнений (гипертонусов) и триггерных точек (узелков Корнелиуса, Мюллера, миогелозов Шаде-Ланге). Известно, что одновременно болевые импульсы активируют альфа- и гамма-мотонейроны передних рогов спинного мозга. Активация передних мотонейронов приводит к спазму мышц, которые иннервируются данным сегментом спинного мозга. При мышечном спазме возникает стимуляция ноцицепторов самой мышцы. Миофасциальные болевые синдромы часто не связаны с заболеванием позвоночника и встречаются независимо от него. Несмотря на то, что клиника миофасциального синдрома описана многими авторами, до сих пор не существует полного гистологического, биохимического или электрофизиологического объяснения природы триггерных точек.
Факторы риска боли в нижней части спины
Оценивая половые различия, принято учитывать гормональные, генетические и множество других факторов. Все факторы риска БНС можно разделить на корригируемые и некорригируемые.
Некорригируемые факторы :
– неблагоприятная наследственность: может реализоваться в особенностях соматогенной, психогенной, гормональной, иммунологической, биохимической конституции, в том числе и соединительной (хрящевой) ткани. Наследуются центральные и периферические механизмы построения двигательного акта.
– возраст и пол: большинство исследователей единогласны в том, что болевой синдром в спине связан с возрастом и полом. Впервые боль в спине появляется как у мужчин, так и у женщин, преимущественно в возрасте 20-30 лет и чаще всего локализована в шейном и поясничном отделе позвоночника. Боль в нижней части спины чаще встречается у женщин и лиц старших возрастных груп. Наиболее выраженная боль в спине приходится на возраст 50-64 года и встречалась чаще у женщин, чем у мужчин.
– в лияние гормонального статуса : с уществует связь между возникновением болевого синдрома и гормональным статусом. У многих женщин болевой синдром в спине значительно усиливается во время менструаций, впервые появляется во время беременности и является предиктором болевых ощущений в постменопаузальном периоде. У женщин с болевым синдромом в репродуктивном периоде обнаружено большую частоту самоабортов, кроме того, у них отмечено увеличение частоты менопаузальных проявлений. Обнаружена незначительная зависимость между наличием болевого синдрома и приемом заместительной гормональной терапии в постменопаузальном периоде. Некоторые исследователи указывают на тесную взаимосвязь между возникновением болевого синдрома и наступлением менопаузы, другие говорят об отсутствии подобной связи. Среди женщин в пери- и постменопаузальном периоде с БНС длительность болевых ощущений в спине более 14 дней в течение года отмечают 45-54 %.
По данным ряда авторов боль в поясничном отделе позвоночника более интенсивна у женщин с ранней менопаузой. С увеличением длительности постменопаузального периода выраженность болевого синдрома в поясничном отделе позвоночника возрастает. Некоторые авторы считают, что такие факторы, как время наступления менархе и менопаузы, количество родов, не влияют на интенсивность болевого синдрома. Следует отметить, что около 25-44% женщин в постменопаузальном периоде относятся к группе риска по развитию остеопороза, который может быть причиной БНС.
Корригируемые факторы :
· производственные статико-динамические перегрузки, особенно в неудобных позах, с вибрацией и воздействием неблагоприятных метеорологических факторов; незнание элементарных эргономически обоснованных приемов производственных операций, а также правил гигиены поз и движений в быту
· отсутствие регулярной физической активности (занятий физкультурой), малоподвижный образ жизни
· эпизодические большие физические нагрузки у лиц, ведущих малоподвижный образ жизни, а также спортивные перегрузки
· нарушение осанки (сколиоз, кифосколиоз, сутулость)
· наличие резких перепадов в физических нагрузках
· частые простудные заболевания, а также ожирение, заболевания пищеварительного тракта и печени
· злоупотребление алкоголем, курением, пристрастие к жареному, копченому, солениям, пряностям и к продуктам, содержащим большое количество пуриновых оснований
· психосоциальные факторы – неудовлетворенность работой, одиночество в семейной жизни, частые стрессы и эмоциональные переживания.
На выраженность болевого синдрома влияют физические нагрузки и курение, поэтому одновременное действие этих факторов значительно увеличивает достоверность появления боли в период постменопаузы. По данным ряда авторов, жалобы на болевой синдром возрастают пропорционально с увеличением индекса массы тела (ИМТ >25 кг/м2). Известно, что болевой синдром связан с профессиональными физическими нагрузками, причем наибольшее количество жалоб на боль в спине выявляется у лиц разных профессий, для которых характерна умеренно выраженная физическая нагрузка.
К факторам риска возникновения болевого синдрома относят тяжелую физическую работу, частые наклоны вперед, скручивания, переразгибания, длительные статические нагрузки. Важным фактором риска хронизации болевого синдрома является длительный эпизод острой боли в спине в анамнезе.
Психосоциальные факторы риска включают тревожность, депрессию и эмоциональные стрессы на работе, в семье. Кроме того существуют данные, что некоторые психологические факторы (эмоциональный стресс, депрессивное настроение) связаны с повышенным риском развития хронической боли в пояснице. В частности, особенности личности, которые определяют реакцию человека на боль. Экстраверты во время болевых ощущений ярко выражают свои эмоции, а интроверты замыкаются в себе и оказываются более чувствительными к болевым раздражениям.
Причинно-следственный подход в дифференциальной диагностике БНС
Возникновение БНС одни исследователи связывают с остеопорозом, другие ― с дегенеративно-дистрофическими заболеваниями позвоночника, третьи ― с гормональными изменениями у женщин в пери- и постменопаузальном периодах. Хотя боль в спине у некоторых пациентов может иметь четкую патоанатомическую этиологию, в большинстве случаев установить такую связь, особенно на первоначальном этапе, достаточно сложно. Кроме того, часто невозможно определить механизмы и размер негативного влияния боли в спине на качество жизни и повседневную активность из-за обилия факторов, приводящих к развитию и способствующих усилению болевого синдрома.
Суть диагностики БНС состоит в понимании того, что данный синдром встречается при многих заболеваниях и патологических состояниях. Кроме того, необходимо помнить, что основным структурным элементом позвоночника является позвоночно-двигательный сегмент (ПДС): тела двух позвонков, соединенные между собой межпозвонковым диском, связочным аппаратом. Источником боли в ПДС могут быть связки и мышцы, надкостница отростков, фиброзное кольцо, особенно его наружные отделы, синовиальные оболочки фасеточных (межпозвонковых) суставов. Но, источником боли в нижней части спины могут быть практически все анатомические структуры пояснично-крестцовой области, брюшной полости и органов малого таза.
В большинстве случаев невозможно определить анатомический субстрат хронического болевого синдрома в спине. У 85% лиц боль в пояснице является неспецифической, то есть не связана с определенным субстратом. Около 4% лиц, которые обращаются с болью в нижней части спины к врачам первичного звена здравоохранения, имеют компрессионные переломы тел позвонков, а около 1% — опухоли. Распространенность протрузий межпозвонковых дисков среди лиц с болью в спине при первичном обращении составляет около 1-3%, анкилозирующий спондилоартрит и инфекционные заболевания позвоночника и спинного мозга встречаются еще реже. Кроме того, интенсивность и характер болевого синдрома слабо коррелируют с рентгенологическими проявлениями. Поэтому, необходимо помнить, что БНС может быть проявлением как вертебральной, так и невертебральной патологии. Диагноз БНС всегда является диагнозом исключения!
В случаях первого эпизода боли в нижней части спины, а часто и в дальнейшем, определить субстрат болевого синдрома не удается. Назначение любых диагностических процедур во время первого эпизода не является обязательным. Исключение составляют ситуации, которые могут свидетельствовать о наличии тяжелой патологии (перелом тела позвонка, опухоли элементов позвоночника и спинного мозга, метастазы, синдром сдавления корешков конского хвоста и др.), требующие тщательного обследования пациентов, так называемые «красные флаги», на которые следует обращать особое внимание в случаях:
|
Серьезные факторы боли в спине «Красные флаги» |
|
возраст пациентов старше 50 лет, или моложе 18 лет; |
|
лихорадка или общая слабость; |
|
потеря массы тела неясной этиологии; |
|
высокоэнергетическая травма в анамнезе, а у пожилых людей также низкоэнергетическая; |
|
онкологическая патология на момент обследования или в анамнезе; |
|
прием иммуносупрессивной терапии, глюкокортикоидов; |
|
потеря чувствительности в области промежности; |
|
тазовые нарушения (недержание/задержка стула, мочи); |
|
тяжелый прогрессирующий неврологический дефицит; |
|
недавно перенесенные бактериальные, вирусные инфекции, ВИЧ; |
|
максимальная интенсивность или усиление боли в ночное время; |
|
продолжительность эпизода боли более 6 недель или сохранение интенсивности боли спустя 4 недели от начала терапии; |
|
высокая интенсивность болевого синдрома; |
|
независимость интенсивности боли от движений и положения тела |
Если у пациента имеются симптомы, перечисленные среди «красных флагов», ему необходимо незамедлительное дополнительное обследование с целью исключения специфического патологического процесса, который может сопровождаться болью в спине.
В связи с особой настороженностью гиподиагностики БНС, в практической медицине наибольшее распространение получила этиологическая классификация БНС Deyo R. и Weinstein J. (2001), согласно которой различают механическую боль, которая составляет 97% всех случаев; немеханическую, связанную с патологией позвоночника – 1% и болевой синдром при висцеральных заболеваниях – 2%.
|
Этиологическая классификация БНС |
|
Механическая боль в нижней части спины или нижних конечностях: |
|
– перенапряжение, повреждение, растяжение поясничного отдела позвоночника (идиопатическая боль в пояснице) (70%) |
|
– дегенеративные изменения межпозвонковых дисков и фасеточных суставов, обычно связанные с возрастом (10%) |
|
– пролапс (грыжа) межпозвоночного диска (4%) |
|
– стеноз позвоночного канала (3%) |
|
– остеопоротические компрессионные переломы (4%) |
|
– спондилолистез (2%) |
|
– травматические переломы (<1%) |
|
– врожденные заболевания (<1%) |
|
– выраженный кифоз |
|
– тяжелые формы сколиотической болезни |
|
– переходные позвонки |
|
– спондилолиз |
|
– внутренние разрывы диска, или дискогенная боль в нижней части спины |
|
– нестабильность позвоночных двигательных сегментов |
|
Немеханические поражения позвоночника (1%): |
|
• Неопластические процессы (0,7%): |
|
– миеломная болезнь |
|
– метастатическая карцинома |
|
– лимфома и лейкемия |
|
– опухоли спинного мозга |
|
– забрюшинные опухоли |
|
– первичные опухоли позвоночника |
|
• Инфекции (0,01%): |
|
– остеомиелит |
|
– септический дисцит |
|
– параспинальный абсцесс |
|
– эпидуральный абсцесс |
|
– опоясывающий лишай |
|
• Воспалительные артриты (часто связаны с антигеном HLA-B27) (0,3%): |
|
– анкилозирующий спондилит |
|
– псориатический спондилит |
|
– синдром Рейтера |
|
– болезнь Шейермана-Мау |
|
– болезнь Педжета |
|
Висцеральные заболевания (2%): |
|
– болезни тазовых органов |
|
– простатит |
|
– эндометриоз |
|
– хронические заболевания тазовых органов |
|
– заболевания почек |
|
– нефролитиаз |
|
– пиелонефрит |
|
– периренальний абсцесс |
|
– аневризма аорты |
|
– панкреатит |
|
– холецистит |
|
– пенетрирующая язва. |
С целью исключения специфических причин боли в спине, необходимо помнить о возрасте пациента. Наиболее частыми специфическими причинами БНС у лиц преимущественно молодого возраста являются патология органов малого таза (воспалительные заболевания, эндометриоз, простатит), болезни почек (пиелонефрит, нефролитиаз, околопочечный абсцесс), специфические артриты, анкилозирующий спондилит. У лиц преимущественно пожилого возраста в первую очередь исключают неопластические порцессы (миеломная болезнь, метастатическая карцинома, опухоли спинного мозга), инфекции (эпидуральный абсцесс, опоясывающий лишай), а также переломы и деформации тел позвонков, связанные с остеопорозом.
Таким образом, БНС может быть результатом многочисленных заболеваний костей, мягких тканей и других органов и систем, часто она локализована далеко от настоящего «очага» патологии. По данным ряда авторов, у женщин в возрасте 45-60 лет причинами болевого синдрома в спине в 20% случаев являются дегенеративные процессы в межпозвоночных дисках, в 19% – спондилоартриты, в 15% – сколиоз, вызванный различной длиной конечностей, в 14% – идиопатический сколиоз, в 7% случаев – спондилолистез. Остеопороз, как причина болевого синдрома в позвоночнике, выявлялся в 6% случаев, с такой же частотой отмечены деформации тел позвонков.
На этапе первичного контакта пациента и врача, тщательный сбор анамнеза истории заболевания, выявление специфических симптомов, общее обследование помогают определить дальнейший путь диагностического поиска. Синдромный подход на этом этапе дает возможность исключить вторичный характер боли в спине.
|
Возможные причины возникновения боли в спине |
|
|
Симптом |
Заболевани е |
|
Хроническая неспецифическая боль в спине |
Хроническое напряжение мягких тканей Дистрофически-деструктивные изменения межпозвонковых дисков Дистрофически-деструктивные изменения межпозвонковых суставов |
|
Структурные нарушения в костях |
Спондилолиз (дефект в межсуставной части дужки позвонка в виде одно- или двусторонней щели) со спондилолистезом или без него (смещение тела позвонка относительно тела соседнего позвонка): обычно врожденный, но может быть приобретенным в результате патологического перелома |
|
Метаболические болезни костей (неопухолевые) |
Болезнь Педжета Остеомаляция Первичный гиперпаратиреоз Другие (редко) |
|
Первичные или вторичные опухоли |
Метастазы опухолей (в частности, молочных желез, предстательной железы, легких, щитовидной железы) Миеломная болезнь Другие гематологические опухоли (лимфома, лейкемия) Первичная костная неоплазия Гуморальные эффекты опухолей костей |
|
Инфекции кости или мягких тканей |
Дисцит Остеомиелит Эпидуральный абсцесс Паравертебральные инфекции |
|
Неинфекционные воспалительные заболевания |
Анкилозирующий спондилоартрит, псориатический спондилит и т. д. Ревматоидный дисцит Арахноидит (после перенесенного миелита или после операции) |
|
Боль, возникающая вследствие патологии бедра |
Остеоартроз Ревматоидный артрит Асептический некроз Инфекции |
|
Боль, возникающая в результате патологии органов и тканей брюшной полости или забрюшинного пространства |
Аневризма аорты Патология почек, мочеточников или мочевого пузыря Патология поджелудочной железы Патология селезенки Язвенная болезнь Гинекологическая патология Ретроперитонеальная опухоль |
|
Смешанные болезни позвоночника |
Спинальный стеноз с перемежающей хромотой Болезнь Шеермана–Мау Спондилоэпифизарная дисплазия |
Установление диагноза при болевом синдроме в нижней части спины требует особой настороженности со стороны специалиста. Существует ряд признаков, требующих особого внимания и последующего диагностического поиска.
|
Признаки, требующие особого внимания и последующего диагностического поиска при БНС |
|
|
Данные анамнеза |
Данные осмотра |
|
· нарушения мочеиспускания (задержка или недержание мочи) · указание на наличие злокачественного новообразования · снижение массы тела неясной этиологии · иммуносупрессивная терапия · длительный прием глюкокортикоидов · внутривенные инъекции лекарственных средств · болевой синдром, выраженность которого не уменьшается в покое · лихорадка · травма в постменопаузальный и сенильный периоды (падение с высоты роста, падения с возможными изменениями костной ткани) |
· выраженные двигательные нарушения в нижних конечностях · анестезия в области вертела бедренной кости · снижение тонуса анального сфинктера · лихорадка · ограничение движений в поясничном отделе позвоночника · повышенная чувствительность позвонков · выраженная отрицательная динамика неврологических проявлений в течение одного месяца · нарушение походки · анталгическая поза |
Даже при отсутствии явных специфических данных анамнеза и осмотра, некоторым пациентам необходимо провести дополнительное инструментальное и лабораторное исследование. Например, пожилым людям, особенно женщинам в постменопаузальном периоде, необходимо проведение рентгенографического исследования для исключения остеопороза и компрессионных переломов, связанных с этим патологическим процессом.
На сегодняшний день в помощь практическому врачу существует целый арсенал визуализационных методов диагностики, помогающих с высокой степенью вероятности определить наличие специфического патологического процесса, провоцирующего боль в спине: рентгенография, компьютерная томография (КТ), магнитно-резонансная томография (МРТ), денситометрия, электромиографическое исследование (ЭМГ).
Первоочередным исследованием в дифдиагностике БНС является рентгенография. Однако, причинно-следственные взаимоотношения клинических проявлений БНС и рентгенологических признаков дегенеративно-дистрофических изменений позвоночника не были доказаны. Показано, что такие рентгенологические симптомы, как спондилолизис и спондилолистез, spina bifida, наличие переходного позвонка (сакрализация, люмбализация), спондилез и болезнь Шейермана-Мау не связаны с болями в пояснице. Также, не доказана связь между дегенеративными признаками при БНС и ее хронизацией.
Учитывая тот факт, что наличие дегенеративных изменений позвоночника не оказывает влияния на выбор терапии и шансы на выздоровление при БНС, а пациент получает дополнительное радиационное воздействие рутинное использование рентгенологического обследования при неспецифической боли в спине не оправдано. В соответствии с этим предложены следующие показания для проведения рентгенологического исследования при БНС:
● возраст 50 лет и старше
● достоверная травма
● двигательные нарушения
● потеря массы тела неясной этиологии (около 4 кг за 6 месяцев)
● подозрение на анкилозирующий спондилоартрит
● злоупотребление алкоголем
● длительная терапия кортикостероидами
● повышенная температура неясного генеза (> 37,8˚С)
● повторное посещение врача в течение 1 месяца с аналогичными симптомами без существенного улучшения
● длительная временная нетрудоспособность в связи с болевым синдромом в нижней части спины.
Учитывая то, что во многих случаях первичного эпизода боли в спине не удается рентгенологически подтвердить причинно-следственную связь между болевым синдромом и патологическим субстратом, разработан дифференцированный подход применения визуализационных методов, основаный на характерологических особенностях боли. Рекомендуемые исследования для диагностики БНС представлены ниже.
|
Рекомендуемые исследования для диагностики БНС |
|
|
Характеристика боли |
Необходимые исследования |
|
Нерадикулярная боль : · отсутствие в анамнезе травмы или факторов риска · подозрение на наличие скрытой инфекции или неопластического процесса · спондилолистез, сопровождающийся выраженной неврологической симптоматикой и отсутствием эффекта от проводимого консервативного лечения |
Рентгенография в передне-задней и боковой проекциях Остеосцинтиграфия, МРТ Функциональная ретгенография в положении сгибания–разгибания, КТ, МРТ, остеосцинтиграфия |
|
Радикулярная боль: · персистирующие симптомы ишиалгии с очевидным поражением нервного корешка · ишиалгия с неясным уровнем поражения нервного корешка |
МРТ ЭМГ, КТ, МРТ |
|
При наличии травмы: поражение двигательных волокон при минимальной травме у пациента с возможным структурным нарушением костной ткани |
Рентгенографическое исследование после установления механизма травмы |
|
При подозрении на остеомиелит: над позвонком определяется точка, болезненная при пальпации |
МРТ |
|
При наличии неопластических процессов в анамнезе: клинические проявления согласуются с метастатическими поражениями |
Остеосцинтиграфия, МРТ |
На следующем этапе необходимо определить есть ли у пациента неврологический (в том числе, корешковый) болевой синдром, в пользу которого будет свидетельствовать нейропатический характер боли («стреляющая», «жгучая» боль, ощущения «удара током», «бегания мурашек», покалывания) и данные объективного осмотра (положительные симптомы натяжения, симптомы неврологического дефицита). Необходимо уточнить наличие и характер двигательных нарушений, чувствительных и трофических расстройств, изменение сухожильных рефлексов. Боль в спине с неврологическим компонентом характеризуется наличием одного или нескольких симптомов и признаков, перечисленных ниже.
|
Симптомы |
Признаки |
|
Боль, иррадиирующая в нижнюю конечность (конечности) |
Положительные симптомы раздражения нервных корешков |
|
Интенсивность боли, иррадиирущей в ногу ниже колена, такая же или большая, чем боль в спине |
Двигательные, чувствительные или рефлекторные признаки поражения нервного корешка |
|
Онемение или парестезии в болезненной области |
С целью выявления корешкового синдрома рекомендуется проводить тест натяжения Ласега (в положении пациента лежа на спине осуществляется медленное поднятие прямой ноги вверх), который считается наиболее точным для выявления корешковой боли. Для компрессионной радикулопатии характерно его ограничение от 30° до 50°, иррадиация боли из пояснично-крестцовой области по задне-наружной поверхности ноги до пальцев стопы и её усиление при тыльном сгибании стопы и наклоне головы вперед. Необходимо отметить, что положительный симптом Ласега может появляться также при растяжении задней группы мышц бедра и ягодичных мышц, особенно если в них определяется миофасциальный болевой синдром. На долю компрессионной радикулопатии пояснично-крестцовых корешков приходится около 4% случаев острой боли в спине.
После исключения (!) специфических и неврологических причин боли в спине следует оценить прогноз болевого синдрома. У большинства пациентов, испытывающих персистирующую боль в спине, невозможно установить конкретное заболевание или специфическое нарушение структур позвоночного столба. В настоящее время в отношении таких болевых феноменов принято использовать термин «неспецифическая боль в спине». Первичным источником такой боли могут служить разные структуры позвоночного столба и окружающих его тканей, например капсулы суставов, связки и фасции, межпозвонковый диск (болевые рецепторы обнаружены в наружной трети кольца), позвонки (ноцицепторы обнаружены в надкостнице и кровеносных сосудах), мышцы. Определить конкретный источник первичной боли в рутинной клинической практике весьма проблематично. Для неспецифической боли в спине характерна поясничная или пояснично-крестцовая локализация без неврологического компонента. Это типичные «механические» боли, появляющиеся и/или усиливающиеся при физической активности, уменьшающиеся или проходящие в покое. Общее состояние здоровья пациента при острой неспецифической боли в спине не страдает. Объективный осмотр позволяет оценить выраженность болевого синдрома и функциональную недостаточность. В большинстве случаев для постановки диагноза неспецифической боли в нижней части спины достаточно подробного сбора анамнеза и объективного осмотра.
В течение последних нескольких десятилетий произошли важные достижения в диагностике и лечении боли в спине. Существует все больше доказательств, что хроническая боль в спине, с одной стороны, может поддерживаться или провоцироваться анатомическими и функциональными изменениями в центральной нервной системе и быть проявлением структурных изменений в позвоночнике (например, дегенеративно-дистрофические изменения, атрофия или асимметрия параспинальных мышц), с другой, ― может быть сама по себе патологическим состоянием.
В докладе Института медицины США «Уменьшение боли в Америке…» было отмечено, что хроническую боль следует считать болезнью, наряду с другими хроническими заболеваниями, такими как диабет, гипертония, застойная сердечная недостаточность и хронические обструктивные заболевания легких. Подобные заключения связанны с тем, что более 70% пациентов с БНС имеют рецидивы в течение последующего года, а в 35-40% случаев боль в спине приобретает хронический характер, что может оказывать существенное влияние на психологический статус пациентов.
При длительно сохраняющемся болевом синдроме постепенно формируется «болевое поведение», изменяется восприятие боли, появляются страх, ощущение ожидания боли, раздражительность. Понимание роли эмоциональных и психологических факторов в интенсивности и длительности болевого синдрома привело к созданию концепции «желтых флагов», направленной на выявление у пациента предикторов, усугубляющих течение болевого синдрома. К «желтым флагам» относят стремление пациентов к опеке, социальной защите, симптомы тревожно-депрессивных расстройств, излишнюю «катастрофизацию» пациентом своей болезни.
Оценка наличия признаков «болевого поведения» и детализация причин/факторов, способствующих его развитию, должны проводиться в случае отсутствия улучшения состояния, возникновении повторных эпизодов острой боли в спине и риске хронизации болевого синдрома. При выявлении «желтых флагов» может быть показано проведение поведенческой терапии, направленной на коррекцию психологического состояния пациента, конечной целью которой является минимизация шансов хронизации болевого синдрома.
Таким образом, причиной боли в нижней части спины могут быть различные заболевания и патологические состояния, что требует соответствующих знаний и профессионализма врача для проведения тщательной диагностики и целенаправленного лечения данного контингента больных. Своевременная диагностика и корректное с патогенетических позиций лечение, в частности устранение боли, позволяют предотвратить персистирование и хронизацию болевого синдрома.
Лечение пациентов с болью в нижней части спины
Первое руководство по ведению пациентов с болью в нижней части спины опубликовано в 1987 году. Авторы этого документа на ряду с положительными моментами указывают на отсутствие высококачественной доказательной базы, на основе которой возможно формулировать рекомендации по лечению с высокой степенью доказательности. С тех пор наблюдается значительное увеличение количества исследований, в которых изучаются диагностика, прогноз и особенно подходы к терапии боли в нижней части спины. На сегодняшний день в Кокрановской базе данных более 2500 контролируемых исследований, оценивающих лечение боли в шейном отделе позвоночника и нижней части спины. Для большинства из предложенных подходов лечения доказательства эффективности приводятся в мета-анализах, что свидетельствует о высокой надежности полученных данных. Так, в настоящее время опубликованы 32 систематических обзора рандомизированных контролируемых исследований, оценивающих эффективность мероприятий по боли в нижней части спины.
За последние десятилетия во многих странах выпущены (обновлены) клинические рекомендации по лечению боли в нижней части спины. В 2010 году в журнале European Spine Journal был опубликован обзор национальных рекомендаций европейских стран и США по ведению врачами первичного звена пациентов с неспецифической болью в нижней части спины. В целом, по принципиальным позициям рекомендации разных стран не отличаются.
На первом этапе терапевтического воздействия рекомендуется заверить больного, что он должен остаться активным насколько это возможно, а затем постепенно увеличивать уровень активности. Современные рекомендации по сравнению с предыдущими предлагают более раннее возвращение на работу. Целесообразность и продолжительность постельного режима у этой категории пациентов активно дискутируется. Одни рекомендации утверждают, что если постельный режим и показан больному в связи с выраженным болевым синдромом, то он не должен длиться более 2-х дней (например, в Германии, Новой Зеландии, Испании, Норвегии). Итальянские рекомендации советуют 2-4 дня постельного режима для пациентов с тяжелым поражением корешков пояснично-крестцового отдела. Но эти рекомендации не предлагают четкой оценки тяжести корешкового поражения, что позволило бы выделить пациентов, которым требуется постельный режим.
Лечебная физкультура признана эффективной у пациентов с подострым и хроническим болевым синдромом, но нет данных о преимуществе в эффективности одного комплекса ЛФК над другим.
Наиболее дискутабельным методом лечения остается мануальная терапия. Некоторые рекомендации не советуют использовать этот метод в остром периоде (например, в Испании, Австралии), некоторые советуют, но он не является обязательным (например, в Австрии, Италии), а некоторые предлагают краткий курс для тех пациентов, которые не реагировали на терапию первой линии (например, в США, Нидерландах). Другие рекомендации указывают на обязательное применение мануальной терапии только в первые недели эпизода острой боли в пояснице (например, в Канаде, Финляндии, Норвегии, Германии, Новой Зеландии).
Первым шагом фармакотерапии боли в спине признан ацетоменофен (парацетамол), или нестероидные противовоспалительные препараты. С этим пунктом согласны большинство рекомендаций. Относительно других препаратов (миорелаксанты, ГКС, антидепрессанты и антиконвульсанты) – в разных рекомендациях существуют различия. Дискутируются срок назначения и продолжительность их использования.
Таким образом, обобщая рекомендации руководств разных стран мира, на сегодняшний день определен базисный пошаговый алгоритм ведения пациентов с неспецифической болью в нижней части спины:
|
При остро й боли: |
|
• убедить пациента, что боль в спине не является опасным состоянием (благоприятный прогноз) |
|
• посоветовать, чтобы пациент оставался активным |
|
• назначить лекарства, если это необходимо: первая линия – парацетамол или нестероидные противовоспалительные препараты, вторая линия – миорелаксанты и/или антидепрессанты, противоэпилептические средства |
|
• не рекомендовать длительный постельный режим без веских показаний |
|
• не рекомендовать применение активных физических упражнений |
|
При хронической боли в нижней части спины: |
|
• краткосрочное использование препаратов |
|
• ЛФК |
|
• когнитивно-поведенческая терапия |
В случае отсутствия у пациента «красных флагов», или перечисленных выше специфических патологических признаков, лечение боли в нижней части спины состоит в лечении собственно болевого синдрома. Современные подходы к эффективной терапии неспецифической боли в спине не требуют патанатомического диагноза, а современные анальгетики позволяют в короткие сроки провести качественное обезболивание и активизировать пациента уже на ранних этапах.
Наиболее часто пациентам с болью в нижней части спины назначают нестероидные противовоспалительные препараты (НПВП). Механизм действия НПВП обусловлен угнетением превращения арахидоновой кислоты в простагландины путем ингибирования фермента циклооксигеназы (ЦОГ). Выделены две изоформы ЦОГ: ЦОГ-1 и ЦОГ-2. Изоформа ЦОГ-1 была выделена в 1976 году, а изоформа ЦОГ-2 позже, в 1991 году.
ЦОГ-1 существует в организме в норме, катализирует синтез простагландинов, участвующих в многочисленных физиологических функциях, включая нормальное функционирование слизистой оболочки желудочно-кишечного тракта и агрегацию тромбоксана А2 в тромбоцитах.
ЦОГ-2 синтезируется только при повреждении тканей, вызывает продукцию цитокинов и других медиаторов воспаления в ряде тканей, включая эндотелиальные клетки и, как полагают, играет определенную роль в посредничестве боли, воспалении и лихорадке. Продукция ЦОГ-2 резко увеличивается при воспалении. Простагландины (ПГ), образованные под влиянием ЦОГ-2, участвуют в развитии и прогрессировании острого и хронического воспаления. Так, ПГ E2, расширяя артериолы, увеличивает приток крови к зоне воспаления, а ПГ F2a – сужает венулы и затрудняет отток крови, что способствует развитию экссудации. Кроме того, ПГ вызывают гипералгезию и потенцируют действие других медиаторов воспаления.
Центральный механизм действия НПВП связан с подавлением синтеза ПГ, которые образуются в центральной нервной системе и способствуют передаче болевого сигнала. НПВП снижают чувствительность болевых рецепторов, уменьшают отек тканей в очаге воспаления, ослабляя механическое давление на ноцицепторы. Обсуждаются дополнительные механизмы противовоспалительной активности НПВП, не связанные с ингибицией ЦОГ: угнетение функции нейтрофилов и взаимодействия лейкоцитов с эндотелием сосудов, активация фактора транскрипции NF-kВ, регулирующего синтез провоспалительных медиаторов, или даже опиоидоподобные эффекты.
На сегодня НПВП представляют разнородную группу препаратов с общими свойствами: обезболивающим, противовоспалительным и жаропонижающим действием. НПВП могут быть классифицированы по различным характеристикам, в том числе по ЦОГ-селективности, химическим и фармакологическим свойствам.
|
Классификация НПВ П по селективности в отношении различных форм ЦОГ |
|
|
Выраженная селективность в отношении ЦОГ-1 |
Аспирин Индометацин Кетопрофен Пироксикам Сулиндак |
|
Умеренная селективность в отношении ЦОГ-1 |
Диклофенак Ибупрофен Напроксен и др. |
|
Примерно равноценное ингибирование ЦОГ-1 и ЦОГ-2 |
Лорноксикам |
|
Умеренная селективность в отношении ЦОГ-2 |
Этодолак Мелоксикам Нимесулид Набуметон |
|
Выраженная селективность в отношении ЦОГ-2 |
Целекоксиб Рофекоксиб |
НПВП, как правило, имеют схожие химические формулы и принадлежат к слабым жирорастворимым кислотам. Однако, существуют некоторые клинически значимые различия в фармакокинетических свойствах препаратов.
Классификация НПВС по активности и химической структуре
|
НПВ П с выраженной противовоспалительной активностью |
|
|
Кислоты |
|
|
Салицилаты |
Ацетилсалициловая кислота Дифлунизал Лизинмоноацетилсалицилат |
|
Пиразолидины |
Фенилбутазон |
|
Производные индолуксусной кислоты |
Индометацин Сулиндак Этодолак |
|
Производные фенилуксусной кислоты |
Диклофенак |
|
Оксикамы |
Пироксикам Теноксикам Лорноксикам Мелоксикам |
|
Производные пропионовой кислоты |
Ибупруфен Напроксен Флурбипрофен Кетопрофен Тиапрофеновая кислота |
|
Некислотные производные |
|
|
Алканоны |
Набуметон |
|
Производные сульфонамида |
Нимесулид Целекоксиб Рофекоксиб |
|
НПВС со слабой противовоспалительной активностью |
|
|
Производные антраниловой кислоты |
Мефенамовая кислота Этофенамат |
|
Пиразолоны |
Метамизол Аминофеназон Пропифеназон |
|
Производные парааминофенола |
Фенацетин Парацетамол |
|
Производные гетероарилуксусной кислоты |
Кеторолак |
Быстрое всасывание – ценная характеристика препарата, особенно актуальна в случае острых болевых синдромов, поскольку именно она обеспечивает скорость наступления обезболивающего эффекта. НПВП, как правило, имеют высокую биодоступность после перорального приема, хорошо всасываются из желудочно-кишечного тракта. Тем не менее, скорость всасывания колеблется у разных НПВП, может повлиять на кратность применения препарата. По периоду полураспада НПВП могут быть классифицированы на две группы: с коротким периодом полувыведения (<6 ч) и длительным. Этот показатель обеспечивает рекомендации по периодичности приема препаратов. Препараты с коротким периодом полувыведения (например, ибупрофен) обычно принимают каждые 6-8 ч, а средства с более длительным периодом (например, напроксен и целекоксиб) вводят один или два раза в день.
Классификация НПВП по продолжительности действия
|
Короткого действия (Т 1/2 = 2-8 часов): |
|
– ибупрофен |
|
– индометацин |
|
– вольтарен |
|
– кетопрофен |
|
– фенопрофен |
|
– фенаматы |
|
– толметин |
|
Средней продолжительности действия (Т 1/2 =10-20 часов): |
|
– напроксен |
|
– сулиндак |
|
– дифлюнизал |
|
Длительного действия (Т 1/2 = 24 и более часов): |
|
– оксикамы |
|
– фенилбутазон |
НПВП являются одними из наиболее часто используемых препаратов во всем мире – более чем 30000000 человек каждый день принимают эти препараты. В обеспечении адекватной аналгезии большое значение уделяется традиционным НПВП, которые обладают мощным обезболивающим действием, однако имеют ряд побочных эффектов. Выбор адекватного обезболивающего препарата остается сложной задачей.
В 2008 году был опубликован мета-анализ, посвященный оценке эффективности неспецифических НПВП и ингибиторов ЦОГ-2 в лечении неспецифического боли в нижней части спины. В анализ были включены 65 исследований (общее количество 11 237 пациентов). Доказательства, полученные в результате этого анализа показывают, что НПВП являются эффективными для краткосрочного облегчения симптомов у больных с острой и хронической БНС. Но не были выделены отдельные классы НПВП, которые были бы более эффективными по сравнению с другими, в лечении БНС. Применение селективных ингибиторов ЦОГ-2 сопровождалось развитием меньшего количества гастроинтестинальных побочных эффектов по сравнению с традиционными НПВП, включенными в данный обзор. Однако, недавние исследования показали, что применение ингибиторов ЦОГ-2 связано с увеличением сердечно-сосудистых случаев в конкретной популяции пациентов, но краткосрочное применение этой группы препаратов для лечения БНС не сопровождается увеличением риска сердечно-сосудистых катастроф. Был сделан главный вывод, что четких различий в эффективности между различными НПВП в лечении пациентов с болью в нижней части спины не существует при условии соблюдения стандартных дозировки и режима приема препаратов.
Для купирования острого болевого синдрома Кеторолак
Особенности действия кеторолака. Кеторолака трометамин – производное арилуксусной кислоты, неселективный ингибитор ЦОГ. Используется в виде трометаминовой соли, что увеличивает его растворимость в воде и при этом трометаминовая соль легко расщепляется, высвобождая кеторолак.
Биодоступность перорального кеторолака составляет 80-100 % и аналогична таковой при внутримышечном введении, что обеспечивает быстрое наступление анальгезии [Беловол А.Н., Князькова И.И., 2012]. Максимальная концентрация препарата в плазме крови достигается через 5-50 минут в зависимости от способа введения, фармакокинетика имеет линейный характер. После приема внутрь 10 мг эффект развивается через 10-60 мин, после внутримышечного введения 30 мг – через 15-75 мин. Продолжительность действия кеторолака составляет до 10 часов. Кеторолак связывается с белками плазмы крови на 90-99 %, метаболизируется в печени, выводится через почки (90 %) и кишечник (6 %). Период полувыведения составляет 5 часов, а у пожилых людей приближается к 7 часам [Беловол А.Н., Князькова И.И., 2012].
Механизм действия кеторолака обусловлен блокированием ЦОГ и обеспечивается центральными и периферическими механизмами.
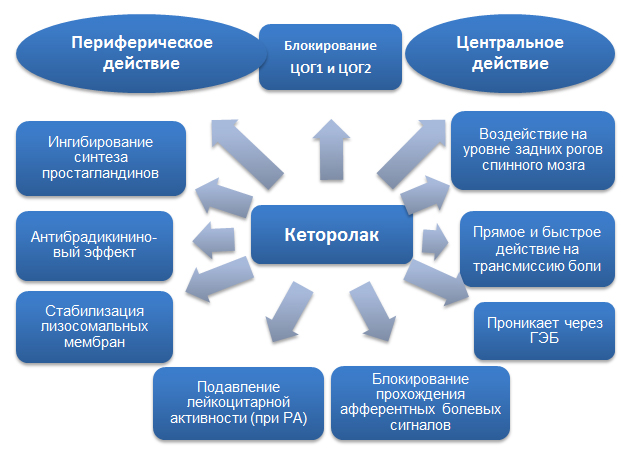
Рис.1. Механизм действия кеторолака.
Анальгетическая эффективность кеторолака была высоко оценена при применении в послеоперационном периоде, как в стационарных, так и в амбулаторных условиях. После больших абдоминальных, ортопедических или гинекологических оперативных вмешательств применение кеторолака обеспечивало эффективное уменьшение болевого синдрома от легкой до выраженной интенсивности у большинства пациентов подобно стандартным дозам морфина и приводило к уменьшению использования опиатов. Преимущество кеторолака перед наркотическими анальгетиками выражается в отсутствии влияния на функцию дыхания, седативного и психомоторного эффектов. Кеторолак также может использоваться для обезболивания у пациентов с почечной коликой, мигренью, головной болью, мышечной болью и др. Парентеральное введение кеторолака уменьшает боль у пациентов с онкологической патологией.
В Северной Америке, Великобритании и некоторых других европейских странах кеторолак является единственным парентеральным НПВП, использующимся для лечения острого болевого синдрома. Показано, что при введении 30 мг препарата он оказывает действие сравнимое с эффектом 10-12 мг морфина или 50 мг мепередина [Верткин А.Л. и др., 2006].
Основное направление использования кеторолака – это обезболивание при травмах и в послеоперационном периоде.
Побочные эффекты кеторолака обусловлены влиянием на ЦОГ и представлены специфическими эффектами класса НПВП. Большинство клинически значимых побочных эффектов связано с воздействием на ЖКТ, почечную и гематологическую функцию. Частота развития побочных эффектов при применении кеторолака составляет 2,7 %. Наиболее часто встречаются диспепсические симптомы. Тяжелые побочные симптомы (геморрагические осложнения, нарушение функции почек, острая анафилаксия) встречаются значительно реже [Верткин А.Л. и др., 2006]. Результаты большого ретроспективного постмаркетингового исследования с привлечением более 20000 пациентов показало, что общий относительный риск желудочно-кишечных кровотечений у кеторолака сравним с опиатами, но заметно возрастает при использовании высоких его доз в течение более 5 дней, особенно у пожилых людей. Признаки почечной недостаточности, которые могут возникнуть при применении высоких доз кеторолака, как правило, проходят самостоятельно после отмены препарата и не требуют дополнительных мер. Как и другие НПВП, кеторолак также может вызвать аллергические реакции или реакции гиперчувствительности. Применение кеторолака противопоказано при реакциях гиперчувствительности, гиповолемии, тяжелой почечной и печеночной недостаточности, пептических язвах, язвенной болезни желудка и двенадцатиперстной кишки, нарушениях гемостаза, беременности, родах, кормлении грудью и детям до 16 лет [Helin-Salmivaara A. et al., 2006].
Таким образом, кеторолак – сильный обезболивающий препарат с профилем переносимости подобным другим НПВП. При использовании его в соответствии с принципами действующих руководств, препарат является серьезной альтернативой опиатам.
Высокая анальгетическая активность и наличие различных форм препарата (инъекционная, таблетированная,) позволяет широко использовать кеторолак в практике травматолога: от обезболивания при ушибах и растяжениях в виде геля до аналгезии при больших оперативных вмешательствах, в том числе эндопротезировании крупных суставов. Об эффективности кеторолака может свидетельствовать тот факт, что Национальная футбольная лига (НФЛ) Северной Америки использует кеторолак в оральной или инъекционной форме для лечения повреждений опорно-двигательного аппарата и предотвращения послематчевой болезненности. В 2001 году было проведено исследование эффективности кеторолака в профессиональном спорте [Tokish, 2002] на основании данных его использования в командах НФЛ в течение сезона 2001. Результаты исследования показали, что 28 из 30 команд, которые были опрошены, использовали кеторолак. Введение кеторолака в день игры использовали 93 % опрошенных, 1-2 дня у 50-75 % игроков. Примечательно, что медицинский персонал НФЛ отмечал, что инъекционный кеторолак более мощный анальгетик, чем другие НПВС. В целом, в исследовании установлено, что использование кеторолака было безопасным и эффективным, результаты этого исследования привели к значительному расширению использования кеторолака среди спортсменов, в частности футболистов [ Matava M., 2012]. Основной задачей при острой травме остается необходимость прямого и быстрого поступления обезболивающего вещества в зону травмы. В условиях стадиона или гостиничного номера в случае спортивной травмы применение инъекционной формы препарата часто затруднительно. Быстрота наступления эффекта после перорального приема позволяет эффективно использовать таблетированную форму препарата в качестве системной аналгезии, кеторолак в аппликационной форме позволяет обеспечить поступление препарата непосредственно в травмированную зону. Дополнительное применение локальных форм препарата приводит к более значительному снижению интенсивности болевого синдрома, а также дает возможность сократить длительность приема таблетированных и инъекционных форм [Пастернак Д.В., 2014].
Особенности действия нимесулида. Среди ЦОГ-2 селективных препаратов наиболее исследованным остается нимесулид (4-нитро-2-феноксиметансульфонамид) – уникальный противовоспалительный препарат, отличающийся от большинства НПВП. Нимесулид – первый представитель нового класса селективных ингибиторов ЦОГ-2, представленных на мировом рынке. Он используется в клинической практике с 1985 г., когда впервые появился на фармацевтическом рынке Италии, а в настоящее время это лекарственное средство зарегистрировано более чем в 50 странах мира. Нимесулид наиболее часто назначаемый НПВП в Италии, Португалии, Франции [Mathew S., Devi G., Prasanth V., 2011]. Препарат был разработан в Швейцарии фирмой Helsinn Healthcare в 1980 году, в 1994 году было доказано преобладающее влияние нимесулида на ЦОГ-2, и подтверждено, в дальнейшем, многочисленными исследованиями. Воздействие на ЦОГ-1 осуществляется преимущественно в очаге воспаления, что обеспечивает дополнительный противовоспалительный эффект, а отсутствие влияния на ЦОГ-1 желудка и почек, в свою очередь, обусловливает высокий профиль безопасности [Барскова В.Г., 2011].
Препарат имеет высокую биодоступность, быстро и полностью всасывается из ЖКТ [Барскова В.Г., 2011]. После приема первой дозы в течение 30 мин достигается 25-80 % максимальной концентрации, в это же время, в среднем, наступает его анальгетический эффект. В синовиальной жидкости максимальная концентрация достигается аналогично концентрации в крови. Доказано, что фармакокинетика препарата не зависит от пола и возраста больного.
Механизмы действия нимесулида . Влияние нимесулида обусловлено класс-специфическими механизмами, характерными для большинства НПВП и эффектами именно нимесулида. Как и все представители класса, нимесулид обладает противовоспалительным, обезболивающим и жаропонижающим действием. Препарат снижает концентрацию короткоживущего ПГН2, из которого под действием ПГ-изомеразы образуется ПГЕ2. Уменьшение концентрации ПГЕ2 ведет к снижению степени активации простаноидных рецепторов ЕР-типа, что реализуется в анальгетический и противовоспалительный эффекты. Препарат обратимо подавляет образование ПГЕ2 не только в очаге воспаления, но и в восходящих путях ноцицептивной системы, включая пути проведения болевых импульсов в спинном мозге. На ЦОГ-1 нимесулид действует незначительно и, практически, не препятствует образованию ПГЕ2 из арахидоновой кислоты в физиологических условиях, благодаря чему снижается количество побочных эффектов препарата (рис. 1).
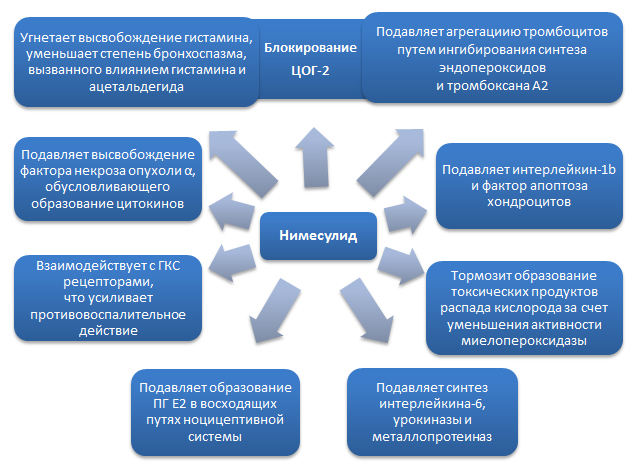
Рис. 1. Механизмы действия нимесулида .
Нимесулид подавляет агрегацию тромбоцитов путем ингибирования синтеза эндопероксидов и тромбоксана А2, подавляет синтез фактора агрегации тромбоцитов, подавляет высвобождение гистамина, а также уменьшает степень бронхоспазма, вызванного воздействием гистамина и ацетальдегида. Нимесулид ингибирует высвобождение фактора некроза опухоли α, который обусловливает образование цитокинов. Показано, что нимесулид способен подавлять синтез интерлейкина-6 и урокиназы, металлопротеиназ (эластазы, коллагеназы), замедляя разрушение протеогликанов и коллагена хрящевой ткани. Кроме того, нимесулид подавляет интерлейкин-1β и фактор апоптоза хондроцитов [Воробьева О.В., 2010].
Нимесулид обладает антиоксидантными свойствами, тормозит образование токсических продуктов распада кислорода за счет уменьшения активности миелопероксидазы, влияет на продукцию и действие окислительных радикалов, а также других компонентов нейтрофильной активации, что усиливает противовоспалительный и анальгетический эффекты и снижает вероятность гастро-интестинальной ульцерогенности. Взаимодействие нимесулида с ГКС рецепторами и активация их путем фосфорилирования усиливает противовоспалительное действие препарата.
Б езопасност ь нимесулида. Нимесулид хорошо переносится, что выгодно отличает его от многих других представителей группы НПВП. Большинство побочных эффектов нимесулида являются класс-специфичными и зависят, в определенной степени, от фармакокинетики препарата.
Наиболее частым осложнением для всего класса НПВП является влияние на слизистую оболочку ЖКТ. Изучению этого явления посвящено большое количество исследований. В исследовании F. Bradbury, где проведена оценка частоты осложнений со стороны ЖКТ при применении диклофенака (n = 3553), нимесулида (n = 3807) и ибупрофена (n = 1470) в реальной клинической практике, суммарная частота этой патологии при использовании нимесулида была существенно меньше в сравнении с диклофенаком (12,1 %) и не отличалась от таковой при использовании ибупрофена (8,1 и 8,6 %) [Bradbury F., 2004]. Итальянские исследователи A. Conforti et al. провели анализ 10608 сообщений о серьезных побочных явлениях, связанных с приемом различных НПВП с 1988 по 2000 год. Оказалось, что нимесулид был причиной развития тех или иных осложнений со стороны ЖКТ в 2 раза реже, чем другие НПВП. Таким образом, количество нежелательных явлений при применении нимесулида составило 10,4 %, диклофенака – 21,2 %, кетопрофена – 21,7 %, пироксикама – 18,6 % [Conforti A., Leone R., Moretti U. et al., 2001]. Риск развития желудочно-кишечного кровотечения при использовании нимесулида в реальной клинической практике оценивался в масштабном эпидемиологическом исследовании J. Laporte et al. Согласно полученным результатам, относительный риск кровотечения для нимесулида составил 3,2, для диклофенака – 3,7, мелоксикама – 5,7, а рофекоксиба – 7,2 [28].
Гастроинтестинальная безопасность нимесулида обусловлена отсутствием влияния на ЦОГ-1 и химическими свойствами препарата. Большинство традиционных НПВП по химической структуре – кислоты, которые повышают проницаемость тонкого кишечника. Это является дополнительным, не связанным с угнетением синтеза ПГ, механизмом развития гастропатии. Нимесулид, напротив, имеет слабые кислотные свойства и не накапливается в слизистой оболочке желудка и кишечника. Кроме того, нимесулид снижает продукцию окислительных радикалов и лейкотриенов, а также выброс гистамина из тучных клеток, чем создает дополнительную протекцию слизистой оболочки ЖКТ. В многочисленных клинических исследованиях при различных заболеваниях костно-мышечной системы доказано, что подавляющее большинство побочных реакций для нимесулида со стороны ЖКТ транзиторные, слабо выраженные и слабо коррелируют с ульцерогенным эффектом. Двойное слепое исследование с использованием гастродуоденоскопии показало, что применение нимесулида в дозе 100 или 200 мг в течение 7 дней не приводило к изменениям слизистой оболочки по сравнению с плацебо. Таким образом, можно констатировать, что нимесулид крайне редко вызывает тяжелые гастроинтестинальные осложнения, что особенно важно для лиц старших возрастных групп.
Принципиальное значение для оценки безопасности нимесулида имеет опыт его длительного применения. Так, в работе P. Locker et al. 199 больных с ОА получали нимесулид (200 мг/д) или этодолак (600 мг/д) в течение 3 мес. Терапевтический потенциал нимесулида оказался выше: его действие оценили как «хорошо» или «отлично» 80 % больных, в то время как препарату сравнения аналогичную оценку дали только 68 % больных. При этом, хотя этодолак относится к селективным НПВП и считается препаратом с очень хорошей переносимостью, количество побочных эффектов в обеих группах лечения не отличалось. В масштабном исследовании Huskisson et al. нимесулид (200 мг/д) или диклофенак (150 мг/д) были назначены 279 пациентам с ОА, причем продолжительность терапии составила 6 мес. Эффективность препаратов, которую оценивали по динамике самочувствия больных и функциональному индексу Лекена, оказалась фактически одинаковой. Однако нимесулид существенно превосходил диклофенак по переносимости: появление побочных эффектов со стороны ЖКТ регистрировалось в 36 и 47 % больных соответственно (p<0,05). В настоящее время наиболее длительным и большим рандомизированным двойным слепым исследованием нимесулида остается работа W. Kriegel et al. В этом исследовании определялись эффективность и безопасность нимесулида (200 мг/д) и напроксена (750 мг/д) у 370 больных с ОА в течение 12 мес. Как и в работе Huskisson, эффективность обоих препаратов оказалась сопоставимой. Количество осложнений при использовании нимесулида также оказалось меньшим: суммарно 47,5 % (54,5 % – у пациентов, получавших напроксен). Очень важно, что ни в одной из трех представленных работ не зафиксировано значимого повышения частоты кардиоваскулярных осложнений на фоне длительного приема нимесулида.
Применение нимесулида связано с низкой частотой аллергических реакций. Нимесулид обладает также дополнительными эффектами, которые реализуют его гипоаллергенность, в частности, он подавляет фосфодиэстеразу IV, редуцирует выброс гистамина из базофилов и тучных клеток. Эти дополнительные свойства позволяют рассматривать нимесулид как альтернативный противовоспалительный препарат для пациентов с реакциями гиперчувствительности на традиционные НПВП [Воробьева О.В., 2010].
Обсуждая вопросы безопасности нимесулида, необходимо остановиться на риске гепатотоксических реакций. В последние годы проблема гепатотоксичности НПВП активно обсуждается в мировой литературе. По данным многолетней статистики, тяжелые гепатотоксические осложнения развиваются примерно у 1 из 10 тыс. больных [Каратеев А.Е., 2009]. Что касается нимесулида, то за период 15 летнего применения этого препарата в мировой клинической практике (~ 50 разных стран за период с 1985 по 2000 год) всего отмечено 192 эпизода значимых осложнений со стороны печени. Учитывая, что к 2000 г. нимесулидом было пролечено 280 млн. больных, суммарная частота опасных гепатотоксических реакций, таким образом, составляет менее 0,1 эпизода на 100 тыс. пролеченных больных. Однако, контролирующие органы ряда европейских стран, последней из которых была Ирландия, прекратили использование нимесулида на своей территории, обосновывая свое решение статистическими данными спонтанных сообщений о тяжелых гепатотоксических реакциях. Тем не менее EMEA (European Medicines Agency ) – основной орган Европейского союза, обеспечивающий контроль над оборотом лекарственных препаратов в Европе, после обсуждения сложившейся ситуации не нашел достаточных оснований для прекращения использования нимесулида (пресс-релиз от 21.09.07 г.). Очень важно, что в этом документе, как отметили авторы обзора по нимесулиду Mattia C.C. et. al. (2010), содержится признание того факта, что гепатотоксичность нимесулида не выше гепатотоксичности многих других НПВП, активно применяющихся в Европе [Каратеев А.Е., 2009]. При этом было принято компромиссное решение: рекомендовать использование нимесулида в странах Европы ограниченным курсом (не более 15 дней) в дозе, не превышающей 200 мг/д. Действительно, результаты рандомизированных клинических исследований показывают, что отрицательная динамика изменений лабораторных биохимических показателей, свидетельствующих о повреждении печени, отмечается при использовании нимесулида с такой же частотой, как и на фоне приема других НПВП.
Очередное обсуждение вопроса гепатотоксичности нимесулида было проведено медицинским руководством Евросоюза 23 июня 2011 г. Решение EMEA вновь подтвердило основные положения, обозначенные в пресс-релизе от 21.09.2007 г. Преимущества нимесулида при кратковременном использовании с целью уменьшения острой боли явно превышают его недостатки и оправдывают его дальнейшее использование.
На основании проведенного анализа можно сделать вывод, что краткосрочное применение нимесулида в лечении пациентов с ОА эффективно и оправдано, а вероятность развития нежелательных явлений при применении данного лекарственного средства не превышает риск подобных осложнений при приеме других НПВП.
Таким образом, нимесулид – уникальный представитель класса НПВП, быстро и эффективно уменьшает болевой синдром за счет действия не только на ЦОГ-2, но и непосредственно на элементы ноцицептивной системы.







