Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ: СОСТОЯНИЕ ПРОБЛЕМЫ"
Автор: Дядык А.И., Багрий А.Э., Цыба И.Н., Цыба Н.Ю.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Кардиология, Семейная медицина/Терапия
Просмотров: 1 692
Дата проведения: с 03.11.2014 по 03.11.2015
Определение
Инфекционный эндокардит (ИЭ) – заболевание инфекционной природы с первичной локализацией возбудителя на эндокардиальной поверхности (клапаны сердца, пристеночный эндокард), эндотелии аорты и крупных сосудов, а также на внутрисердечных искусственных материалах (протезированные клапаны, электрокардиостимулятор, имплантированный кардиовертер-дефибриллятор).
Актуальность проблемы
ИЭ является серьезной медицинской и социальной проблемой, что аргументируется:
– нарастанием распространенности ИЭ в последние 3–4 десятилетия, обус-ловленным постарением населения, широким использованием инвазивных методов лечения и диагностических исследований, увеличением количества оперативных вмешательств на сердце (прежде всего имплантаций искусственных клапанов) и применением кардиостимуляторов и кардиовертеров-дефибрилляторов, увеличением числа больных, находящихся на гемодиализе, нарастающим количеством внутривенных наркоманов и ВИЧ-инфицированных больных;
– значительными трудностями ранней диагностики ИЭ, особенно у больных с его первичными формами, при которых правильный диагноз при первом обращении к врачу устанавливается в 19–34% случаев, а средние сроки его установления составляют 1,5–2,0 месяца и более, что объясняется широкой вариабельностью как инфекционных агентов, приводящих к развитию заболевания, так и его клинических проявлений;
– сохраняющейся высокой летальностью, несмотря на существенные достижения в диагностике и применение мощных антибактериальных средств;
– отсутствием широкомасштабных контролируемых исследований, посвященных изучению эффективности различных лечебных подходов (фармакологических и хирургических), а также выбору контингента лиц, нуждающихся в проведении первичной и вторичной профилактики заболевания.
Эпидемиология ИЭ
За последние пять десятилетий существенно изменился эпидемиологический профиль ИЭ, прежде всего в индустриально развитых странах. Если до 50-60-х гг. XX века ИЭ в молодом и среднем возрасте наблюдался у больных с ревматическим поражением клапанного аппарата сердца и с врожденными пороками сердца, то в настоящее время удельный вес заболевания существенно увеличился у пожилых (особенно при дегенеративных поражениях клапанного аппарата), у больных сахарным диабетом 2-го типа, при пролапсе митрального клапана, а также без поражений клапанов. Прогрессивно нарастает количество больных с внутрисердечными искусственными материалами (протезированные клапаны, кардиостимуляторы, кардиоверторы-дефибрилляторы), больных с терминальной стадией почечной недостаточности, получающих диализную терапию, а также число внутривенных наркоманов и ВИЧ-инфицированных лиц, которые относятся к группам высокого риска развития ИЭ.
Частота ИЭ значимо различается в различных странах и составляет 3-10 случаев на 100000 человеко-лет, что в определенной мере объясняется различными методологическими подходами, используемыми в эпидемиологических исследованиях. В целом в экономически развитых странах наблюдается существенное прогрессирующее увеличение частоты ИЭ с возрастом: у лиц старше 70 лет она составляет 14,5 случая на 100000 человеко-лет. По данным большинства эпидемиологических исследований, ИЭ чаще болеют мужчины, соотношение мужчин и женщин составляет 2 : 1.
Этиология ИЭ. Стратегические особенности лечебных подходов в зависимости от возбудителя.
Инфекционные агенты, ведущие к развитию ИЭ, характеризуются широким разнообразием. Среди них превалируют стрептококки, энтерококки и стафилококки, выявляемые при рутинном бактериологическом исследовании в 85% случаев ИЭ.
А. ИЭ, обусловленные стрептококками и энтерококками
Оральная (ранее viridans) форма стрептококка, представляющая группу микроорганизмов, включающую S.sanguis, S.salivarius, S.mutans и Gemella morbillorum. Почти всегда стрептококки этой группы чувствительны к пенициллину. Следует выделить группу стрептококков, включающую S.milled, или группу S.anginosus (S.anginosus, S.intermedins иS.constellatus), так как им присуще формирование абсцессов и гематогенная диссеминация. S.bovis чувствительны к пенициллину, подобно оральным стрептококкам. К энтерококкам, вызывающим ИЭ, относятся Е.faecalis , E.faecium и Е.durans.
Б. ИЭ, обусловленные стафилококком
Традиционно S.aureus считается ведущим патогеном, вызывающим развитие ИЭ нативных клапанов. S. aureus обычно чувствителен к оксациллину. Коагулазонегативный стафилококк (КНС), вызывающий развитие ИЭ протезиро- ванных клапанов, резистентен к оксациллину. В недавно проведенных исследованиях показано, что S.aureus может вызвать ИЭ протезированных клапанов, а КНС – нативных клапанов.
Другие возбудители ИЭ
А. Грамотрицательные бациллы группы НАСЕК (Haemophilus parаinfluenzae, H.aphrophilus, H.paraphrophilus, H.influenzae, Actinobacillus actinomycete micomitans и др.), а также бруцелла и грибы относятся к инфекционным агентам, вызывающим развитие ИЭ. При этом результаты посева крови могут быть отрицательными.
Б. Еще одна группа инфекционных агентов состоит из таких внутриклеточных бактерий, как Coxiella burnetii, Bartonella, Chlamydia, составляющих около 5% среди всех случаев ИЭ. У таких больных всегда наблюдается отрицательный результат посева крови, а диагноз устанавливается на основании серологических тестов клеточных культур или генной аппликации.
Патофизиология ИЭ
Нормальный эндотелий клапанов и эндокард резистентны к колонизации и инфицированию. Развитие ИЭ является результатом сложного взаимодействия между циркулирующими патогенами и поврежденным эндотелием / эндокардом. Целый ряд факторов, включая механическое повреждение, обусловленное турбулентным движением крови, контактом с электродами или катетерами, а также воспалением (например, ревматический кардит) или дегенеративными изменениями у пожилых, ассоциируется с развитием повреждения, формированием микроязв и микротромбов. Нарушение целостности эндотелия / эндокарда запускает нормальные процессы заживления, включающие экспозицию экстрацеллюлярных матриксных протеинов, продукцию тканевого фактора, депозицию фибрина и тромбоцитов на поверхности эндотелия, что приводит к формированию небактериального тромботического эндокардита, являющегося высоким фактором риска адгезии микроорганизмов, их колонизации и развития ИЭ. Локальное эндотелиальное воспаление, индуцирующее экспрессию интегринов семейства β-эндотелиальными клетками, может также способствовать развитию ИЭ. Интегрины, являющиеся трансмембранными протеинами, способны присоединять экстрацеллюлярные детерминанты к клеточному цитоскелету. Интегрины семейства β присоединяют циркулирующий фибронектин к эндотелиальной поверхности. В то же время S. aureus и некоторые другие патогены, вызывающие ИЭ, несут на своей поверхности фибронектин-связывающие протеины. Следовательно, когда активированные эндотелиальные клетки присоединяют фибронектин, они создают адгезивную поверхность для циркулирующих стафилококков и других патогенов. Адгезированные стафилококки активно проникают в эндотелиальные клетки клапанов, где они персистируют и «спасаются» от защитных механизмов организма и антибиотиков, размножаются и распространяются на соседние отделы сердца и близлежащие органы.
Таким образом, существует по меньшей мере два сценария развития первичного инфицирования клапана: первый включает физическое повреждение эндотелия / эндокарда с последующим инфицированием поврежденной поверхности, второй – развитие ИЭ на неповрежденной эндокардиальной поверхности при инфицировании S.aureus и некоторыми другими патогенами.
Роль транзиторной бактериемии
Слизистые десен, рта, глотки, желудочно-кишечного тракта, уретры всегда содержат различную микрофлору. В процессе физиологической активности (жевание, чистка зубов), при локальных воспалениях, а также различных инвазивных лечебных и диагностических вмешательствах наблюдается транзиторная бактериемия. При этом риск инфицирования клапанного аппарата зависит от продолжительности и интенсивности бактериемии, частоты ее эпизодов, вида микроорганизмов и их способности поражать клапаны, а также особенностей защитных механизмов организма. В связи с этим важное место в профилактике ИЭ должны занимать гигиенические мероприятия в ротовой полости, а также проведение инвазивных диагностических процедур и лечебных внутривенных инфузий по строгим показаниям.
Пролиферация бактерий в вегетациях
Микроорганизмы, адгезируемые к вегетациям, стимулируют дальнейшую депозицию фибрина и тромбоцитов на их поверхности. В связи с этим в вегетациях интенсивно размножаются патогены.
Классификация инфекционных эндокардитов
ИЭ характеризуются широким разнообразием этиологии, патофизиологии, локализации, возраста больных, клинических проявлений, осложнений и ответа на антибактериальную терапию, а также наличием или отсутствием интракардиальных искусственных материалов. В связи с этим, важное место в диагностике и тактике ведения больных ИЭ отводится классификационным системам. Приведем классификацию ИЭ, рекомендуемую Европейской ассоциацией кардиологов.
Классификация инфекционных эндокардитов
I. Локализация ИЭ, наличие или отсутствие интракардиальных искусственных материалов:
– левосторонний ИЭ нативных клапанов (ИЭНК);
– левосторонний ИЭ протезированных клапанов (ИЭПК):
а) ранний ИЭПК: ≤ 1 года после операции;
б) поздний ИЭПК: ≥ 1 года после операции;
– правосторонний ИЭНК;
– вторичный ИЭ.
II. Условия, в которых развился ИЭ:
– ИЭ, связанный с медицинскими вмешательствами:
а) нозокомиальный – проявления ИЭ наблюдаются в течение 48 часов и более после поступления в стационар;
б) ненозокомиальный – проявления ИЭ наблюдаются в течение 48 часов и меньше после поступления в стационар у лиц с ранее проводимыми медицинскими или инвазивными диагностическими вмешательствами:
1) лица, получающие амбулаторное лечение или внутривенные (в/в) инфузии, гемодиализную или в/в химиотерапию в сроки менее 30 дней до начала ИЭ;
2) госпитализированные в отделения интенсивной терапии менее чем за 90 дней до начала ИЭ;
3) резиденты домов престарелых;
– ИЭ, развившийся у лиц, находящихся в коллективах. Его проявления начинаются менее чем за 48 часов до поступления в стационар при отсутствии каких-либо предшествующих медицинских и диагностических вмешательств;
– ИЭ, развившийся у внутривенных наркоманов, не имеющих других источников инфицирования.
III. Активность ИЭ:
– ИЭ с персистирующей лихорадкой и положительными результатами посева крови;
– гистологические доказательства активности ИЭ.
IV. Рецидивы ИЭ:
– обострения: повторные эпизоды ИЭ, вызываемые одним и тем же инфекционным агентом ≤ 6 месяцев от начала заболевания;
– реинфицирование:
а) инфицирование другими патогенами;
б) повторныеэпизоды ИЭ, вызванные одним и тем же патогеном в течение 6 месяцев и более oт начала заболевания.
Диагностика ИЭ
Диагностика ИЭ часто довольно затруднительна, что обусловлено широким спектром инфекционных агентов, клинических, инструментальных и лабораторных проявлений, возрастом больных, наличием или отсутствием предшествующих заболеваний сердца. В связи с этим заслуживают внимания и представляют клинический интерес ряд предложений Европейской ассоциации кардиологов, изложенных в рекомендациях, посвященных профилактике, диагностике и лечению ИЭ, которые приводятся в таблице 1.
Таблица 1. Алгоритм диагностики ИЭ
|
ИЭ следует подозревать в следующих клинических ситуациях: |
|
1) Новый регургитационный шум в сердце |
|
2) Тромбоэмболия неизвестного происхождения |
|
3) Сепсис неизвестного происхождения (особенно в случаях, ассоциированных с инфекционными агентами, часто выявляемыми при ИЭ) |
|
4) Наличие лихорадки – наиболее частое проявления ИЭ в следующих ситуациях:* – интракардиальные искусственные материалы (протезированные клапаны, кардиостимуляторы, имплантированные кардиовертеры-дефибрилляторы, хирургические заплаты); – ИЭ в анамнезе; – приобретенные или врожденные пороки сердца; – другие факторы риска (состояние иммунодефицита, частые в/в инфузии различных лекарственных препаратов); – недавние инвазивные медицинские или диагностические вмешательства, ассоциируемые с бактериемией; – наличие застойной сердечной недостаточности; – вновь возникшие нарушения проводимости; – положительный посев крови на наиболее частый патоген ИЭ или положительные результаты серологического исследования на хроническую лихорадку Q (микробиологические данные могут предшествовать кардиальным симптомам); – сосудистые или иммунологические феномены: тромбоэмболии, пятна Рота, точечные кожные геморрагии, поражения Janeway, узелки Ослера; – очаговые неспецифические неврологические симптомы; – наличие легочных тромбоэмболий/инфильтраций (правосторонний ИЭ); – наличие периферических абсцессов различной локализации (почки, селезенка, головной мозг, спинной мозг). |
Примечание: *- лихорадка может отсутствовать у пожилых, при предыдущем применении антибиотиков, иммунодефицитных состояниях, а также ИЭ, вызванном атипичными патогенами.
Как видим, ИЭ ассоциируется с широким разнообразием клинических проявлений, в связи с чем больные нередко обращаются к врачам различной специальности и им выставляются различные диагнозы, включающие хронические инфекционные заболевания, системные заболевания соединительной ткани, системные васкулиты, новообразования, туберкулез и др.
Микробиологическая диагностика
Положительные посевы крови остаются краеугольным камнем в диагностике ИЭ и дают возможность определить чувствительность патогенов к антибактериальной терапии. Для выявления возбудителя достаточно трех проб (включая по меньшей мере одну аэробную и одну анаэробную), содержащих по 10 мл крови, полученной из периферической вены в стерильных условиях. Следует избегать забора крови из загрязненного центрального венозного катетера из-за высокой вероятности получения ложноположительных результатов (чаще всего – стафилококковой инфекции). При ИЭ бактериемия почти всегда персистирующая, в связи с чем нет необходимости в заборе крови на высоте лихорадки, так как фактически все пробы (или большинство из них) положительные. Поэтому при наличии одной положительной пробы следует с осторожностью подходить к установлению диагноза ИЭ.
Хотя ИЭ редко вызывается анаэробами, пробы крови должны инкубироваться как в аэробных, так и в анаэробных условиях для выявления таких патогенов, как Bacteroides или Clastridium.
ИЭ с отрицательными посевами крови
Частота ИЭ с отрицательными пробами крови (ИЭОПК) в различных сообщениях широко колеблется в пределах 2,5–31%. При отрицательных результатах пролонгируются своевременное установление диагноза и проведение адекватной антибактериальной терапии. ИЭОПК чаще всего наблюдается у лиц, принимавших до посева крови антибиотики, что требует их отмены и проведения в последующем повторных исследований гемокультур. Кроме того, отрицательные результаты гемокультур наблюдаются у больных с ИЭ, вызванными патогенами с ограниченной способностью к пролиферации в обычных средах. К этой категории больных относятся лица с протезированными клапанами, искусственными водителями ритма, почечной недостаточностью, иммунодефицитными состояниями.
Гистологические / иммунологические исследования
Морфологическое исследование резецированной ткани клапанов или эмболических фрагментов остается золотым стандартом в диагностике ИЭ, а также идентификации патогена посредством специальных окрашиваний препарата и использования иммунологических методов, а следовательно, назначения адекватной антибактериальной терапии.
Молекулярные биологические методики
Полимеразная цепная реакция (ПЦР) позволяет быстро устанавливать патогены у больных с ИЭ, трудно выявляемые при рутинных методиках. Хотя ПЦР рассматривается в качестве большого диагностического критерия ИЭ, нет основания считать, что данная методика вытеснит из клинической практики общедоступную и информативную методику, каковой является посев крови (гемокультура). Проведение ПЦР показано для исследования ткани клапанов или эмболов у больных ИЭ при отрицательных посевах крови.
Трансторакальная и трансэзофагеальная эхокардиография
Трансторакальная и трансэзофагеальная эхокардиография (ТТЭ и ТЭЭ соответственно) рассматривается как фундаментальный инструмент в диагностике ИЭ и оценке эффективности терапии. При подозрении на ИЭ эхокардиография должна проводиться незамедлительно. Рекомендуемая стратегия проведения исследования представлена на рисунке 1.
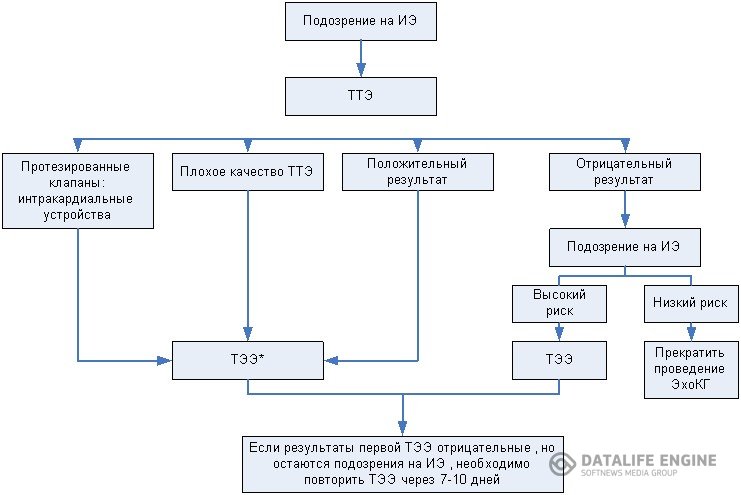
Рисунок 1. Стратегия проведения эхокардиографического исследования при подозрении на ИЭ .
Примечания: ТТЭ – трансторакальная эхокардиография; ТЭЭ – трансэзофагеальная эхокардиография; * – проведение ТЭЭ не обязательно при изолированном правостороннем ИЭ и несомненных доказательствах признаков ИЭ, по данным ТТЭ.
Выполнение ТЭЭ показано: (1) если наличие ИЭ предполагается по данным ТТЭ; (2) если результат ТТЭ не позволяет диагностировать ИЭ, но клинически вероятность наличия ИЭ кажется достаточно высокой; (3) если имеется плохое ультразвуковое окно; (4) если у больного имеются протезы клапанов или имплантированные кардиальные электронные устройства. У лиц с низкой клинической вероятностью ИЭ отрицательные результаты ТТЭ высокого качества позволяют не проводить ТЭЭ. Основным эхокардиографическим критерием ИЭ являются вегетации (рис. 2), абсцессы (рис. 3) и нарушения в работе искусственных клапанов.
Чувствительность ТТЭ в диагностике ИЭ составляет 40–63%, а ТЭЭ – 90–100%. Эхокардиографическая диагностика ИЭ затруднительна у больных с имплантированными искусственными материалами. Идентификация вегетаций сложна у лиц с предшествующими тяжелыми органическими поражениями клапанного аппарата (ревматические пороки сердца, особенно при кальцификации клапанных структур, дегенеративные кальцифицированные поражения, пролапс митрального клапана), а также при очень маленьких вегетациях (≤ 2 мм).
Образования, напоминающие вегетации при ИЭ, наблюдаются при миксоматозных и дегенеративных поражениях клапанов, системной красной волчанке (эндокардит Либмана–Сакса), ревматоидном артрите, первичном антифосфолипидном синдроме, вальвулярном тромбозе, опухолевых процессах (марантический эндокардит, разрыв хорд, маленькие интракардиальные опухоли (фиброэластома), что следует учитывать при диагностике ИЭ.
Часто сложно идентифицировать маленькие абсцессы, особенно на ранних стадиях заболевания, в постоперационном периоде, а также у больных с протезированными клапанами (особенно митральными). В таблице 2 показаны анатомические и эхокардиографические характеристики, присущие ИЭ.
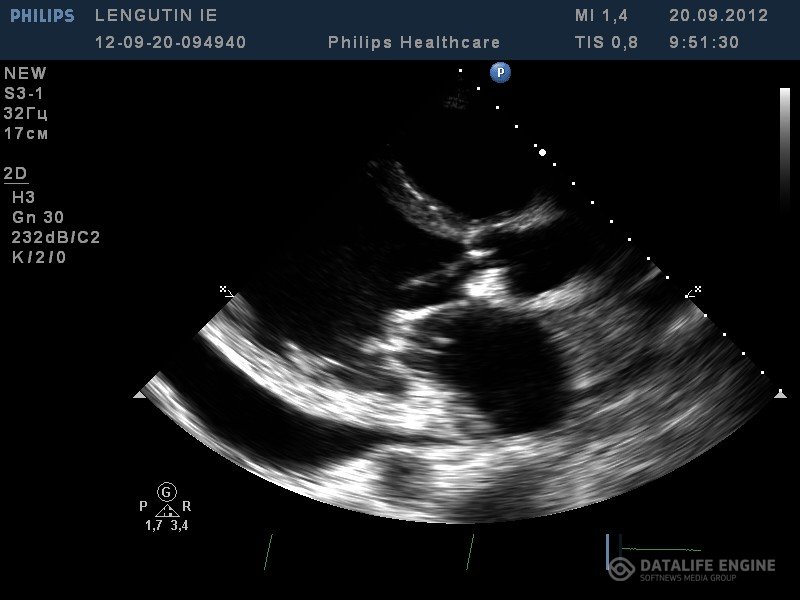
Рисунок 2. ИЭ, ТТЭ. Вегетации на створках аортального клапана
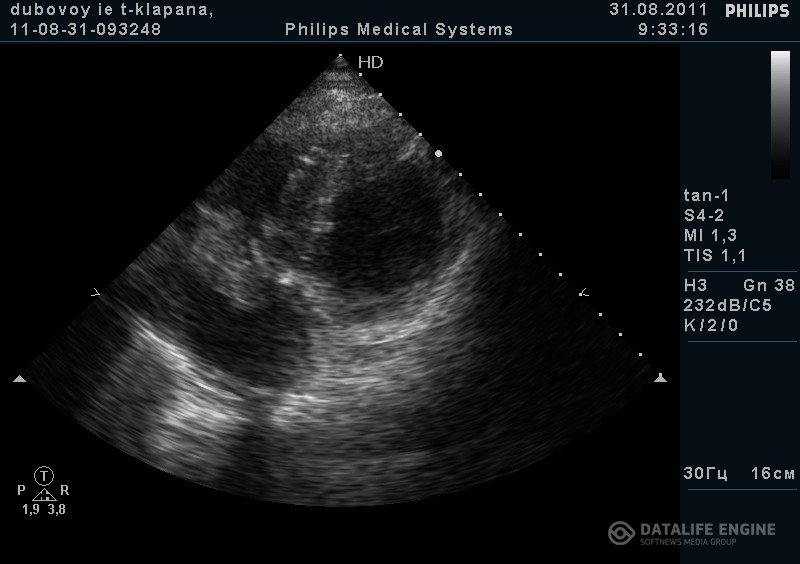
Рисунок 3. ИЭ, ТТЭ. Паравальвулярный абсцесс
Таблица 2. Анатомические и эхокардиографические характеристики ИЭ
|
Характе-ристики |
Хирургические/аутопсийные |
Эхокардиографические |
|
Вегетации |
Инфицированные массы, прикрепленные к эндокардиальным структурам или имплантированным искусственным материалам. |
Осциллирующие или неосциллирующие интракардиальные образования на клапанах или других интракардиальных структурах, или имплантированном интракардиальном материале. |
|
Абсцессы |
Перивальвулярные полости с некротическим и гнойным материалом, не соединяющимся с кардиоваскулярными полостями. |
Утолщенные негомогенные перивальвулярные плотные или осциллирующие участки. |
|
Псевдоаневризмы |
Перивальвулярные полости, соединенные с кардиоваскулярными полостями. |
Пульсирующие перивальвулярные участки с повышенной или сниженной эхогенностью и наличием в них самостоятельного потока, устанавливаемые в цветном Допплеровском режиме. |
|
Перфорации |
Нарушение целостности эндокардиальной ткани. |
Нарушение целостности эндокардиальной ткани с постоянным потоком через них, устанавливаемым в цветном Допплеровском режиме. |
|
Фистулы |
Сообщения между двумя соседними участками через перфорацию. |
Наличие постоянного потока между двумя соседними полостями через перфорацию. |
|
Клапанные аневризмы |
Мешковидные выпячивания вальвулярной ткани. |
Мешковидные выпячивания вальвулярной ткани |
|
Развитие дисфункции протезированных клапанов |
Нарушение смыкания элементов протезированных клапанов. |
Паравальвулярная регургитация на протезированных митральных клапанах. |
Диагностические критерии ИЭ
Важное место в диагностике ИЭ отводится модифицированным критериям Duke, базирующимся на клинических, эхокардиографических и микробиологических данных, которые следует использовать в тесной связи с полноценной клинической оценкой больного. Чувствительность и специфичность критериев Duke составляют около 80 %.
В таблице 3 показаны модифицированные критерии Duke, адаптированные J. S. Li.
Таблица 3 . Модифицированные критерии диагностики ИЭ Duke (адаптировано из J.S. Li et al.)
|
Большие критерии |
|
Положительные посевы (культуры) крови при ИЭ: – типичные для ИЭ микроорганизмы, установленные в двух раздельных пробах крови: Viridans streptococci, Streptococcus bovis, группа НАСЕК, S. aureus или распространенные в общей популяции энтерококки при отсутствии первичного инфекционного очага; или – персистирующее наличие микроорганизмов, характерных для ИЭ, при неоднократных посевах крови: по меньшей мере две положительные пробы, проведенные с 12-часовым интервалом или все три, или ≥ 4 раздельных проб (с первичной и последней пробами по меньшей мере в течение одного часа); или – однократный положительный посев крови на Coxiella burnetii титр антител Ig G фаза 1 ≥ 800. |
|
Доказательства эндокардиального поражения: – наличие характерных для ИЭ эхокардиографических параметров: вегетации, абсцессы, вновь возникшие нарушения функции (несмыкание) структур протезированного клапана; – вновь возникшая вальвулярная регургитация |
|
Малые критерии |
|
– предрасположенность: предрасполагающие заболевания сердца, частые в/в инфузии, в/в наркоманы; – лихорадка (повышение температуры тела выше 38˚); – сосудистые феномены: артериальная эмболия, септические полиморфные инфаркты, микотические аневризмы, интракраниальные геморрагии, коньюнктивальные геморрагии, пятна Janeway; – иммунологические феномены: гломерулонефрит, узелки Ослера, пятна Рота, ревматоидный фактор; – микробиологические доказательства: положительная культура крови, не соответствующая большим критериям или наличие серологических тестов активности инфекции, вызванной микроорганизмами, характерными для ИЭ. |
|
Диагноз считается определенным при наличии: – 2 больших критериев, – 1 большого и трех малых критериев, – 5 малых критериев; Диагноз ИЭ считается возможным при наличии: – 1 большого критерия и 1 малого или – 3 малых критериев |
Клиническая картина
Клинические проявления ИЭ характеризуются многообразием, что обусловлено возможным вовлечением в патологический процесс всех органов и систем. Четыре ведущих патологических процесса включают: 1) инфекционное поражение клапанов или прилежащих к ним отделов, или имплантированного искусственного клапана; 2) эмболизацию; 3) инфекционные метастатические процессы, обусловленные персистирующей бактериемией; 4) клинические проявления, являющиеся результатом иммунопатологических процессов.
Важное место в своевременной диагностике ИЭ отводится тщательно собранному анамнезу с обязательным выяснением факторов риска: наличие приобретенных или врожденных пороков сердца, имплантированных искусственных материалов, предшествующих в/в инфузий (особенно введения наркотиков) или инструментальные инвазивные исследования (фиброгастроскопия, цистоскопия, ангиография и др.); оперативные вмешательства, гнойные процессы различной локализации (фурункулез, панариций, паронихий, абсцессы), диализные процедуры (гемодиализ, перитонеальный диализ), иммунодефицитные состояния, перенесенный ранее ИЭ. В ряде случаев ИЭ развивается среди полного здоровья без указаний на наличие вышеперечисленных факторов риска. Приблизительно в 80% случаев имеют место предшествующие поражения клапанного аппарата различного генеза или врожденные пороки сердца; у 15–20% больных предшествует экстракция зуба или другие стоматологические вмешательства (преимущественно стрептококковая инфекция); у 20–30% больных с энтерококковым ИЭ имеет место инфекция мочевой системы или инвазивные процедуры на мочеполовой системе.
Интервал между вмешательствами, ведущими к бактериемии, и симптомами ИЭ довольно вариабелен и нередко составляет около двух недель.
Время установления диагноза ИЭ от первоначальных проявлений заболевания широко колеблется (от нескольких дней до месяцев), что зависит от вида патогена, возраста пациента, особенностей клинических проявлений, своевременного проведения необходимых диагностических тестов и ряда других факторов.
У подавляющего большинства больных уже на начальных этапах заболевания развивается комплекс симптомов: лихорадка ремиттирующего характера (более высокая температура днем и вечером), озноб, потливость (особенно в ночное время), артралгии, миалгии, анорексия, исхудание. Иногда развиваются септические артриты.
Лихорадка может отсутствовать приблизительно у 10 % больных: у пожилых, лиц с тяжелой сердечной или почечной недостаточностью или иммунодефицитом, а также у принимающих к моменту заболевания антибиотики.
Поражение сердца прежде всего включает поражения створок клапанного аппарата, ведущие к развитию недостаточности с развитием регургитации крови на вовлеченных в патологический процесс клапанах, что клинически проявляется появлением систолических шумов (при ИЭ митрального или трехстворчатого клапанов) или диастолических (протодиастолических) шумов при ИЭ аортального и пульмонального клапанов. При ИЭ чаще поражаются митральный и аортальный клапаны, реже – трикуспидальный и еще более редко – пульмональный клапан.
Абсцессы миокарда чаще наблюдаются при ИЭ протезированных клапанов. Они могут локализоваться на любых участках сердца, но чаще – в перивальвулярных районах.
Нарушения ритма и проводимости могут быть результатом отрыва вегетаций и их эмболизаций в коронарные артерии. Их частота довольно широко варьирует (от 3 до 25 %) в разных сообщениях.
Миокардиты часто ассоциируются с абсцедированием миокарда и могут быть одной из причин развития сердечной недостаточности.
Перикардиты чаще наблюдаются при стафилококковых ИЭ и являются результатом бактериемии или распространения инфекции из миокарда (прорыв из миокардиальных абсцессов).
Кожные пятна Дженевей ( Janeway ) наблюдаются приблизительно в 10% случаев и представляют плоские безболезненные геморрагические макулярные образования, локализующиеся преимущественно на ладонях и подошвах.
Пятна Рота ( Roth ) наблюдаются приблизительно в 10% случаев и представляют пятнистые бледные овальные образования с периферическим гемор- рагическим ободком размером в несколько миллиметров, локализующиеся в сетчатке.
Спленомегалия выявляется у 40–60% больных ИЭ и ассоциируется с продолжительным течением заболевания.
Отдельного обсуждения требует целый ряд экстракардиальных клинических проявлений ИЭ, нередко определяющих характер течения и прогноз заболевания. Ряд авторов обозначает эти клинические проявления как осложнения. Сердечная недостаточность, системные эмболии, неконтролируемая персистирующая инфекция являются такими проявлениями. Они рассматриваются отдельно, так как среди лечебных подходов при них определенное место отводится различным оперативным вмешательствам.
Сердечная недостаточность (СН) является одним из наиболее частых и серьезных проявлений ИЭ и развивается в 50–60% случаев (чаще всего при ИЭ аортального клапана (АК) – 29% и несколько реже при ИЭ митрального клапана (МК) – 20%). Ведущими причинами развития СН являются развитие тяжелой митральной и аортальной недостаточности, интракардиальных фистул и реже обструкция клапанных отверстий крупными вегетациями. Клапанная регургитация может быть обусловлена перфорацией створок. У части больных развитие СН обусловлено миокардитом.
Клинические проявления СН могут включать одышку, кардиальную астму, отек легких, кардиогенный шок. Развитие СН при ИЭ является критерием риска госпитальной и 6-месячной летальности (особенно при несвоевременном протезировании пораженных клапанов). Терапией выбора является имплантация искусственных клапанов, показания к которой отражены в таблице 4.
Таблица 4 . Показания и сроки проведения операции при левостороннем ИЭ нативных клапанов
|
Рекомендации |
Сроки |
|
Сердечная недостаточность |
|
|
Аортальный или митральный ИЭ с тяжелой острой регургитацией или выраженной обструкцией клапанного отверстия, обусловившие развитие рефрактерной кардиальной астмы/отека легких или кардиогенного шока. |
Экстренно |
|
Аортальный или митральный ИЭ с фистулой в камеру сердца или в перикард, обусловившие развитие рефрактерной кардиальной астмы/отека легких или кардиогенного шока. |
Экстренно |
|
Аортальный или митральный ИЭ с тяжелой острой регургитацией или выраженной обструкцией клапанного отверстия и персистирующей сердечной недостаточностью, или эхокардиографическими признаками тяжелых гемодинамических нарушений (раннее закрытие МК и/или легочная гипертензия). |
Ургентно |
|
Аортальный или митральный ИЭ с тяжелой острой регургитацией без СН. |
Избирательно |
|
Предотвращение тромбоэмболий |
|
|
Аортальный или митральный ИЭ с большими вегетациями (≥10 мм) с одним и более эпизодами эмболий, несмотря на адекватную терапию антибиотиками. |
Ургентно |
|
Аортальный или митральный ИЭ с большими вегетациями (≥10 мм) и другими предикторами неблагоприятного течения заболевания (СН, персистирующая инфекция, абсцессы). |
Ургентно |
|
Изолированные большие вегетации ≥ 15 мм. |
Ургентно |
|
Неконтролируемая инфекция |
|
|
Локальная неконтролируемая инфекция (абсцессы, ложные аневризмы, увеличивающиеся вегетации) |
Ургентно |
|
Персистирующая лихорадка и положительная культура крови ≥ 7-10 дней, несмотря на проведение адекватной терапии антибиотиками. |
Ургентно |
|
Инфекция, вызванная грибами или мультирезистентными микроорганизмами. |
Ургентно |
Примечания : экстренно – хирургические вмешательства должны быть проведены в течение 24 часов; ургентно – хирургические вмешательства должны быть проведены в течение нескольких дней; избирательно – необходимость проведения хирургического вмешательства должна быть оценена после 1–3-недельной адекватной терапии антибиотиками.
Системные эмболии являются одним из частых и серьезных клинических проявлений ИЭ и обусловлены миграцией кардиальных вегетаций. Частота системных эмболий составляет 20–50%. Однако при своевременной и адекватной антибактериальной терапии риск заметно снижается до 6–21%. При левостороннем ИЭ наиболее частыми мишенями эмболий являются головной мозг, селезенка и почки. При правостороннем ИЭ нативных клапанов, а также ИЭ искусственных водителей ритма наблюдается легочная эмболия. Одним из серьезных проявлений эмболий головного мозга являются инсульты.
К факторам риска эмболий относятся крупные и мобильные вегетации, наличие вегетаций на МК, увеличение или уменьшение вегетаций при проведении антибактериальной терапии, инфицировании клапанов S.aureus, Streptococcus bovis, Candida spp., мультивальвулярный ИЭ, системные эмболии в анамнезе. Среди этих факторов наиболее серьезными являются размеры и мобильность вегетации. Наиболее высокий риск эмболий – при размере вегетаций ≥ 10–15 мм.
Риск эмболий остается высоким в первые дни проведения антибактериальной терапии и в последующем снижается, хотя при персистенции вегетаций (инфекции) сохраняется. Одним из лечебных подходов в превентировании эмболий является оперативное вмешательство, показания к которому отражены в таблице 4.
Персистирующая неконтролируемая инфекция является одной из серьезнейших проблем при ИЭ. Нередко при проведении специфической антибактериальной терапии происходит нормализация температуры. Персистенция лихорадки может быть обусловлена рядом причин, включающих перивальвулярное распространение инфекции, неадекватную антибактериальную терапию, резистентные патогены, локальную неконтролируемую инфекцию, системную эмболию, экстракардиальную локализацию инфекции, серьезные побочные эффекты антибиотиков.
Перивальвулярные осложнения включают формирование абсцессов, псевдоаневризм и фистул.
Перивальвулярные абсцессы развиваются при аортальном ИЭ (10–40%), при нативном вальвулярном ИЭ и очень часто – при протезированном ИЭ (56-100%). Формирование абсцессов является динамическим процессом, начиная с утолщения стенки аорты и распространяясь с формированием фистул.
Псевдоаневризмы и фистулы являются тяжелыми осложнениями ИЭ и часто ассоциируются с тяжелыми вальвулярными и перивальвулярными поражениями. Наиболее часто фистулы развиваются при ИЭ, вызванном S.aureus. Несмотря на оперативные вмешательства, при их развитии госпитальная летальность остается высокой.
Из других осложнений, обусловленных интракардиальным распространением инфекции, выделяют развитие септального внутрикардиального дефекта, полного атриовентрикулярного блока и острого коронарного синдрома.
Периваскулярное распространение инфекции следует предположить при персистенции лихорадки или развитии атриовентрикулярной блокады на фоне интенсивной антибактериальной терапии. В связи с этим при персистирующей неконтролируемой инфекции необходимо динамическое проведение не только эхокардиографии, но и электрокардиографии.
Наличие локальной неконтролируемой инфекции является показанием для раннего оперативного вмешательства.
Таким образом, клинические ситуации, включающие СН, системную эмболию и неконтролируемую персистирующую инфекцию, должны рассматриваться как состояния, при которых в лечебной тактике важное место занимает оперативное вмешательство.
Неврологические клинические проявления ИЭ
Неврологические проявления ИЭ наблюдаются в 20–40% случаев ИЭ и обусловлены главным образом эмболиями вегетаций. Их клинический спектр обширен и включает ишемические и геморрагические инсульты, транзиторные ишемические атаки, «тихий» церебральный эмболизм, симптоматические или бессимптомные инфицированные аневризмы, абсцессы мозга, менингит, токсическую энцефалопатию, судорожный синдром. Среди микроорганизмов, ассоциирующихся с неврологическими осложнениями, ведущее место занимает S.aureus. Развитие неврологических осложнений является предиктором неблагоприятного прогноза и основанием для назначения адекватных антибиотиков.
Лечебная тактика при неврологических осложнениях у больных ИЭ с неврологическими проявлениями (осложнениями)
– После «тихой» церебральной ишемии или транзиторной ишемической атаки рекомендуется хирургическое вмешательство (без промедления), если име- ются показания;
– при интракраниальных геморрагиях хирургическое вмешательство должно быть отсрочено по меньшей мере на месяц;
– нейрохирургическое вмешательство или эндоваскулярная терапия показаны при очень больших, увеличивающихся или разорвавшихся интракраниальных аневризмах;
– после инсульта возможно без промедления хирургическое вмешательство по поводу СН, неконтролируемой инфекции, абсцессов, высокого эмболического риска;
– наличие интракраниальных аневризм должно быть исключено у каждого больного ИЭ при наличии неврологической симптоматики (компьютерная томография (КТ), магнитно-резонансная томография (МРТ));
– при подозрении на наличие интракраниальных аневризм и отрицательных результатов КТ и МРТ показано проведение ангиографии.
Другие клинические проявления ИЭ
Инфицированные аневризмы
Инфицированные (микотические) аневризмы (ИА) являются результатом септических артериальных эмболий в интралюминальное пространство или vasa vasorum или распространения инфекции через сосудистую интиму. Наиболее часто ИА локализуются интракраниально. Их клинические проявления довольно вариабельны и включают фокальный неврологический дефицит, головную боль, спутанность сознания, припадки. Разрывы аневризмы ассоциируются с крайне неблагоприятным прогнозом. При аневризмах крупного размера или их разрывах показано хирургическое вмешательство.
Поражение почек при ИЭ
Поражение почек при ИЭ характеризуется широким спектром и включает инфаркты и абсцессы почек, развитие гломерулонефритов (ГН) (мезангиопролиферативного или фокального полулунного), клинические проявления которого характеризуются протеинурией различной выраженности (от минимальной до большой), гломерулярной гематурией, цилиндрурией, ранним и прогрессирующим повышением уровня креатинина крови и снижением скорости клубочковой фильтрации. Частота развития ГН остается малоизученной, так как для его реальной диагностики необходимо прижизненное морфологическое исследование почек, проведение которого у большинства больных сопряжено с высоким риском различных осложнений. Развитие ГН ассоциируется с неблагоприятным прогнозом и развитием терминальной стадии почечной недостаточности, требующей проведения терапии, замещающей почки (гемо- или перитонеальный диализ, трансплантация почки).
Серьезной проблемой является развитие острого повреждения почек, частота которого достигает 30%. Его развитие носит мультифакторный характер и включает тяжелые гемодинамические нарушения, обусловленные СН, септическим шоком или послеоперационным состоянием, нефротоксическим эффектом антибиотиков, нефротоксическими эффектами контрастных агентов, используемых в диагностических целях, инфарктами и абсцессами почек. В части случаев острое повреждение почек носит обратимый характер, но прогрессирует в хроническое повреждение почек с развитием почечной недостаточности.
Мышечно-скелетные осложнения
У больных ИЭ часто наблюдаются артралгии, миалгии, боль в спине. Примерно в 14% случаев развиваются периферические артриты. При стрептококковом ИЭ нередко развивается пиогенный спондилодисцит, наличие которого тре- бует проведения длительной антибактериальной терапии.
Абсцессы селезенки
При ИЭ часто наблюдаются эмболии селезенки, но при этом развитие абсцессов наблюдается редко. Наличие абсцессов является показанием для длительной антибактериальной терапии, при отсутствии эффекта которой, а также при крупных абсцессах и разрывах селезенки необходима спленэктомия.
Правосторонний ИЭ
Частота правостороннего ИЭ составляет 5–10% в общей структуре ИЭ. Среди больных с правосторонним ИЭ преобладают внутривенные наркоманы. Развитие правостороннего ИЭ также наблюдается у больных с врожденными пороками сердца, имплантированными водителями ритма или кардиоверторами-дефибрилляторами, а также у лиц с центральными венозными катетерами.
При правостороннем ИЭ чаще поражается трикуспидальный клапан и значительно реже – пульмональный клапан. Доминирующим патогеном является S .aureus (в 60–90% случаев), а также у части больных – Pseudomonas aeruginosa, другие грамотрицательные микроорганизмы, грибы, энтерококки, стрептокок- ки и полимикробные инфекции.
Диагностика и клинические проявления правостороннего ИЭ
Обычными клиническими проявлениями правостороннего ИЭ являются персистирующая лихорадка, бакте риемия, множественные септические пульмональные эмболии, проявляющиеся болью и дискомфортом в грудной клетке, кашлем, кровохарканьем. Легочные септические эмболии могут осложняться легочными инфарктами, абсцессами, пневмотораксом и эмпиемой плевры. При выраженной недостаточности трехстворчатого клапана или значительном сужении отверстия трехстворчатого клапана, а также высоком давлении в легочной артерии при объективном исследовании на трехстворчатом клапане выслушивается пансистолический шум, усиливающийся на вдохе (симптом Риверо-Корвалло), определяются положительный венный пульс, пульсация печени. Как и в случае с левосторонним ИЭ, ведущее место в диагностике поражения трехстворчатого и пульмонального клапанов занимает эхокардиографическое исследование, причем ТЭЭ более информативна, чем ТТЭ.
Прогноз при правостороннем ИЭ
Прогноз при правостороннем ИЭ нативных клапанов относительно благоприятный (госпитальная летальность менее 10%). Неблагоприятными прогностическими признаками являются большие размеры вегетации (≥ 20 мм), фунгальная этиология ИЭ и наличие ВИЧ-инфекции.
Лечебная тактика при правостороннем ИЭ
I . Антимикробная терапия
Характер первоначальной эмпирической терапии определяется предполагаемым патогеном, видом наркотика или его растворителя у внутривенных наркоманов, а также локализацией эндокардита. Возможно сочетание правостороннего ИЭ с левосторонним.
Лечение включает или пенициллиназо-резистентные пенициллины, или ванкомицин. При комбинации правостороннего ИЭ с левосторонним высока вероятность стрептококковой или энтерококковой этиологии ИЭ, а следовательно, необходимо проведение специфической терапии. После установления характера патогена антибактериальная терапия требует коррекции.
Внутривенным наркоманам с ИЭ, обусловленным метициллинчувствительным S.aureus, показан пенициллиназо-резистентный пенициллиновый режим, который более эффективен, чем гликопептид-содержащие режимы. Представлены убедительные доказательства, что достаточен 2-недельный указанный антибактериальный лечебный подход без дополнительного назначения аминогликозидов. Двухнедельное применение оксациллина (или клоксациллина) с гентамицином или без него приемлемо в ситуациях, отвечающих следующим критериям:
— метициллинчувствительный S.aureus;
— хороший клинический эффект;
— отсутствие метастатических участков инфекции или эмпием;
— отсутствие кардиальных или экстракардиальных осложнений;
— отсутствие инфицирования протезированных клапанов или клапанов левого сердца;
— размер вегетаций ≤ 20 мм;
— отсутствие тяжелого иммунодефицитного состояния.
В связи с ограниченнной антибактериальной активностью, плохим проникновением в вегетации и увеличенным лекарственным клиренсом у внутривенных наркоманов в течение первых двух недель не следует использовать гликопептиды.
Стандартный 4–6-недельный режим следует проводить в следующих ситуациях:
1) медленный клинический или микробиологический ответ (≥ 96 часов) на антибактериальную терапию;
2) правосторонний ИЭ, осложненный правосторонней СН, вегетации ≥ 20 мм, острая респираторная недостаточность, септические метастатические фокусы вне легких (включая эмпиему) или экстракардиальные осложнения, включая острое повреждение почек или ГН;
3) терапия другими антибиотиками (не пенициллиназо-резистентными пенициллинами);
4) внутривенные наркоманы с тяжелым иммунодефицитом;
5) ассоциация правостороннего ИЭ с левосторонним.
При правостороннем ИЭ у внутривенных наркоманов, вызванном S.aureus, хороший клинический эффект может быть достигнут с помощью перорального применения ципрофлоксацина (по 750 мг 2 раза в сутки) в сочетании с рифампицином (по 300 мг 2 раза в сутки).
Для других микроорганизмов (не метициллинчувствительных) лечебные подходы у внутривенных наркоманов не отличаются от таковых у больных с ИЭ, не связанным с внутривенным приемом наркотиков.
II . Хирургические подходы
Обычно хирургическое лечение не используется при правостороннем ИЭ нативных клапанов. Рассмотрим клинические ситуации, при которых обсуждается необходимость оперативного лечения.
Показания для хирургического лечения правостороннего ИЭ:
– при микроорганизмах, резистентных к эрадикации (т.е. персистирующие грибы), или бактериемии ≥ 7 дней (т.е. S.ureus, P.aeruginosa), несмотря на проведение адекватной антимикробной терапии, или
– персистирующие клапанные вегетации ≥ 20 мм после повторных легочных эмболий с наличием правосторонней СН или без нее, или
– правосторонняя СН, обусловленная тяжелой трикуспидальной недостаточностью, при плохом ответе на диуретическую терапию.
ИЭ при врожденных пороках сердца
В последние десятилетия наблюдается увеличение распространенности врожденных пороков сердца (ВПС) среди детей и взрослых. Частота развития ИЭ при ВПС, по данным различных авторов, в 15–140 раз выше, чем в общей популяции. Риск развития ИЭ невысок при дефекте межпредсердной перегородки и существенно выше при дефекте межжелудочковой перегородки (особенно при ассоциации с аортальной недостаточностью). Среди микроорганизмов, вызывающих развитие ИЭ при ВПС, превалируют стрептококки и стафилококки. Клиническая картина при этом мало отличается от таковой у лиц с приобретенными пороками сердца, однако чаще наблюдается правосторонний ИЭ.
Лечение ИЭ у больных с ВПС включает общие стратегические подходы.
Кардиохирургическое вмешательство показано при отсутствии благоприятного эффекта от антимикробной терапии, при развитии серьезных гемодинамических нарушений или высоком риске септических тромбоэмболических осложнений.
Важное место в ведении больных с ВПС отводится профилактическим мероприятиям, которые описаны детально в разделе «Профилактика ИЭ».
Антимикробная терапия при ИЭ: принципы и методы
Общие принципы
Успех лечения ИЭ базируется на эрадикации микроорганизмов антимикробными препаратами. По показаниям проводится хирургическое удаление инфицированного материала или дренирование абсцесса. Роль защитных механизмов организма в эффективности антимикробной терапии ограничена. Этим объясняется более высокая эффективность бактерицидных лечебных режимов по сравнению с бактериостатической терапией, что продемонстрировано в эксперименте и в клинических исследованиях.
Аминогликозиды проявляют синергизм с ингибиторами клеточной стенки (т.е. β-лактамамии гликопептидами) относительно бактериальной активности и благоприятны для уменьшения продолжительности лечения (т.е. при оральных стрептококках) и решения эрадикационных проблем (т.е. Enterococcus spp.).
В таблицах 5–9 представлены стратегические подходы к антибактериальной терапии при ИЭ, вызванных различными патогенами, а также при особых клинических ситуациях, рекомендуемые экспертами Европейской ассоциации кардиологов.
Таблица 5. Антибиотикотерапия ИЭ, вызванного оральными стрептококками и стрептококками группы D.
|
Антибиотик |
Дозировки и путь введения |
Длительность (нед) |
|
Штаммы, полностью чувствительные к пенициллину (минимальная ингибирующая концентрация (МИК) <0,125 мг/л) |
||
|
Стандартное лечение |
||
|
Пенициллин G1 или |
12–18 млн ед/сут в/в в 6 приемов |
43 |
|
Амоксициллин2 или |
100–200 мг/кг/сут. в/в в 4-6 приемов |
43 |
|
Цефтриаксон 4 |
2 г/сут в/в или в/м в один прием |
43 |
|
Двухнедельное лечение 5 |
||
|
Пенициллин G или |
12–18 млн/сут в/в в 6 приемов |
2 |
|
Амоксициллин2 или |
1–200 мг/кг/сут в/в в 4-6 приемов |
2 |
|
Цефтриаксон4 в сочетании с |
2 г/день в/в или в/м в один прием |
2 |
|
Гентамицином6 или |
3мг/кг/сут в/в или в/м в один прием |
2 |
|
Нетилмицином |
–5 мг/кг в сут в/в в один прием |
2 |
|
У пациентов с аллергией на β-лактамы |
||
|
Ванкомицин7 или |
30 мг/кг/сут в/в в 2 приема |
43 |
|
Тейкопланин |
6 мг/кг в/в ч/з 12 ч. 1–4 сутки, затем 6 мг/кг/сут в/в или в/м в один прием |
43 |
|
Штаммы, частично чувствительные к пеницилинну (МИК 0,125-2,0 мг/л) |
||
|
Стандартное лечение |
||
|
Пенициллин G или |
24 млн. ед/сут в 6 приемов |
43 |
|
Амоксициллин2 в сочетании с |
200 мг/кг/сут в/в в 4-6 приемов |
43 |
|
Гентамицином6 |
3мг/кг/ сут в/в или в/м в1прием |
2 |
У пациентов с аллергией на β-лактамы |
||
|
Ванкомицин7 или |
30 мг/кг/сут в/в в 2 приема |
43 |
|
Тейкопланин в сочетании с |
6 мг/кг в/в ч/з 12 ч. 1–4 сутки, затем 6 мг/кг/сут в/в или в/м в один прием |
43 |
|
Гентамицином6 |
3мг/кг/сут в/в или в/м в один прием |
2 |
Примечания:
1 – предпочтителен у больных в возрасте > 65 лет или со сниженной функцией почек.
2 – или ампициллин, в тех же дозах.
3 – шестинедельная терапия при ИЭПК.
4 – предпочтителен для амбулаторной терапии.
5 – только при неосложненном ИЭ нативных клапанов.
6 – один раз в неделю должны быть проверены почечная функция и сывороточная концентрация гентамицина. При назначении препарата 1 раз в сутки концентрация перед очередным введением должна быть <1мг/л и концентрация после введения (пик; 1ч после инъекции) должна быть – 10-20 мг/л.
7 – сывороточная концентрация ванкомицина должна достигнуть 10-15 мг/л перед очередным введением и 30-45 мг/л после введения.
Таблица 6 . Антибиотикотерапия при стафилококковом ИЭ
|
Антибиотик |
Дозировка и путь введения |
Длительность, нед |
|
Нативные клапаны |
||
|
Метициллин-чувствительные стафилоккоки |
||
|
Флуклоксациллин или |
12 г /сут в 4-6 приемов |
4-6 |
|
Оксациллин в сочетании с |
||
|
Гентамицином1 |
3 мг/кг/сут в/в или в/м в 2-3 приема |
3-5 сут |
|
При аллергии на пенициллин или инфицировании метициллин-резистентными стафилококками |
||
|
Ванкомицин2 или |
30мг/кг/сут в/в в 2 приема |
4-6 |
|
Тейкопланин в сочетании с |
6 мг/кг в/в ч/з 12 ч. 1 – 4 сутки, затем 6 мг/кг/сут в/в или в/м в один приём |
4-6 |
|
Гентамицином1 |
3мг/кг/сут в/в в 2-3 приема |
3-5 сут |
|
Протезированны е клапаны |
||
|
Флуклоксациллин или |
12 г /сут в 4-6 приемов |
>6 |
|
Оксациллин в сочетании с |
>6 |
|
|
Рифампицином3 и |
1200мг/сут в 2 приема |
>6 |
|
Гентамицином4 |
3 мг/кг/сут в/в или в/м в 2-3 приема |
2 |
|
При аллергии на пенициллин или инфицировании метициллин-резистенными стафилококками |
||
|
Ванкомицин2 или |
30 мг/кг/сут в/в в 2 приема |
>6 |
|
Тейкопланин в сочетании с |
6 мг/кг в/в ч/з 12 ч. 1 – 4 сутки, затем 6 мг/кг/сут в/в или в/м в один прием |
>6 |
|
Рифампицином3 и |
1200 мг/сут в/в или per os в 2 приема |
>6 |
|
Гентамицином4 |
3 мг/кг/сут в/в или в/м в 2-3приема |
2 |
Примечания:
1 – преимущество добавления гентамицина не продемонстрировано. Его использование связано с увеличенной токсичностью и поэтому является необязательным.
2 – концентрация ванкомицина должна достигать 25-30 мг/л перед очередным введением.
3 – рифампицин увеличивает печеночный метаболизм варфарина и других препаратов. Рифампицин, как полагают, играет особую роль при инфекции кардиальных протезных материалов и электронных устройств, так как он позволяет ликвидировать бактерии, присоединенные к инородному веществу. Рифампицин должен всегда использоваться в комбинации с другим эффективным антистафилококковым лекарственным средством, чтобы минимизировать риск образования устойчивых мутантных штаммов.
4 – хотя клиническое преимущество гентамицина не было продемонстрировано, он остается рекомендованным для ИЭПК. Почечная функция и сывороточная концентрация гентамицина должны быть проверены 1 раз в неделю (дважды в неделю у больных с почечной недостаточностью). При трехразовом введении концентрация перед очередным введением должна быть < 1 мг/л. Концентрация после введения (пик, 1 час после инъекции) должна быть между 3-4 мг/л.
Таблица 7. Антибиотикотерапия ИЭ, вызванного Enterococcus spp.
|
Антибиотик |
Дозировка и путь введения |
Длительность, недели |
|
Бета-лактам и гентамицин-чувствительные стрептококки 1 |
||
|
Амоксициклин в сочетании с |
200 мг/кг/сут в/в в 4-6 приемов |
4-6 2 |
|
Гентамицином 3 |
3 мг/кг/сут в/в или в/м в 2-3 приема |
4-6 |
|
Или |
||
|
Ампицилин в сочетании с |
200 мг/кг/cyт в/в в 4-6 приемов |
4-6 2 |
|
Гентамицином 3 |
3 мг/кг/сут в/в или в/м в 2-3 приема |
4-6 |
|
Или |
||
|
Ванкомицин 4 или |
30 мг/кг/сут в 2 приема |
6 |
|
Тейкопланин в сочетании с |
6 мг/кг в/в ч/з 12 ч. 1–4 сутки, затем 6 мг/кг/сут в/в или в/м в один прием |
6 |
|
Гентамицином 3 |
3 мг/кг/сут в/в или в/м в 2-3 приема |
6 |
Примечания:
1 – высокий уровень резистентности к гентамицину (МИК>500мг/л): при чувствительности к стрептомицину заменить им гентамицин в дозе 15 мг/кг/сут в два приема. Или использовать более пролонгированый курс β-лактамной терапии. Комбинация ампициллина с цефтриаксоном была недавно предложена для гентамицин-резистентной Е. faecalis.
2 – β-лактамная резистентность: а) если обусловлена продукцией β-лактамазы, заменить ампициллин ампициллин-сульбактамом или амоксициллин амоксициллином-клавуланатом; б) если обусловлена альтерацией РВР5, использовать ванкомициновые режимы;
3 – мультирезистентность к аминогликазидам, β-лактамам и ванкомицину – возможны альтернативные подходы: а) линезолид 2 x 600 мг/сут в/в или перорально > 8 нед. (мониторировать гематологическую токсичность); б) квинупристин – дальфопристин 3 х 7,5 мг/кг/сут; в) β-лактамные комбинации, включающие имипенем плюс ампициллин или цефтриаксон плюс ампициллин > 8 недель;
4 – 6-недельная терапия показана для пациентов ИЭПК при наличии симптомов > 3 месяцев.
Таблица 8. Антибиотикотерапия ИЭ при отрицательных посевах крови
|
Патоген |
Предполагаемая терапия |
Результаты лечения |
|
Brucella spp. |
Доксициклин (200мг/сут) ко-тримоксазол(900мг/12ч) рифампицин (300-600 мг/сут) > 3 мес per os |
Лечение считается успешным при снижении титра антител до <1:60 |
|
Coxiella burnetii (лихорадка Q) |
Доксициклин (200мг/сут) гидроксихлорохин (200 – 600 мг/сут) per os или доксициклин (200мг/ сут) хинолон (офлоксацин, 400мг/сут) per os (лечение >18 мес) |
Лечение считается успешным при титре IgG<1:200, IgM и IgA< 1:50 |
|
Bartonella spp . |
Цефтриаксон (2 г/ сут) или ампициллин (амоксициллин) (12 г/сут) в/в или доксициклин (200 мг/сут) per os 6 нед гентамицин 3 мг/сут или нетилмицин в/в (3 нед) |
Ожидается успешное лечение у > 90 % пациентов |
|
Legionella spp. |
Эритромицин (3 г/сут в/в 2 нед), далее per os 4 нед рифампицин (300–1200 мг/сут) или ципрофлоксацин (1,5 г/сут) (6 нед per os) |
Оптимальное лечение неизвестно. Из-за высокой чувствительности должны быть включены хинолоны |
|
Mycoplasma spp. |
Новейшие фторхинолоны (>6мес) |
Оптимальное лечение неизвестно |
|
Tropheryma Whipplei (агент болезни Уипла) |
Ко-тримоксазол пенициллин G (1,2 МЕ/сут) и стрептомицин (1 г/сут в/в 2 нед), затем ко-тримоксазол per os (1 год) или доксициклин (200 мг/сут) гидроксихлорохин (200–600 мг/сут per os > 18 мес.) |
Длительная терапия, оптимальная длительность неизвестна |
Таблица 9. Предполагаемый режим антибактериальной эмпирической терапии для больных ИЭ (до или без идентификации инфекционного агента)
|
Антибиотик |
Дозировка и путь введения |
Длитель-ность, недели |
Комментарии |
|
Нативные клапаны |
|||
|
Ампициллин – сульбактам или |
12 г/сут в/в в 4 приема |
4-6 |
Пациентам с ИЭ при отрицательных посевах крови лечение должны проводить совместно со специалистом по инфекционным болезням |
|
Амоксициллина – клавуланат в сочетании с |
12 г/сут в/в в 4 приема |
4-6 |
|
|
Гентамицином |
3 мг/кг/сут в/в или в/м в 2-3 приема |
4-6 |
|
|
Ванкомицин или |
30 мг/кг/сут в/в в 2 приема |
4-6 |
Для пациентов, не переносящих β-лактамы |
|
Тейкопланин в сочетании с |
6 мг/кг в/в ч/з 12 ч. 1–4 сутки, затем 6 мг/кг/сут в/в или в/м в один прием |
4-6 |
|
|
Гентамицином в сочетании с |
3 мг/кг/сут в/в или в/м в 2-3 приема |
4-6 |
|
|
Ципрофлоксацином |
1000 мг/сут перорально в 2 приема или 800 мг/сут в/в в 2 приема |
4-6 |
Ципрофлоксацин не является универсально активным для Bartonella spp. Добавление доксициклина является вариантом выбора, если вероятно наличие Bartonella spp. |
|
Протезированные клапаны (ранний период – до 12 месяцев после операции) |
|||
|
Ванкомицин или |
30 мг/кг/сут в/в в 2 приема |
6 |
При отсутствии клинического ответа должна быть рассмотрена возможность хирургического вмешательства и, возможно, расширения спектра антибиотиков для грамотрицательной флоры. |
|
Тейкопланин в сочетании с |
6 мг/кг в/в ч/з 12 ч. 1–4 сутки, затем 6 мг/кг/сут в/в или в/м в один прием |
4-6 |
|
|
Гентамицином в сочетании с |
3 мг/кг/сут в/в или в/м в 2-3 приема |
2 |
|
|
Рифампицином |
1200 мг/сут перорально в 2 приема |
||
|
Протезированный клапан (поздний период ≥ 12 месяцев после операции) – те же подходы, что при нативных клапанах. |
|||
В таблице 5 суммированы рекомендуемые антибактериальные режимы при ИЭ, вызванном оральными стрептококками и стрептококками группы D.
Эмпирическая терапия
Лечение ИЭ должно быть начато незамедлительно. Перед назначением антибиотиков необходимо взять три пробы крови с интервалом 30 минут для изучения культуры.
Первоначальный подход к эмпирической терапии определяется рядом ситуаций, включающих:
– получал ли больной перед началом эмпирической антибактериальной терапии антибиотики;
– инфицированы ли нативные или протезированные клапаны (в последнем случае установить сроки протезирования).
Установить локальную эпидемиологическую обстановку (особенно резистентность к антибиотикам).
Грибы
Грибы наиболее часто наблюдаются при ИЭПК, у внутривенных наркоманов и у лиц с иммунодефицитом. Превалируют Candida и Aspergillus spp. Прогноз неблагоприятный – летальность достигает 50%.
Лечебная тактика включает комбинацию противогрибковой терапии и протезирование клапана. Обычно в лечебной тактике используются различные формы амфотерицина В с азолами или без них.
Профилактика ИЭ
В Рекомендациях экспертов Европейской ассоциации кардиологов подвергнуты ревизии ранее предлагавшиеся лечебные подходы, направленные на профилактику ИЭ, что представлено ниже:
1. Частота бактериемии после различных дентальных процедур широко варьирует (от 10 до 100%) в различных сообщениях, причем риск развития бактериемии существенно выше у лиц с плохим гигиеническим содержанием полости рта.
2. Критическая оценка преимуществ и недостатков профилактики:
– риск развития ИЭ после различных дентальных процедур в общей популяции составляет 1 : 14 000 000 и 1 : 95 000 у больных с ранее перенесенным ИЭ. Эти данные демонстрируют, что для профилактики единственного случая ИЭ необходимо проведение антибактериальной терапии у неоправданно большого количества лиц;
– только в минимальном проценте случаев антибактериальная профилактика ИЭ оправдана. При развитии ИЭ следует искать другие (не дентальные) источники бактериемии;
– применение антибиотиков ассоциируется с небольшим риском анафилаксии. Не опубликовано ни одного случая фатальной анафилаксии после применения амоксициллина для профилактики ИЭ;
– широкое необоснованное применение антибиотиков сопряжено с высоким риском развития резистентных микроорганизмов.
3. Недостаточная доказательная база, касающаяся эффективности профилактики ИЭ.
Исследования, посвященные оценке эффективности антибиотической профилактики в превентировании или снижении уровня бактериемии у людей после дентальных процедур, довольно противоречивы. Не получено убедительных доказательств, демонстрирующих, что снижение продолжительности или частоты бактериемии после любой медицинской процедуры уменьшает риск развития ИЭ.
Концепция эффективности антибиотической профилактики не изучена ни в одном проспективном рандомизированном исследовании, а длительное время предположения об ее эффективности базировались на малообоснованных мнениях экспертов, экспериментальных исследованиях, гипотезах и противоречивых результатах клинических наблюдений.
1. Больные с очень высоким риском развития ИЭ (табл. 10).
Антибактериальная профилактика сейчас не рекомендуется при пороках нативных клапанов, включая бикуспидальный аортальный клапан, пролапс митрального клапана и кальцифицированный аортальный стеноз.
Таблица 10. Заболевания сердца с самым высоким риском развития ИЭ, при которых рекомендуют профилактику в случае проведения процедур высокого риска
|
1. Пациенты с протезированным клапаном или протезным материалом, использованным для восстановления клапана. |
|
2. Пациенты, имевшие ИЭ ранее. |
|
3. Пациенты с врожденными пороками сердца: – врожденный порок сердца с цианозом, без хирургической коррекции или остаточными дефектами, паллиативными шунтами или сообщениями; – врожденный порок сердца с полной коррекцией с протезным материалом, имплантированным или хирургически, или путем чрескожного вмешательства, в течение 6 мес после процедуры; – в случаях, когда на месте имплантации протезного материала или устройства, имплантированных хирургически или путем чрескожного вмешательства, сохраняется остаточный дефект. |
|
Антибиотикопрофилактика больше не рекомендована при других формах клапанных пороков или врожденных пороков сердца |
2. Процедуры высокого риска (табл. 11 и 12)
Таблица 11. Рекомендации по антибактериальной профилактике у пациентов высокого риска развития ИЭ в зависимости от типа манипуляции
|
А. Стоматологические процедуры |
|
Профилактическое применение антибиотиков рекомендовано при всех стоматологических процедурах с вовлечением тканей десны, или периапикальной области зуба (эндодонтическом лечении зубов), или наличия повреждения слизистой оболочки полости рта |
|
Профилактическое применение антибиотиков не рекомендовано при введении местного анестетика в неинфицированные ткани, удалении швов, рентгеновском исследовании зубов, постановке или удалении ортодонтических конструкций |
|
Профилактика также не рекомендована в период смены молочных зубов, а также при травме губ. |
|
Б. Манипуляции на дыхательных путях |
|
Профилактическое применение антибиотиков не рекомендовано при манипуляциях на дыхательных путях, включая бронхоскопию или ларингоскопию, трансназальную или эндотрахеальную интубацию. |
|
В. Гастроинтестинальные и урогенитальные процедуры |
|
Профилактическое применение антибиотиков не рекомендовано при гастроскопии, колоноскопии, цистоскопии и трансэзофагальной эхокардиографии |
|
Г. Кожа и мягкие ткани |
|
Профилактическое применение антибиотиков не рекомендовано при любых манипуляциях |
Таблица 12. Рекомендации по профилактике развития ИЭ при стоматологических вмешательствах у больных группы высокого риска
|
Ситуация |
Антибиотик |
Одна доза за 30–60 мин до процедуры |
|
|
взрослые |
дети |
||
|
Аллергии на пенициллин или ампициллин нет |
Амоксициллина клавуланат или ампицилин* |
2 г перорально или в/в |
50 мг/кг перорально или в/в |
|
Аллергия на пенициллин или ампициллин |
Клиндамицин |
600 мг перорально или в/в |
20 мг/кг перорально или в/в |
Примечание: цефалоспорины не следует применять у больных с анафилаксией, ангионевротическим отеком, крапивницей после приема пенициллина или ампициллина. В качестве альтернативы взрослым назначают 2 г цефалексина, а детям – 50 мг/кг цефазолин или цефтриаксон по 1 г/кг м.т. в/в и по 50 мг/кг м.т. в/в детям .
Прогноз ИЭ
Несмотря на существенные достижения в диагностической технологии (широкое клиническое использование ТТЭ, ТЭЭ, КТ, МРТ), улучшения антимикробной селекции и мониторирования антимикробной терапии, а также параллельные успехи в хирургических подходах, частота осложнений и летальность при ИЭ остаются высокими. Так, один из пяти больных умирает при первой госпитализации в клинику; 10-летняя выживаемость составляет 60–90%, а 15–20-летняя летальность – около 50%.
Определенным объяснением этому является изменение спектра патогенов и их вирулентности, изменение удельного веса лиц с высоким риском развития ИЭ (старение населения, увеличение числа внутривенных наркоманов и лиц с иммунодефицитом), а также существенное повышение числа больных с наличием синтетических материалов в сердце и сосудах (протезированные клапаны, искусственные водители ритма, кардиоверторы-дефибрилляторы, сосудистые протезы). Кроме того, серьезной проблемой остаются трудности диагностики и запоздалая диагностика ИЭ, а следовательно – несвоевременная терапия, а также сложности в прогнозировании характера течения, развития обострений, установлении исхода ИЭ и неадекватность антимикробной терапии.
В связи с этим представляются важными своевременная диагностика больных ИЭ и проведение адекватной антимикробной терапии, позволяющей у части больных достигнуть нормализации температуры и отчетливого улучшения общего состояния. Обычно у таких больных прогноз благоприятный. В то же время персистирующая лихорадка является неблагоприятным прогностическим фактором и часто требует хирургического вмешательства.
В многочисленных исследованиях изучены факторы риска неблагоприятного исхода ИЭ. По ряду параметров точки зрения неоднозначны и требуют уточне ния.
Заслуживают внимания результаты исследования S. Wallace et al., посвященного изучению роли различных факторов в исходе ИЭ. Авторами изучены факторы, ассоциируемые с госпитальной и отдаленной (6-месячной) летальностью у 208 больных с ИЭ. Госпитальная летальность составляла 18%, а отдаленная – 27%. Факторами, ассоциируемыми с высоким риском отдаленной и госпитальной летальности, оказались патологические уровни лейкоцитов периферической крови, низкие концентрации альбуминов крови, повышенные сывороточные значения креатинина, нарушения ритма и проводимости, наличие двух больших критериев Duke или крупных (> 1 см) вегетаций. В то же время не отмечено заметного влияния на выживаемость, продолжительность заболевания до поступления в стационар, половой принадлежности, возраста, вовлеченных в патологический процесс клапанов, характера патогена и состояния функции левого желудочка.
Рецидивы: обострения ИЭ или реинфицирование
Выделяют два варианта рецидивов ИЭ – обострение и реинфицирование. Термин «обострение» означает повторный эпизод ИЭ, вызванный тем же самым патогеном, обусловившим первый эпизод заболевания. Реинфицирование подразумевает повторное развитие ИЭ, вызванное другим патогеном. Обострения ИЭ обычно наблюдаются в течение первых шести месяцев после достижения ремиссии; реинфицирование характеризуется более длительными сроками рецидива ИЭ.
К факторам, ассоциирующимся с обострением ИЭ, относят:
– неадекватную антибактериальную терапию (препарат, доза, продолжительность);
– резистентность микроорганизмов (Brucella spp., Legionella spp., Chlamydia spp., Mycoplasma spp., Mycobacterium spp., Bartonella spp., Coxiella Burnetii, грибы);
– полимикробную инфекцию при ИЭПК;
– эмпирическую антимикробную терапию при отрицательной гемокультуре;
– перианулярные инфекции;
– ИЭПК;
– персистирующие метастатические фокусы инфекции (абсцессы);
– резистентность к общим антибактериальным режимам;
– персистирующую лихорадку.
Риск реинфицирования повышен у больных с перенесенным ИЭ, в связи с чем такие лица требуют строгого подхода к вторичной профилактике ИЭ. Чаще реинфицирование имеет место у внутривенных наркоманов, при ИЭПК, у больных, находящихся на программном гемодиализе, а также у лиц с высоким риском развития ИЭ.
У больных с реинфекцией высокий риск летальных исходов, и они обычно нуждаются в протезировании пораженного клапана (клапанов).
Анализ многочисленных исследований, посвященных оценке влияния различных факторов на прогноз ИЭ, позволяет оценить их место в исходе заболевания.
К факторам неблагоприятного прогноза ИЭ относят:
1) клинические особенности больного:
– пожилой возраст;
– ИЭПК;
– коморбидность (сахарный диабет, сердечная недостаточность, почечная недостаточность, печеночная недостаточность, хроническое обструктивное заболевание легких и др.);
2) наличие осложнений ИЭ:
– рецидивы (обострения, реинфекция);
– перианулярное распространение инфекции;
– септические метастазы (абсцессы);
– сердечная недостаточность;
– тромбоэмболические осложнения;
3) эхокардиографические критерии:
– перианулярные осложнения;
– тяжелая левосторонняя клапанная регургитация;
– тяжелая недостаточность трехстворчатого клапана;
– низкая фракция выброса левого желудочка;
– легочная гипертензия;
– вегетации > 1 см;
– дисфункция клапанного протеза.
СПИСОК СОКРАЩЕНИЙ
ВПС – врожденный порок сердца
ГН – гломерулонефрит
ИЭ – инфекционный эндокардит
ИЭПК – инфекционный эндокардит протезированного клапана
MIC – минимальная ингибирующая концентрация
СН – сердечная недостаточность







