Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ОСТЕОАРТРОЗ У ПОЖИЛЫХ, ОСОБЕННОСТИ ЛЕЧЕНИЯ"
Автор: Поворознюк В.В., Дзерович Н.И.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Кардиология, Неврология, Ревматология, Семейная медицина/Терапия
Просмотров: 5 454
Дата проведения: с 01.06.2015 по 01.06.2016
Остеоартроз (ОА) – хроническое прогрессирующее дегенеративное заболевание суставов, характеризующееся деградацией суставного хряща с последующими изменениями в субхондральной кости и развитием краевых остеофитов, приводящее к потере хряща и сопутствующему поражению других компонентов сустава (синовиальная оболочка, связки).
При проведении Международной декады заболеваний костей и суставов (2000–2010) выделены следующие заболевания, имеющие наиболее важное медико-социальное значение для общества: остеоартроз, остеопороз, боль в нижней части спины, ревматоидный артрит, травматические повреждения. По влиянию на состояние здоровья ОА занимает в западных странах среди всех заболеваний четвертое место у женщин и восьмое у мужчин. Частота ОА прогрессирующе увеличивается с возрастом. В связи с существенным постарением населения, в том числе и украинской популяции, вопросы профилактики и лечения этого заболевания приобретают особую актуальность.
Медико-социальное значение. Остеоартроз – наиболее распространенная форма суставной патологии. В западных странах рентгенологические признаки ОА встречаются у большинства лиц старше 65 лет и приблизительно у 80% людей старше 75 лет. Приблизительно 11% лиц старше 60 лет имеют симптоматический (с клиническими проявлениями) ОА коленных суставов. Среди жителей США старше 30 лет симптоматический ОА коленных суставов встречается приблизительно у 6%, а симптоматический ОА тазобедренного сустава – приблизительно у 3% населения.
Из-за распространенности и частой нетрудоспособности, которая сопровождает заболевание при локализации в коленном и тазобедренном суставах, ОА обусловливает наибольшее количество проблем, связанных с ходьбой и подъемом по лестнице, чем какая-либо другая болезнь. ОА – наиболее частая причина эндопротезирования тазобедренного и коленного суставов.
Распространенность заболевания изучена при проведении эпидемиологических исследований. Частота остеоартроза увеличивается с возрастом, при этом очевидны половые различия. До 50-летнего возраста распространенность ОА в большинстве суставов выше у мужчин по сравнению с женщинами. После 50 лет у женщин по сравнению с мужчинами чаще наблюдается ОА коленных суставов, суставов кисти, стопы. В большинстве исследований ОА тазобедренного сустава чаще наблюдается у мужчин. В популяционных исследованиях частота и распространенность заболевания увеличивается в 2–10 раз за период от 30 до 65 лет и продолжает увеличиваться далее с возрастом.
ОА развивается преимущественно в среднем и пожилом возрасте, а в молодом возрасте может встречаться после перенесенных травм суставов, воспалительных процессов, у пациентов с врожденной патологией опорно-двигательного аппарата. C возрастом частота ОА существенно увеличивается. Так, если в возрасте до 29 лет болеет 8,4 человека на 1000 населения, в 30–39 лет – 42,1 на 1000 человек, 40–49 лет – 191, 9 на 1000 человек, 50–59 лет – 297,2 на 1000 человек, то в 60–69 лет – 879,7 на 1000 человек. Гонартроз у мужчин встречается более чем в 2 раза реже, чем у женщин, при этом женщины чаще страдают ОА коленного сустава (гонартроз), а мужчины – тазобедренного сустава (коксартроз). Хотя развитие ОА и не влияет на жизненный прогноз, заболевание является одной из основных причин преждевременной потери трудоспособности и инвалидности. Остеоартроз является одной из основных причин хронического болевого синдрома, значительно снижающего качество жизни пациентов.
Частота поражения отдельных суставов при ОА неодинакова. В одних исследованиях указывается на преобладание артроза мелких суставов кистей над остальными его локализациями, в других – артроза коленного сустава. В исследовании Института ревматологии АМН СССР обнаружено, что среди больных ОА наблюдалось более частое поражение коленных суставов (71,2%) и мелких суставов кистей (47,7%), а затем суставов стоп, включая голеностопные (23,3%) и позвоночника.
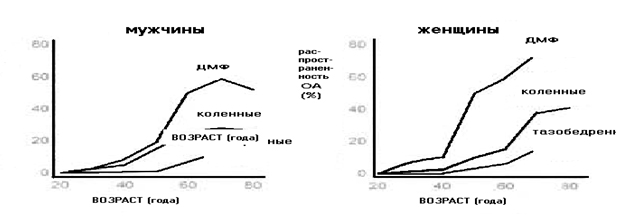
Рисунок 1. Распространенность остеоартроза в зависимости от возраста и локализации
Механизмы развития остеоартроза. Остеоартроз может быть диагностирован на основании клинических симптомов или патологических проявлений заболевания. В патологический процесс при ОА вовлекается весь сустав, который включает фокальную и прогрессивную потерю гиалинового суставного хряща с сопутствующими изменениями в субхондральной кости, развитием краевых разрастаний (остеофитов) и утолщением замыкательной костной пластинки (субхондральный склероз). Поражаются также мягкотканные структуры в суставе и вокруг него. Они включают синовиальную оболочку, на которой могут наблюдаться умеренные воспалительные инфильтраты, часто – измененные мышцы и связки, которые становятся «слабыми». Много людей с рентгенологическими признаками ОА не имеют никаких клинических признаков заболевания.
Различают две основные формы ОА: первичный, или идиопатический остеоартроз, этиология которого неизвестна, и вторичный, возникновение которого обусловлено нарушениями в суставе, вызванными воздействием известных этиологических факторов (воспалительных заболеваний, травм, врожденных или приобретенных анатомических деформаций, метаболических нарушений и др.).
В развитии ОА принимают участие многие факторы, при этом одни играют ведущую роль (физические нагрузки, микротравматизация, гипоксия и ишемия), а другие – предрасполагающую (гормональные, метаболические, инфекционно-аллергические факторы, возраст, гиподинамия).
Факторы риска, обусловливающие возможность развития ОА, условно подразделяются на три основные группы (табл. 1).
Таблица 1. Факторы риска развития остеоартроза
|
Генетические |
Приобретенные |
Факторы внешней среды |
|
|
|
Следует отметить, что факторы, ассоциирующиеся с поражением различных суставов (коксартроз, гонартроз и т.д.), могут существенно различаться.
Основу поражения при ОА составляют изменения в хрящевой ткани, важнейшая функция которой – адаптация сустава к механической нагрузке. При ОА происходит дегенерация и гибель хондроцитов, развивается деполимеризация основного вещества, продуцируемого ими, снижается количество гликозаминогликанов. Потеря протеогликанов ведет к уменьшению прочности хряща и его дегенерации. Ответная реакция костной ткани выражается в ее разрастании и образовании остеофитов.
Состояние эндокринного статуса организма является важным фактором возможного развития ОА. В настоящее время доказано, что гормональные влияния являются существенными регуляторами на этапах роста и развития хрящевой ткани, а хондроциты имеют специфические рецепторы к тироксину, инсулину, глюкокортикоидам, соматотропину, эстрадиолу, тестостерону. В экспериментальных условиях показано, что дисбаланс гормонов в организме приводит к изменению метаболизма хрящевой ткани, в связи с чем нарушения в эндокринной системе могут рассматриваться как фактор риска остеоартроза.
На сегодняшний день в мировой литературе ведется дискуссия о роли дефицита половых гормонов и менопаузы в развитии ОА. В 1940 году M. Silberberg, N. Silberberg показали, что введение животным экстракта гипофиза приводит к дистрофии суставных хрящей, а введение эстрогенов благоприятно влияет на их метаболизм. В 1966 году S. Seze и A. Ryskewaert высказали точку зрения о том, что нарушения в системе гипоталамус-гипофиз-яичники, особенно возникающие в постменопаузальном периоде, могут быть патогенетическим звеном в развитии ОА. В более поздних работах показано, что рецепторы к эстрогенам существуют в тканях сустава, а именно в синовиоцитах, хондроцитах, фибробластах, синовиальном эпителии, стенках сосудов сустава, суставной строме.
Большое значение в развитии ОА имеют иммунные нарушения. Разрушение протеогликанов хряща сопровождается развитием иммунных реакций клеточного и гуморального иммунитета. Сенсибилизация продуктов распада Т- и В-лимфоцитов проявляется повышенной выработкой лимфокинов и образованием иммунных комплексов, а также, возможно, образованием аутоантител к хрящевой ткани, ткани синовиальной оболочки. Это приводит к прогрессивному фиброзу синовиальной оболочки, патологическому изменению синовиальной жидкости, нарушению смазывания и питания хряща. Выработка неполноценной синовиальной жидкости поддерживает прогрессирование дегенеративных изменений в суставном хряще.
Важную роль в развитии катаболических процессов в хряще при ОА играют «провоспалительные» цитокины, особенно интерлейкин I (IL-I) и тумор-некротизирующий фактор α (ТНФ-α), которые активизируют ферменты, принимающие участие в протеолитическом повреждении хрящевой ткани. ОА развивается при условии превышения катаболизма (разрушения) хрящевой ткани над ее синтезом. Полагают, что коллагенолитические ферменты (металлопротеиназа -1, 8, 13) способствуют деструкции хряща.
Еще одним важным фактором, ведущим к более частому развитию ОА, являются избыточные нагрузки на суставы. Так, установлено, что чаще болеют лица, занятые тяжелым физическим трудом и со стажем работы более 5 лет. Кроме того, чаще всего при ОА в процесс вовлекаются нагрузочные суставы (коленные, тазобедренные), мелкие суставы кистей (дистальные и проксимальные межфаланговые суставы кистей) и позвоночник. Профессиональные нагрузки, связанные со сгибанием коленных суставов, сидением на корточках и хождением по лестницам связаны с более высоким риском развития ОА коленного сустава, в то время как поднятие тяжестей, тяжелая физическая работа связаны с риском развития коксартроза. Однако, оздоровительные физические упражнения, такие как бег, не увеличивают риск развития ОА при отсутствии биомеханических нарушений в суставах.
У людей с избыточной массой тела наблюдается высокая частота ОА коленных суставов. Потеря веса при ожирении может уменьшать риск развития ОА. В Фрименгеймском исследовании женщины, снизившие свой вес в среднем на 11 фунтов, уменьшили риск развития ОА коленных суставов на 50 %. Взаимосвязь увеличенной массы тела с остеоартрозом тазобедренных суставов менее выражена, чем при ОА коленных суставов. При этом одностороннее поражение тазобедренного сустава не связано с избыточным весом, в отличие от двусторонней локализации.
Перегрузка коленных и тазобедренных суставов ведет к повреждению хрящевой ткани и нарушениям в связочном аппарате, а также других поддерживающих структурах. Для каждого увеличения в массе на 1 фунт общая сила, действующая на коленный сустав в положении стоя на одной нижней конечности, увеличивается на 2–3 фунта. Это влияние избыточной нагрузки объясняет в большинстве случаев повышенный риск развития ОА коленных и тазобедренных суставов среди лиц с избыточным весом. В некоторых, но не в большинстве исследований, сообщено о взаимосвязи между избыточным весом и ОА кистей, предполагается, что метаболические нарушения могут выступать в роли посредника (например, диабет или нарушение липидного обмена), однако достоверно такой посредник не был обнаружен.
Классификация остеоартроза. В соответствии с Международной классификацией болезней Х пересмотра выделяют:
М15. Полиартроз. Включен: артроз более чем одного сустава.
М16. Коксартроз (артроз тазобедренного сустава).
М17. Гонартроз (артроз коленного сустава).
М18. Артроз первого запястно-пястного сустава.
М19. Другие артрозы.
Различают две основные формы ОА: первичный, или идиопатический остеоартроз, этиология которого неизвестна, и вторичный, возникновение которого обусловлено нарушениями в суставе, вызванными воздействием известных этиологических факторов (табл. 2).
Таблица 2. Классификация остеоартроза
| Первичный остеоартроз |
Вторичный остеоартроз и его причины |
|
Дегенеративный процесс развивается в здоровом суставном хряще, например, под влиянием чрезмерной функциональной нагрузки |
Дегенеративные процессы развиваются в измененном суставном хряще как следствие: · воспалительных заболеваний соединительной ткани; · травм (переломы, повреждения менисков, повторные микротравмы); · перегрузки сустава (профессиональные или спортивные перегрузки); · метаболических нарушений (акромегалия, гиперпаратиреоз, гемохроматоз и др.); · врожденных или приобретенных анатомических деформаций (дисплазия тазобедренных суставов, эпифизарная дисплазия); · некоторых заболеваний костей и суставов (асептический некроз, болезнь Педжета и др.) |
Выделяют такие специфические подклассы вторичного остеоартроза:
· эрозивный ОА кисти;
· моносуставной синовит коленного сустава;
· хондрокальциноз и остеоартрит.
По локализации различают следующие виды вторичного остеоартроза: моноартикулярный, олигоартикулярный, полиартикулярный.
Клинические проявления остеоартроза. Основные клинические симптомы ОА – боли и деформация суставов, приводящие к нарушению функции сустава. Варианты болевого синдрома при остеоартрозе коленного сустава приведены в таблице 1. Боли возникают при нагрузке на больной сустав, при ходьбе, уменьшаются в покое. Характерны вечерние и ночные боли после дневной нагрузки. Иногда боли в суставах усиливаются под влиянием метеорологических факторов (низкой температуры, высокой влажности и атмосферного давления и др.), вызывающих увеличение давления в полости сустава. Скованность при ОА длится до 30 мин в отличие от ревматоидного артрита (более часа).
Таблица 3. Варианты болевого синдрома при остеоартрозе (Мазуров В.И., Онущенко И.А., 2000)
|
Вариант болевого синдрома |
Клинические особенности |
Механические боли |
Возникают при нагрузке на сустав, больше к вечеру, стихают после ночного отдыха |
Стартовые боли |
Возникают при наличии реактивного синовита в начале ходьбы, затем быстро исчезают и возобновляются при продолжающейся физической нагрузке |
|
Боли, связанные с наличием тендобурсита и периартроза |
Возникают только при движениях, в которых участвует пораженные сухожилия |
|
Боли, связанные с венозной гиперемией и стазом крови в субхондральной кости на фоне внутрикостной гипертензии |
Возникают ночью, исчезают утром при ходьбе |
Рефлекторные боли |
Обусловлены реактивным синовитом |
Отраженные боли |
Связаны с вовлечением в воспалительно-дегенеративный процесс капсулы сустава |
|
«Блокадная боль» |
Обусловлена ущемлением секвестра хряща (суставной «мыши») между суставными поверхностями |
По течению ОА подразделяют на медленно и быстро прогрессирующий. ОА может сопровождаться на определенных этапах течения реактивным синовитом. Клиническое течение ОА характеризуется волнообразностью, когда короткие периоды обострения сменяются спонтанной ремиссией.
При опросе больного выясняют причины развития заболевания и наличие факторов риска развития и прогрессирования патологического процесса. Осмотр позволяет выявить деформации сустава во фронтальной и сагиттальной плоскостях, нарушения походки, ее особенности, способность передвигаться самостоятельно или с использованием дополнительных средств (трость, костыли), сравнить передвижение пациента по местности и по лестнице (вверх и вниз). Определяют локализацию боли, наличие синовита, свободных внутрисуставных тел, выявляют повреждения менисков, измеряют объем движения в суставе, величину сгибательной и разгибательной контрактур.
Характерно также образование узелков в области проксимальных (узелки Бушара) и дистальных (узелки Гебердена) межфаланговых суставов. Выраженная припухлость и локальное повышение температуры над суставами не характерны, однако могут возникать при развитии вторичного синовита.
Диагностика остеоартроза. Классификационные критерии помогают распределить больных на различные категории по этиопатогенетическому принципу, однако не отражают индивидуальных особенностей и различий клинических проявлений ОА. Классификационные критерии отличаются от диагностических, которые описывают симптоматику заболевания. Это нашло отражение в классификационных критериях ОА коленного, тазобедренного суставов и ОА суставов руки, разработанных Американской коллегией ревматологов (табл.4).
Таблица 4. Классификационные критерии остеоартроза коленного и тазобедренного суставов (American College of Rheumatology).
Клинические критерии |
Клинические, лабораторные и рентгенологические критерии |
|
|
Коленный сустав |
||
|
1. Боль в коленном суставе в течение большинства дней предыдущего месяца |
1. Боль в коленном суставе в течение большинства дней предыдущего месяца |
|
|
2. Крепитация |
2. Наличие остеофитов |
|
|
3. Утренняя скованность < 30 мин |
3. Синовиальная жидкость типичная для ОА |
|
|
4. Возраст > 38 лет |
4. Возраст > 40 лет |
|
|
5. Увеличение размеров костей |
5. Утренняя скованность < 30 мин |
|
|
6. Крепитация |
||
|
Диагноз достоверен при таких совокупностях критериев |
Диагноз достоверен при таких совокупностях критериев |
|
|
1, 2, 3 и 4 |
1 и 2 |
|
|
1, 2 и 5 |
1, 3, 5 и 6 |
|
|
1, 4 и 5 |
1, 4, 5 и 6 |
|
|
Тазобедренный сустав |
||
|
1. Боль в тазобедренном суставе в течение большинства дней предыдущего месяца |
1. Боль в тазобедренном суставе в течение большинства дней предыдущего месяца |
|
|
2. Внутренняя ротация < 150 |
2.СОЭ < 20 мм/час |
|
|
3.СОЭ < 45 мм/час |
3. Остеофиты (рентгенологически) |
|
|
4. Сгибание бедра < 1150 |
4. Сужение суставной щели (рентгенологически) |
|
|
5. Внутренняя ротация > 150 |
||
|
6. Утренняя скованность< 60 мин. |
||
|
7. Возраст > 50 лет |
||
|
8. Боль при внутренней ротации |
||
|
Диагноз достоверен при таких совокупностях критериев |
Диагноз достоверен при таких совокупностях критериев |
|
|
1, 2 и 3 |
1, 2 и 3 |
|
|
1, 2 и 4 |
1, 2 и 4 |
|
|
1, 5, 6, 7 и 8 |
1, 3 и 4 |
|
В настоящее время разработаны диагностические подходы и классификационные критерии для наиболее распространенных локализаций ОА (коленный, тазобедренный суставы и суставы кисти); однако возможны трудности при установлении начальных проявлений ОА различной локализации.
Процесс диагностики предусматривает тщательный сбор анамнеза, детальный анализ жалоб, клиническое обследование, анализ причин болевого синдрома и наличия деформаций. При установлении диагноза следует учитывать, что болевой синдром и деформации суставов не всегда являются следствием ОА, даже если пациент относится к старшим возрастным группам и признаки ОА подтверждены рентгенологически. Следует учитывать, что при ОА основные жалобы пациента могут быть связаны с сопутствующей заболеванию патологией (например, энтезопатией или тендопатией), и наиболее эффективными методами лечения будут физиотерапевтические, а также локальная инъекционная терапия. Своевременно поставленный диагноз ОА – залог успешного лечения.
Для установления правильного диагноза необходимо учитывать следующие критерии:
· определенные симптомы, такие как боль механического типа (возникает при ходьбе и особенно при спуске и подъеме по лестнице и проходит в состоянии покоя);
· клинические признаки деформации;
· рентгенологические признаки сужения суставной щели.
При лабораторных исследованиях в крови обычно не обнаруживают изменений, при исследовании синовиальной жидкости определяется незначительное помутнение, отсутствие кристаллов, лейкоцитов – менее 2000 клеток/мм3 и нейтрофилов – менее 25 %.
Рентгенологические критерии остеоартроза. Выделяют следующие основные рентгенологические признаки ОА:
· остеофиты – костные краевые разрастания, увеличивающие площадь соприкосновения, изменяющие конгруэнтность суставных поверхностей;
· сужение суставной щели, более выраженное в сегментах, испытывающих большую нагрузку (в коленных суставах – в медиальные отделах, в тазобедренных суставах – в латеральных отделах);
· субхондральный склероз (уплотнение костной ткани).
Необязательными рентгенологическими признаками при ОА являются:
· кисты (обычно расположены по оси наибольшей нагрузки);
· подвывихи и вывихи;
· эрозии.
Для определения рентгенологических изменений и степени выраженности ОА наиболее часто используется классификация, предложенная J. Kellgren и J. Lawrence, в которой выделены 4 стадии основных рентгенологических признаков ОА.
Стадии остеоартроза по J. Kellgren и J. Lawrence:
0 стадия – отсутствие рентгенологических признаков;
I стадия – сомнительная;
II стадия – минимальная;
III стадия – средняя;
IV стадия – выраженная.
Н.С. Косинская предложила выделять 3 клинико-рентгенологические стадии ОА.
I стадия – незначительное ограничение подвижности в суставе преимущественно в каком-либо определенном направлении. На рентгенограмме определяются небольшие костные разрастания по краям суставной впадины, а также островки оссификации суставного хряща впоследствии сливающиеся с эпифизом, суставная щель сужена незначительно.
II стадия – общее ограничение подвижности сустава, грубый хруст при движении, умеренная атрофия регионарных мышц. На рентгенограмме – значительные костные разрастания, сужение суставной щели в 2–3 раза по сравнению с нормой, субхондральный склероз.
III стадия – значительная деформация сустава с резким ограничением его подвижности. На рентгенограмме – почти полное исчезновение суставной щели, выраженная деформация и уплотнение суставных поверхностей эпифизов, обширные краевые разрастания.
Ошибки при диагностике остеоартроза. Наиболее важные причины ошибок при диагностике остеоартроза перечислены ниже.
I. Неверная трактовка болевого синдрома
1. Причина болевого синдрома не ОА, а другой патологический процесс:
артрит другого генеза;
· патологические изменения в костях, формирующих сустав (опухоль, остеомиелит, метаболические заболевания костей и т.д.);
· механические повреждения, патологические переломы;
· ирритативный болевой синдром (например, радикулопатия спинномозгового корешка L4 может вызывать болевой синдром в коленном суставе или в области большого трохантера);
· другие неврологические заболевания, вызывающие неподвижность в суставе (паркинсонизм, повреждения центральных мотонейронов и т.д.);
· нарушения мягких тканей, независимые от ОА (например, тендопатия области большой гусиной лапки, болезнь Кервена и др.).
2. Причина болевого синдрома – ОА иной локализации:
· боль в коленном суставе при ОА тазобедренного сустава;
· боли в плечевом суставе при остеохондрозе позвоночно-двигательного сегмента C4 – C5;
· боли при остеохондрозе пояснично-крестцового отдела позвоночника, вызывающие болевой синдром в тазобедренном, коленном или голеностопном суставах.
3. Причина болевого синдрома – вторичные изменения периартикулярных мягких тканей при ОА:
· лигаментиты (особенно при ОА коленного сустава);
· энтезопатии, тендинопатии как следствие контрактур суставов;
· бурситы (например, киста Бейкера).
II. Неверная трактовка деформаций суставов:
· псевдогипертрофическая артропатия;
· псориатический артрит (дистальный тип);
· сгибательная контрактура суставов;
· мукополисахаридоз;
· неврогенные артропатии;
· кристаллические артропатии;
· варусная или вальгусная деформация суставов, не связанная с ОА.
III. Неверная трактовка рентгенологических снимков:
· артриты на фоне предшествующего ОА;
· начальные проявления ОА (рентгенологические признаки ОА могут отсутствовать);
· синдром идиопатического распространенного гиперостоза;
· сгибательная контрактура, вызывающая кажущееся сужение суставной щели.
IV. Неврогенные и метаболические артропатии:
· пирофосфатная артропатия;
· гидроксиапатитная артропатия;
· артропатия при гемохроматозе;
· алкаптонурия.
Во избежание ошибок при установлении диагноза остеоартроза следует проводить тщательный сбор анамнеза, квалифицированное нейро-ортопедическое обследование (определение болезненности, выявление контрактур и деформаций, исследование функции суставов), лабораторные и рентгенологические исследования, а при необходимости использовать и другие методы диагностики (компьютерная томография, магнитно-ядерный резонанс и др.).
Дифференциальный диагноз болевого синдрома при остеоартрозе коленного сустава. Болевой синдром при ОА коленного сустава носит главным образом механический характер, т.е. возникает при физической активности и уменьшается в покое. Его характер зависит от различных патогенетических механизмов.
Наиболее частая причина боли при ОА коленного сустава – реактивный синовит. Причинами его возникновения чаще всего являются травма, механическая перегрузка суставов, воспалительные изменения. Синовит нередко сопровождается явлением тендобурсита, при котором возникают боли при определенных движениях в коленном суставе, связанные с сокращением пораженного сухожилия. Эти явления, в отличие от синовитов при артритах, быстро проходят при соблюдении постельного режима.
Для реактивного синовита характерны так называемые стартовые боли, возникающие при первых шагах больного; они затем быстро исчезают и могут возобновиться после продолжающейся физической нагрузки. Стартовые боли возникают при трении друг о друга пораженных хрящей, на поверхности которых оседает хрящевой детрит (обломки некротизированного хряща). При первых движениях в коленном суставе детрит выталкивается в суставную полость и боли прекращаются. Возникновению стартовых болей способствует несоответствие быстрого нарастания потребности в тканевом дыхании способности микроциркуляторного русла обеспечить ткани кровью.
Возникновение синовитов может быть связано с выпадением кристаллов пирофосфата кальция или гидроксилаппатита в полость сустава с их последующим фагоцитозом, высвобождением лизосомальных ферментов и развитием воспалительной реакции.
Венозная гиперемия, стаз в субхондральной кости, и повышение внутрикостного венозного давления вызывают тупые непрерывные ночные боли, исчезающие при ходьбе. Эти боли образно называют «суставной мигренью», что подчеркивает ведущую роль венозных нарушений в их патогенезе. Следует учитывать, что ишемические боли могут также возникать при аваскулярном некрозе и у больных серповидно-клеточной анемией.
Боли при длительном пребывании в вертикальном положении или длительной ходьбе (при механической нагрузке), как правило, возникают вследствие снижения способности переносить нагрузку субхондральной костью. Они обусловлены развитием остеосклероза и остеопороза эпифизов.
У больных ОА коленного сустава часто наблюдается болезненность тканей в непосредственной близости возле суставов, т.е. околосуставных тканей (сухожилий мышц, их влагалищ, слизистых сумок, связок, фасций и апоневрозов), а также тканей, находящихся на некотором отдалении от суставов (мышц, нервно-сосудистых образований, подкожной жировой клетчатки).
При ОА коленного сустава изменения мягких тканей наблюдаются как в периартикулярной области (в основном в местах прикрепления мышц портняжной, нежной, полусухожильной, полуперепончатой мышц и двуглавой мышцы бедра), трактуемые как периартрит коленного сустава, так и в областях, связанных с суставом функционально. При этом формируются зоны болевой триггерной активности в проксимальных участках прямой мышцы, мышцы, напрягающей широкую фасцию бедра, большой ягодичной мышце, а также в области подвздошно-большеберцового тракта, что расценивается как миофасциальные синдромы при ОА коленного сустава. Эти изменения приводят к формированию болевых контрактур и ограничению движений в коленных суставах.
Болевой синдром, возникающий при ходьбе вниз по лестнице, на поздних стадиях патологического процесса обусловлен поражением связочного аппарата и регионарных мышц. Постоянные боли при любом движении сустава связаны с рефлекторным спазмом близлежащих мышц. Внезапная острая боль и возникновение блока в суставе, заставляющие больного остановиться, связаны с ущемлением относительно крупного костного или хрящевого обломка, так называемой суставной мыши, между суставными поверхностями. Источником формирования свободных суставных тел при ОА коленных суставов могут быть обломки измененного хряща, костные фрагменты, ткани менисков. После нескольких удачных движений в суставе «суставная мышь» выскальзывает, боль внезапно прекращается, движения в суставе восстанавливаются.
Дегенеративные изменения или разрыв (полный или частичный) мениска ведут к нестабильности сустава и возникновению болевого синдрома.
Чаще всего причинами болей при ОА коленного сустава становятся реактивный синовит, периартрит и спазм близлежащих мышц.
Неверная трактовка болевого синдрома при установлении диагноза ОА коленного сустава может возникнуть при артритах другого генеза, механических повреждениях и других процессах в мягких тканях не связанных с ОА, при болях в коленных суставах ирритативного характера, обусловленных ОА тазобедренного сустава или клиническими проявлениями остеохондроза пояснично-крестцового отдела позвоночника.
Дифференциальную диагностику следует проводить и при заболеваниях, в клинической картине которых наблюдается болевой синдром коленного сустава:
· остеохондропатии бугристости большеберцевой кости (болезнь Osgood–Schlatter);
· остеохондропатии суставной поверхности мыщелка бедра (болезнь König);
· посттравматическом обызвествлением мягких тканей в области внутреннего мыщелка бедра (болезнь Pelligrini–Stieda);
· посттравматическом повреждении крыловидных складок и гиперплазией суставной жировой ткани коленного сустава (болезнь Hoffa).
Лечение остеоартроза. Известный специалист John Kent Spender (1829–1916) более ста лет назад писал, что «малое количество тем могут вызвать сонливость и отчаяние, как конференция, посвященная проблеме обсуждения остеоартрита. Область настолько бесплодна. Результат – минимальный …». Заметим, что в иностранной литературе остеоартрит выступает аналогом остеоартроза, таким образом исследователи подчеркивают роль воспалительного процесса в патогенезе заболевания. При этом наиболее часто используемой группой препаратов, используемых в лечении ОА, являются нестероидные противовоспалительные препараты (НПВП).
Механизм действия НПВП обусловлен угнетением превращения арахидоновой кислоты в простагландины путем ингибирования фермента циклооксигеназы (ЦОГ). Выделены два изофермента ЦОГ: ЦОГ-1 и ЦОГ-2. ЦОГ-1 существует в организме в норме, катализирует синтез простагландинов (ПГ), участвующих в многочисленных физиологических функциях, включая нормальное функционирование слизистой оболочки желудочно-кишечного тракта и агрегационные свойства тромбоксана 2 в тромбоцитах. ЦОГ-2 синтезируется только при повреждении тканей, индуцирует производство цитокинов и других медиаторов воспаления в ряде тканей, в том числе в эндотелиальных клетках и, считается, играет определенную роль в развитии боли, воспаления и лихорадки. Продукция ЦОГ-2 значительно увеличивается в условиях воспаления. ПГ, образованные под влиянием ЦОГ-2, принимают участие в развитии и прогрессировании острого и хронического воспаления. Таким образом, ПГ E2, расширяя артериолы, увеличивает приток крови в область воспаления, а ПГ F2a – сужает венулы и затрудняет отток крови, что способствует развитию экссудации. Кроме того, ПГ вызывают гипералгезию и потенцируют действие других медиаторов воспаления.
Центральный механизм действия НПВП связан с угнетением синтеза простагландинов, которые образуются в центральной нервной системе и способствуют передаче болевого сигнала [Castellsague J. et al., 2012]. НПВП снижают чувствительность болевых рецепторов, уменьшают отечность тканей в очаге воспаления, ослабляя механическое давление на ноцицепторы. Обсуждаются дополнительные механизмы противовоспалительной активности НПВП, не связанные с ингибированием ЦОГ: угнетение функции нейтрофилов и взаимодействие лейкоцитов с эндотелием сосудов, активации фактора транскрипции NF-kВ, регулирующего синтез провоспалительных медиаторов или, даже, опиоидоподобные эффекты.
В обеспечении адекватного уровня обезболивания большое внимание уделяется традиционным НПВП, обладающим мощным обезболивающим эффектом [Spitzer W., 1987], но имеющим ряд побочных эффектов. Согласно литературным данным, распространенность язв желудка и 12-перстной кишки у больных с долгосрочным приемом НПВП составляет около 20%, а ежегодная частота серьезных осложнений от этих язв – 1–4% [Spitzer W., 1987]. Поэтому выбор адекватного обезболивающего препарата с минимальным риском развития побочных явлений остается сложной задачей.
Среди ЦОГ-2 селективных препаратов наиболее исследованным остается нимесулид (4-нитро-2-феноксиметансульфонамид) – уникальный противовоспалительный препарат, отличающийся от большинства НПВП.
Нимесулид – первый представитель нового класса селективных ингибиторов ЦОГ-2, представленных на мировом рынке. Он используется в клинической практике с 1985 г., когда впервые появился на фармацевтическом рынке Италии, а в настоящее время это лекарственное средство зарегистрировано более чем в 50 странах мира. Нимесулид наиболее часто назначаемый НПВП в Италии, Португалии, Франции [Spitzer W., 1987]. Препарат был разработан в Швейцарии фирмой Helsinn Healthcare в 1980 г., в 1994 г. было доказано преобладающее влияние нимесулида на ЦОГ-2, и подтверждено в дальнейшем многочисленными исследованиями. Воздействие на ЦОГ-1 осуществляется преимущественно в очаге воспаления, что обеспечивает дополнительный противовоспалительный эффект, а отсутствие влияния на ЦОГ-1 желудка и почек, в свою очередь, обусловливает высокий профиль безопасности [Барскова В.Г., 2011].
Влияние нимесулида обусловлено класс-специфическими механизмами, характерными для большинства НПВП и эффектами именно нимесулида. Как и все представители класса, нимесулид обладает противовоспалительным, обезболивающим и жаропонижающим действием. Препарат снижает концентрацию короткоживущего ПГ Н2, из которого под действием ПГ-изомеразы образуется ПГ Е2. Уменьшение концентрации ПГ Е2 ведет к снижению степени активации простаноидных рецепторов ЕР-типа, что реализуется в анальгетический и противовоспалительный эффекты. Препарат обратимо подавляет образование ПГ Е2 не только в очаге воспаления, но и в восходящих путях ноцицептивной системы, включая пути проведения болевых импульсов в спинном мозге. На ЦОГ-1 нимесулид действует незначительно и, практически, не препятствует образованию ПГ Е2 из арахидоновой кислоты в физиологических условиях, благодаря чему снижается количество побочных эффектов препарата (рис. 2).
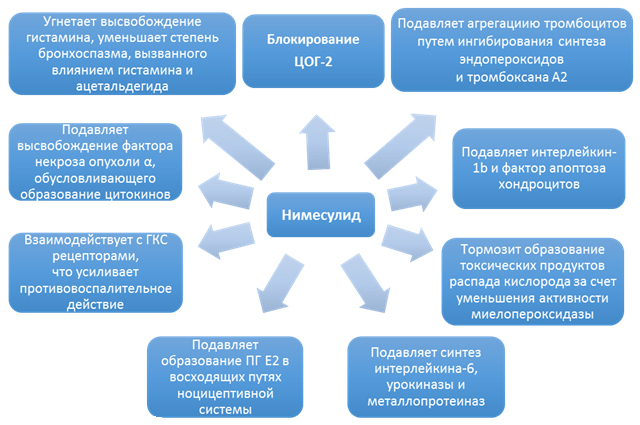
Рисунок 2. Механизмы действия нимесулида
Нимесулид подавляет агрегацию тромбоцитов путем ингибирования синтеза эндопероксидов и тромбоксана А2, подавляет синтез фактора агрегации тромбоцитов, подавляет высвобождение гистамина, а также уменьшает степень бронхоспазма, вызванного воздействием гистамина и ацетальдегида [Косарев В.В., Бабанов С.А., 2011].
Нимесулид ингибирует высвобождение фактора некроза опухоли α, который обусловливает образование цитокинов. Показано, что нимесулид способен подавлять синтез интерлейкина-6 и урокиназы, металлопротеиназ (эластазы, коллагеназы), замедляя разрушение протеогликанов и коллагена хрящевой ткани. Кроме того, нимесулид подавляет интерлейкин-1b и фактор апоптоза хондроцитов [Воробьева О.В., 2010].
Нимесулид обладает антиоксидантными свойствами, тормозит образование токсических продуктов распада кислорода за счет уменьшения активности миелопероксидазы, влияет на продукцию и действие окислительных радикалов, а также других компонентов нейтрофильной активации, что усиливает противовоспалительный и анальгетический эффекты и снижает вероятность гастроинтестинальной ульцерогенности. Взаимодействие нимесулида с ГКС рецепторами и активация их путем фосфорилирования усиливает противовоспалительное действие препарата [Косарев В.В., Бабанов С.А., 2011].
Гастроинтестинальная безопасность нимесулида обусловлена отсутствием влияния на ЦОГ-1 и химическими свойствами препарата. Большинство традиционных НПВП по химической структуре – кислоты, которые повышают проницаемость тонкого кишечника. Это является дополнительным, не связанным с угнетением синтеза ПГ, механизмом развития гастропатии. Нимесулид, напротив, имеет слабые кислотные свойства и не накапливается в слизистой оболочке желудка и кишечника. Кроме того, нимесулид снижает продукцию окислительных радикалов и лейкотриенов, а также выброс гистамина из тучных клеток, чем создает дополнительную протекцию слизистой оболочки ЖКТ. В многочисленных клинических исследованиях при различных заболеваниях костно-мышечной системы доказано, что подавляющее большинство побочных реакций для нимесулида со стороны ЖКТ транзиторные, слабо выраженные и слабо коррелируют с ульцерогенным эффектом. Двойное слепое исследование с использованием гастродуоденоскопии показало, что применение нимесулида в дозе 100 или 200 мг в течение 7 дней не приводило к изменениям слизистой оболочки по сравнению с плацебо. Таким образом, можно констатировать, что нимесулид крайне редко вызывает тяжелые гастроинтестинальные осложнения, что особенно важно для лиц старших возрастных групп.
Принципиальное значение для оценки безопасности нимесулида имеет опыт его длительного применения. Так, в работе P. Locker et al. 199 больных с ОА получали нимесулид (200 мг) или этодолак (600 мг) в течение 3 мес. Терапевтический потенциал нимесулида оказался выше: его действие оценили как «хорошо» или «отлично» 80% больных, в то время как препарату сравнения аналогичную оценку дали только 68% больных. При этом, хотя этодолак относится к селективным НПВП и считается препаратом с очень хорошей переносимостью, количество побочных эффектов в обеих группах лечения не отличалось. В масштабном исследовании Huskisson et al. нимесулид (200 мг/сут) или диклофенак (150 мг/сут) были назначены 279 пациентам с ОА, причем продолжительность терапии составила 6 мес. Эффективность препаратов, которая оценивалась по динамике самочувствия больных и функциональному индексу Лекена, оказалась фактически одинаковой. Однако нимесулид существенно превосходил диклофенак по переносимости: появление побочных эффектов со стороны ЖКТ регистрировалось в 36 и 47 % больных соответственно (p<0,05) [E.C. Huskisson et al., 1999]. В настоящее время наиболее длительным и большим рандомизированным двойным слепым исследованием нимесулида остается работа W. Kriegel et al. В этом исследовании определялись эффективность и безопасность нимесулида (200 мг) и напроксена (750 мг) у 370 больных с ОА в течение 12 мес. Как и в работе Huskisson, эффективность обоих препаратов оказалась сопоставимой. Количество медикаментозных осложнений при использовании нимесулида также оказалось меньшим: суммарно 47,5% (54,5 % – у пациентов, получавших напроксен) [Каратеев А.Е., 2009]. Очень важно, что ни в одной из трех представленных работ не зафиксировано значимого повышения частоты кардиоваскулярных осложнений на фоне длительного приема нимесулида.
В исследовании N. A. da Silva et al. проводилась сравнительная оценка эффективности и переносимости нимесулида и целекоксиба в лечении остеоартрита. Участие приняло 57 пациентов в возрасте от 40 и 80 лет с остеоартритом коленного и тазобедренного сустава, которые случайным образом были распределены в две группы, получающие либо нимесулид, либо целекоксиб в течение 30 дней. Оценка состояния пациентов проводилась до начала терапии, через 10, 20 и 30 дней лечения. Достоверное снижение болевого синдрома в покое и при движении было подобным в обеих группах на всех визитах наблюдения. Средняя продолжительность утренней скованности достоверно уменьшилась при приеме нимесулида на протяжении всего исследования. У пациентов, получающих целекоксиб, достоверное снижение скованности было отмечено на третьем визите. При оценке функциональных возможностей с помощью шкалы HAQ у пациентов, принимавших нимесулид, достоверное улучшение показателя отмечалось в течение всего периода исследования, а у пациентов, получавших целекоксиб, только на 4-м визите. Индекс тяжести остеоартрита коленного сустава Lesquesne & Samson’s (1991) достоверно снижался при приеме нимесулида на 3-м визите, при приеме целекоксиба – достоверных изменений показателя не установлено. Побочные явления были выявлены у 21% пациентов, получавших нимесулид и 25% – целекоксиб. Таким образом, хотя в данном исследовании было отмечено подобное снижение выраженности болевого синдрома при остеоартрите коленного и тазобедренного сустава при приеме как нимесулида, так и целекоксиба, достоверно более быстрое снижение утренней скованности, индекса тяжести остеоартрита коленного сустава Lesquesne & Samson’s и улучшение функциональных возможностей пациента было установлено в группе пациентов, получающих нимесулид [N. A. da Silva et al., 2001].
Хондропротективные свойства нимесулида были изучены в рандомизированном, двойном слепом, контролируемом клиническом исследовании H. Ergün et al., целью которого была сравнительная оценка эффективности, переносимости и хондропротекции нимесулида и пироксикама. В исследовании приняло участие 90 больных, страдающих остеоартритом коленного сустава. В результате лечения было отмечено достоверное улучшение индекса тяжести остеоартрита через 2 недели (р <0,01) и улучшение глобальной оценки артрита врачом через 4 недели (р <0,01) терапии в обоих группах наблюдения. Достоверное снижение суставного индекса болезненности суставов (р <0,05) через 8 недель и самостоятельной оценки нетрудоспособности – через 4 недели (р <0,05) по сравнению с исходным показателем, наблюдалось только в группе пациентов, получающих нимесулид. При проведении магнитно-резонансной томографии с целью оценки изменений в суставном хряще после 6 месяцев терапии не было выявлено достоверных отличий между двумя группами обследуемых пациентов. Побочные эффекты наблюдались у 6 пациентов при приеме нимесулида и 9 пациентов, получавших пироксикам. Таким образом, учитывая клиническую эффективность, результаты визуализирующих методов исследования, меньшую частоту побочных явлений препаратом выбора в лечении остеоартрита коленных суставов является нимесулид [Roy V. et al., 1999].