Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ПРЕГРАВИДАРНАЯ ПОДГОТОВКА И ПРИЕМ ФОЛАТОВ"
Автор: Пустотина Ольга Анатольевна
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Акушерство и гинекология
Просмотров: 2 805
Дата проведения: с 01.06.2015 по 01.06.2016
 Недостаток фолатов и осложнения беременности
Недостаток фолатов и осложнения беременности
Термин «Прегравидарная подготовка» произошел от латинского слова «gravida», то есть «беременная», приставка «пре» обозначает предшествие чему-либо.
Прегравидарная подготовка включает комплекс диагностических, профилактических и лечебных мероприятий, направленных на подготовку организма женщины к полноценному зачатию, вынашиванию и рождению здорового ребенка. При подготовке к беременности необходимым является нормализация питания и образа жизни, отказ от вредных привычек, приема алкоголя, наркотических средств, курения. Наряду с этим всем женщинам, планирующим беременность, рекомендуется дополнительный прием фолиевой кислоты на протяжении как минимум 30 дней до зачатия и всего первого триместра беременности (FIGO, 2015). Данные рекомендации основаны на незаменимой роли фолатов при формировании плаценты и развитии эмбриона.
Фолаты представляют собой химические соединения на основе фолиевой кислоты, в целом составляющие витамин В9. Они являются незаменимыми компонентами основных обменных процессов в организме, важнейший из которых – синтез нуклеотидов и репликация ДНК, обеспечивающий физиологическое деление и нормальный рост всех клеток в организме.
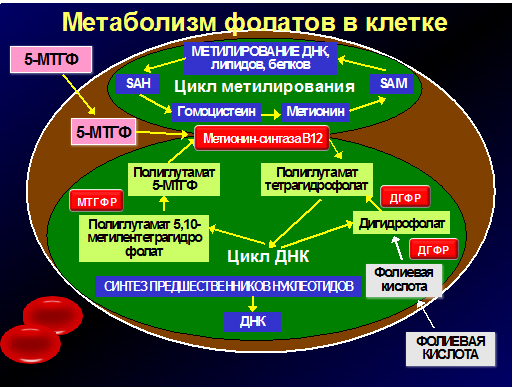
Также, фолаты принимают участие в реакциях метилирования белков, гормонов, липидов, нейромедиаторов, ферментов и других компонентов обмена веществ. Важнейшим субстратом для метилирования является ДНК. Этот процесс обеспечивает функционирование клеточного генома, регуляцию онтогенеза и клеточную дифференцировку (Pietrzik и соавт., 2010).
Нарушение процессов синтеза и метилирования ДНК в первую очередь отражается на быстропролиферирующих клетках. Наиболее чувствительны к негативному влиянию фолатдефицита эмбриональные клетки. Расстройство работы генома эмбриональных клеток во время их деления и дифференцировки приводит к нарушению эмбриогенеза и формированию пороков развития у плода.
Одним из тяжелейших пороков, связанных с фолатдефицитом, является незаращение нервной трубки у плода. Каждый год в странах Евросоюза данный порок выявляется более, чем у 4500 беременных, и еще более часто – в странах с низким и средним уровнем дохода. Так, в Европейских странах частота порока нервной трубки составляет в среднем 1 на 1000 новорожденных, тогда как в странах Латинской Америки достигает 5 на 1000 живорожденных детей.
Существует четкая зависимость частоты порока нервной трубки у плода от уровня фолатов в эритроцитах крови беременной. Минимально достаточная концентрация фолатов для рождения здорового ребенка составляет 906 нмоль/л и встречается всего у 13% людей в популяции, поэтому повсеместно проводятся программы по дотации фолатов беременным женщинам. В связи с широким распространением фолатдефицита во многих странах мира с конца 90-х годов прошлого века действует программа фортификации фолатами пищевых продуктов. Она регламентирует обогащение продуктов питания (крупы, мука, хлеб и макаронные изделия) синтетической фолиевой кислотой в концентрации 140 мкг на 100 г продукта с целью увеличения ее потребления в общей популяции до 100 мкг/сут.
В рандомизированных клинических исследованиях и метаанализах установлено, что дополнительный прием фолатов снижает частоту развития порока нервной трубки на 70-75%. Также, следствием дефицита фолатов является целый спектр различных аномалий мозга, конечностей, ушей, мочевыделительной системы, расщелина верхнего неба, омфалоцеле. Наиболее часто (примерно у 1 из 100 новорожденных) встречаются пороки сердечно-сосудистой системы. Дополнительный прием фолиевой кислоты на протяжении 4 недель до зачатия и первых 12 нед беременности снижает риск развития врожденного порока сердца на 26% и дефекта сердечной перегородки – на 40%.
Кроме негативного влияния на эмбриогенез, недостаточное потребление фолатов во время беременности нарушает пролиферацию ворсин хориона и формирование плаценты. Нарушение плацентации приводит к осложненному течению беременности: повышается риск невынашивания, недонашивания, плацентарной недостаточности и задержки роста плода, увеличивается количество случаев преэклампсии и отслойки плаценты.
Фолатный статус матери во время беременности имеет важное значение для последующего развития ребенка (Roth и соавт., 2011). Низкое потребление (< 400 мкг/сут) фолиевой кислоты в первом триместре беременности у женщин с полиморфизмом гена МТГФР было связано с более низким индексом психического развития их годовалых младенцев (del Rio Garcia и др., 2009). Использование добавок, содержащих фолиевую кислоту, связано с улучшением двигательных, когнитивных и поведенческих показателей у детей в 4 года (Julvez и др., 2009). Большое Норвежское исследование, включившее 38954 детей, обнаружило значимо меньшую частоту задержки речевого развития у детей 3 лет от матерей дополнительно принимавших фолиевую кислоту на 4-8 неделе беременности (Roth и др., 2011). Низкий уровень фолатов в эритроцитах крови матери на 14 неделе беременности был связан с гиперактивностью детей в возратсе 8 лет по сравнению со сверстниками (Schlotz и соавт., 2010). Исследование, проведенное в Индии с участием 536 женщин, показало корреляцию концентрации фолиевой кислоты в сыворотке крови матери на 30-й неделе беременности с когнитивными нарушениями у 9-10 летних детей (Veena и соавт., 2010).
Метаболизм фолатов в организме
Фолаты не синтезируются в организме и поступают к нам с пищевыми продуктами. Наибольшее количество фолатов содержится в зеленых овощах, зелени, семенах подсолнечника и печени животных. С ограниченным потреблением таких продуктов питания в первую очередь обусловлена высокая частота дефицита фолатов среди населения.
Дефицит фолатов может быть приобретенным и наследственным.
Причины приобретенного дефицита фолатов:
- Недостаточное потребление пищевых продуктов, содержащих фолиевую кислоту, витамины В6 и В12
- Алкоголизм
- Курение
- Прием лекарственных средств (антиконвульсанты, сульфаниламиды, метотраксат, комбинированные гормональные контрацептивы и др.)
- Синдром мальабсорбции (в т.ч. после резекции желудка для коррекции массы тела)
- Сахарный диабет
- Гипотиреоз
Причины врожденного дефицита фолатов.
Полноценный цикл обмена фолатов и сопряженных с ним клеточных процессов в организме возможен не только при достаточном поступлении фолиевой кислоты, а также при нормальном функционировании ферментов фолатного цикла. Наиболее часто встречается нарушение деятельности фермента метилентетрагидрофолатредуктазы (МТГФР) вследствие врожденного полиморфизма в его генах: гомозиготная форма обнаруживается у 15-20% населения, гетерозиготная – у 40-60%. МТГФР – это основной фермент фолатного цикла. Он преобразует все неактивные формы фолатов, как поступившие в организм, в том числе синтетическую фолиевую кислоту в таблетках, так и находящиеся в клетках, в биологически активный 5-МТГФ (рис.2). Нарушение функции данного фермента, которая при гомозиготной форме полиморфизма снижается на 75% от исходной и при гетерозиготной – на 30%, ведет к резкому снижению образования активных фолатов и развитию фолатдефицита. У женщин с полиморфизмом гена МТГФР значительно чаще регистрируются пороки развития плода и осложненное течение беременности. Кроме того, не менее важно функционирование ферментов метионинсинтазы и цистотионредуктазы, участвующих в циклах метилирования. Нарушение активности данных ферментов может быть врожденным, а также зависит от поступления в организм витаминов В12 и В6, соответственно.
Фолаты, содержащиеся в пищевых продуктах, в большинстве случаев являются биологически не активными. Всасывается из кишечника в систему кровообращения и затем потребляется клетками только одна форма фолиевой кислоты – моноглутамат 5-МТГФ (рис.1). Остальные формы фолатов представляют собой полиглутаматы, которые в щеточной каемке слизистой кишечника сначала преобразуются в моноглутаматы и, при всасывании из кишечника в кровь, под воздействием фермента МТГФР тоже превращаются в моноглутамат 5-МТГФ. 5-МТГФ поступает в клетки организма и участвует в биологических процессах: циклах клеточной репликации и метилирования (рис.2).
Цикл метилирования включает трансформацию аминокислоты метионин, поступающей в организм с продуктами животного происхождения (мясом, молоком и яйцами), в S-аденозилметионин и, затем, гомоцистеин. S-аденозилметионин является донором метила для всех клеточных метилтрансфераз, метилирующих различные субстраты (ДНК, белки, липиды и т.д.). После потери метильной группы он преобразуется в гомоцистеин, часть которого метаболизируется при участии В6-зависимого фермента цистатионинсинтазы и выводится почками, а часть повторно метилируется и превращается в метионин, что ведет к возобновлению клеточного цикла метилирования. Метилирование гомоцистеина происходит за счет метильных групп поступившего в клетки моноглутамата 5-МТГФ, которые транспортируются с помощью В12-зависимого фермента метионин-синтазы. Таким образом фолаты обеспечивают постоянное снабжение метильными группами циклы метилирования.
После участия в цикле метилирования 5-МТГФ вновь превращается в полиглутаматы фолиевой кислоты. Полиглутаматы участвуют в другом не менее важном процессе обмена веществ: обеспечивают цикл синтеза ДНК и клеточную репликацию. В результате данных реакций образуются промежуточные формы фолиевой кислоты – полиглутамат дигидрофолат и 5,10-метилентетрагидрофолат. Дигидрофолаты с помощью фермента дегидрофолатредуктазы (ДГФР) обратно превращаются в полиглутаматы тетрагидрофолатов и вновь используются в синтезе предшественников нуклеотидов для образования ДНК и клеточного деления. 5,10-метилентетрагидрофолаты под воздействием фермента МТГФР повторно превращаются в активный моноглутамат 5-МТГФ, который наряду с поступившим из крови метилфолатом используется для повторного метилирования гомоцистеина в метионин и участия последнего в циклах метилирования.
При недостатке фолатов нарушается процесс реметилирования гомоцистеина и происходит его накопление в организме. Гипергомоцистеинемия приводит к повреждению сосудистого эндотелия, что сопровождается тромбообразованием и повышением риска развития тромбофилических осложнений, таких как инфаркт, инсульт и тромбоз глубоких вен бедра. Кроме того, она неблагоприятно влияет на течение беременности. При повышенном содержании гомоцистеина усиливается тромбообразование в зоне плацентации, что нарушает формирование и развитие плаценты и ведет к осложненному течению беременности. Результаты масштабного исследования (Hordaland Homocysteine Study), охватившего 5883 женщины и их 14415 беременностей в период 1967-1996 гг., показали достоверное повышение риска развития преэклампсии, отслойки плаценты, преждевременных родов и рождения детей с экстремально низкой массой тела (менее 1500г) при концентрации гомоцистеина в сыворотке крови более 9 мкмоль/л. При этом частота осложнений беременности коррелировала со степенью повышения уровня гомоцистеина. Дополнительный прием фолиевой кислоты достоверно снижает частоту преждевременных родов и рождения детей с экстремально низкой массой тела, причем с четкой зависимостью от длительности назначения фолиевой кислоты до наступления беременности.
Гипергомоцистеинемия может быть приобретенной и наследственной. Приобретенная гипергомоцистеинемия возникает при недостаточном потреблении пищевых продуктов, богатых фолиевой кислотой, а также при нарушении всасывания фолатов в кровь на фоне заболеваний кишечника. Алкоголизм, курение, применение ряда лекарственных средств (противосудорожные, гормональные контрацептивы, противоопухолевые), гипотиреоз, сахарный диабет могут также приводить к дефициту фолатов и развитию гипергомоцистеинемии. Накопление сывороточного гомоцистеина может быть следствием нарушения его выведения при заболеваниях почек.
Немаловажную роль в метаболизме гомоцистеина также играют ферменты: МТГФР, метиленсинтаза и цистотионредуктаза. Они обеспечивают как реметилирование гомоцистеина и превращение в метионин, так и удаление его избытка через мочевыделительную систему. Нарушение функции данных ферментов часто связано с наследственным дефектом в их генах. В этих случаях гипергомоцистеинемия носит наследственный характер. Кроме того, функционирование метиленсинтазы и цистотионредуктазы зависит от количества поступающих в организм витаминов В12 и В6, соответственно.
Фолиевая кислота и метафолин
Как показывают многочисленные исследования, традиционное назначение препаратов фолиевой кислоты при нарушении функции ферментов фолатного цикла не достаточно эффективно. Синтетическая фолиевая кислота также, как и большинство пищевых фолатов, является биологически не активной и только с помощью фермента МТГФР превращается в активный моноглутамат 5-МТГФ (рис.1, 2). При снижении функции фермента МТГФР образование активных фолатов нарушается, что приводит к повреждению фолатзависимых обменных процессов в организме.
Кроме того, синтетическая фолиевая кислота, в отличие от пищевых фолатов, в неметаболизированном виде также может поступать в системный кровоток и захватываться клетками. Появление неметаболизированной формы в крови происходит уже при суточном потреблении фолиевой кислоты более 200 мкг, что обусловлено ограниченными возможностями ферментативной системы слизистой оболочки кишечника. Поступая в клетки, она блокирует рецепторы и ферменты с которыми взаимодействуют эндогенные активные фолаты, и, не смотря на достаточный и даже избыточный прием фолиевой кислоты, возникает или еще больше усугубляется функциональный фолатдефицит. Активные метаболизированные фолаты не могут реализовать свои эффекты из-за избытка введенной в составе препаратов синтетической фолиевой кислоты.
Таким образом, для организма становится опасен не только недостаток активных фолатов, но и избыток синтетической фолиевой кислоты. В результате эпидемиологических и клинических исследований была выявлена двунаправленная связь между приемом фолиевой кислоты, уровнем фолатов в крови и онкологическими заболеваниями. Онкологический риск повышается как при дефиците активных фолатов, так и при передозировке синтетической фолиевой кислоты. Есть данные о повышении в последствие риска развития рака молочной железы при применении высоких доз (5 мг) фолиевой кислоты во время беременности.
В результате исследований было отмечено, что избыток синтетических фолатов при беременности также ассоциирован с неблагоприятными последствиями для плода. С ним связывают нарушение когнитивных способностей и зрения у новорожденного. Обнаружена корреляция высокого потребления фолатов во время беременности и повышенным риском развития инсулинорезистентности и ожирения у детей в старшем возрасте.
В последние годы все чаще стали встречаться инфекционно-воспалительные и аллергические заболевания верхних дыхательных путей у детей. Одним из факторов риска возможно является высокое потребление синтетических фолатов матерями во время беременности. Так, обследование 32077 детей в возрасте 18 месяцев, выявило увеличение на 24% риска инфекционных заболеваний нижнего респираторного тракта при высокодозированном потреблении фолиевой кислоты беременной в течение первого триместра. Проспективное когортное исследование в Австралии показало, что высокие дозы фолиевой кислоты во время беременности на 26% увеличивают риск заболевания астмой у детей 3,5 лет. Высокий сывороточный уровень фолатов на 18 неделе беременности ассоциирован с повышением риска заболевания астмой на 66%. При применении пищевых натуральных фолатов такой корреляции не отмечалось.
В Австралийском исследовании было показано, что прием фолиевой кислоты в количестве 500 мкг/сут в третьем триместре беременности на 85% повышает риск развития экземы у детей к первому году жизни, по сравнению с суточным потреблением фолиевой кислоты менее 200 мкг (Dunstan и соавт., 2011), при этом связи с пищевыми фолатами также не отмечалось.
Таким образом, отношение к фолиевой кислоте по принципу «много не бывает» в настоящее время считается спорным. Суточная потребность в фолатах составляет около 400 мкг или 0,4 мг. Для беременных эта доза может быть несколько увеличена, но не более 1 мг в сутки до, так называемого, физиологического предела.
В последние годы исследования по профилактике осложнений, связанных с дефицитом фолатов, стали фокусироваться на дополнительном приеме другой формы фолиевой кислоты – 5-МТГФ, или метафолина. Это связано с имеющимися данными о возможных негативных последствиях неконтролируемого приема синтетической фолиевой кислоты, а также обусловлено высокой распространенностью генетического полиморфизма МТГФР среди населения, влияющего на активность основного фермента фолатного цикла. Так, гомозиготный полиморфизм встречается у 15-20% населения, гетерозиготный – у 40-60%. В отличие от синтетической фолиевой кислоты данная форма фолатов является биологически активной и всасывается в кровь без участия ферментативных систем кишечника, в том числе фермента МТГФР. Она непосредственно захватывается клетками и используется в обменных процессах – репликации ДНК и циклах метилирования.
При исследовании уровня фолатов в эритроцитах крови у женщин с полиморфизмом гена МТГФР с различным типом наследования Р.Принц-Лангехоль и соавт. показали, что метафолин значительно в большей степени повышает их содержание, чем фолиевая кислота. Также, значительно большее влияние применение метафолина оказывает на сывороточный уровень гомоцистеина по сравнению с приемом фолиевой кислоты. Биологически активная форма фолиевой кислоты содержится в препарате Фемибион. В его состав входит 400 мкг фолатов, половина из которых представлена фолиевой кислотой и половина – биологически активным метафолином. Кроме того, в нем имеются другие представители витамина группы В (В1, 2, 5, 6 и 12), а также витамины С, Е, РР и йод.
Дефицит фолатов и анемия
Увеличение объема циркулирующей крови является нормальным физиологическим изменением во время беременности. В основном увеличение происходит за счет объема плазмы, на фоне которого концентрация гемоглобина, эритроцитов и гематокрит во время беременности немного уменьшаются. Поэтому нижняя граница нормы содержания гемоглобина у беременных составляет 110 г/л.
Дефицит фолатов может приводить к еще более значимому снижению гемоглобина и эритроцитов. Образование эритроцитов происходит из кроветворных клеток в костном мозге. Для нормального эритропоэза необходимо достаточное количество фолатов, витамина В12 и железа. Дефицит фолатов и/или витамина В12 приводит к нарушению деления кроветворных клеток, что сопровождается развитием анемии.
Назначение синтетической фолиевой кислоты может значительно повысить уровень гемоглобина и эритроцитов в крови, но при условии нормального функционирования ферментов, отвечающих за метаболизм фолатного цикла. В случаях полимормизма в генах МТГФР и/или метионинсинтазы эффективность такой тактики значительно ниже.
Кроме того, назначение синтетической фолиевой кислоты маскирует недостаточность витамина В12, характерного для пернициозной анемии. С витамином В12 связана деятельность фермента метионинсинтазы, отвечающего за перенос метильной группы фолатов в циклы метилирования. Наиболее серьезным последствием этого является повреждение метилирование миелина – белка, обеспечивающего проводимость нервных импульсов. Синтетические фолаты приводят к восстановлению нормального гемопоэза и лечению анемии, но восстановление процессов метилирования не происходит. В результате происходит необратимое разрушение миелина и быстрое прогрессирование неврологической симптоматики: от депрессии к когнитивным расстройствам и болезни Альцгеймера.
В одном из исследований было показано, что у беременных с анемией добавление к фолиевой кислоте метафолина и витамина В12 приводит к более значительному подъему уровня гемоглобина в сравнении с обычной фолиевой кислотой. Фемибион, в состав которого входят все витамины группы В, способствует не только восстановлению цикла синтеза ДНК и лечению анемии, но и цикла метилирования, что улучшает неврологический статус.
Дефицит фолатов и преждевременные роды
В информационном письме, опубликованном в январе 2015 г. рабочей группой FIGO, указывается, что прием фолатов в прегравидарный период и в течение беременности не ограничивается только профилактикой пороков развития у плода. Дополнительный прием фолатов до и после зачатия достоверно снижает риск преждевременных родов и частоту рождения детей с низкой массой тела, причем в прямой зависимости от длительности дотаций до наступления беременности. У женщин, дополнительно принимающих фолиевую кислоту более года до наступления беременности риск преждевременных родов и рождения ребенка с низкой массой тела снижается на 60-70%, в сравнении с 30-50% – при приеме фолатов менее года до зачатия. В популяционном исследовании, проведенном в Великобританиии охватившем около 110000 беременных женщин, убедительно показано, что только стартовая терапия фолатами в прегравидарном периоде позитивно влияет на течение и исход беременности, тогда как начало приема фолатов после наступления беременности такого эффекта не имеет (Hodgetts, 2014).
Заключение
Дополнительный прием фолатов до и после зачатия значительно снижает риск пороков развития у плода. Причем эффект фолатов не ограничивается только дефектом нервной трубки, а также связан с предотвращением врожденных пороков сердца и челюстно-лицевых аномалий. Формирование большинства органов и систем плода происходит в первые 3-5 недель беременности, поэтому крайне важно принимать фолаты не только в первом триместре, но и в прегравидарном периоде.
Назначать препараты, содержащие фолиевую кислоту, необходимо до планируемой беременности не менее, чем за 8-12 недель. Именно столько времени необходимо для накопления клетками минимально достаточного количества фолатов, обеспечивающего профилактику осложнений беременности и пороков развития у плода. Во время беременности прием фолатов продолжается до 12 недель на протяжении всего периода закладки органов и систем плода и формирования плаценты. При этом следует учитывать, что назначение высоких доз синтетической фолиевой кислоты (более 400 мкг/сут) может быть сопряжено с неблагоприятным последствиями, как для матери, так и для новорожденного.
Оптимальной альтернативой синтетической фолиевой кислоте является метафолин, входящий в состав Фемибиона, особенно у женщин c генетическим полиморфизмом фермента МТГФР. В этих случаях дополнительный прием фолатов проводится не только на прегравидарном этапе и в первом триместре, но и на протяжении всей беременности, а также до полугода послеродового периода.
Рис 1.
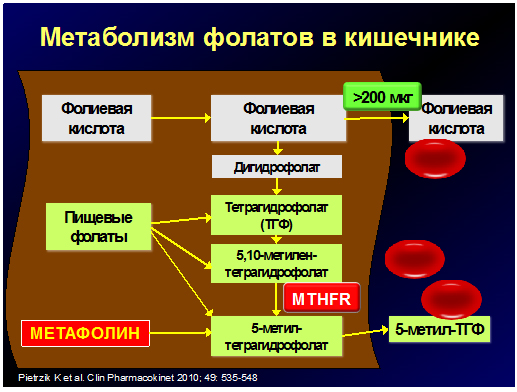
Рис.2
Список литературы:
1. Bentley S, Hermes A, Phillips D, et al. Comparative effectiveness of a prenatal medical food to prenatal vitamins on hemoglobin levels and adverse outcomes: a retrospective analysis. Clin Therapeut 2011;33:204–210.
2. Bodnar LM, Himes KP, Venkataramanan R, et al. Maternal serum folate species in early pregnancy and risk of preterm birth. Am J Clin Nutr. 2010;92:864–871.
3. Bukowski R, Malone FD, Porter FT, et al. Preconceptional folate supplementation and the risk of spontaneous preterm birth: a cohort study. PLoS Med. 2009;6:e1000061.
4. Crider KS, Yang TP, Berry RJ, Bailey LB. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate’s role. Adv Nutr. 2012;3(1):21–38.
5. Czeizel AE, Puho EH, Langmar Z, et al. Possible association of folic acid supplementation during pregnancy with reduction of preterm birth: a population-based study. Eur J Obstet Gynecol Reprod Biol. 2010;148:135–140.
6. Duthie SJ. Folat and cancer: how DNA damage, repair and methylation impact on colon carcinogenesis. J Inherit Metab Dis. 2011;34:101-109.
7. Fekete K, Berti C, Trovato M, et al. Effect of folate intake on health outcomes in pregnancy: a systematic review and meta-analysis on birth weight, placental weight and length of gestation. Nutr J. 2012;11:75-86.
8. FIGO Working Group on Best Practice in Maternal–Fetal Medicine International Journal of Gynecology and Obstetrics 2015; 128: 80–82
9. Greenberg JA, Bell SJ, Guan Y, et al. Folic Acid Supplementaion and Pregnancy: More Than Just Neural Tube Defect Prevention. Rev Obstet Gynecol. 2011;4(2):52-59.
10. Kidd PM. Alzheimer’s disease, amnestic mild cognitive impairment, and age–associated memory impairment: current understanding and progress toward integrative prevention. Altern Med Rev. 2008;13:85–115.
11. Kim MW, Hong SC, Choi JS, et al. Homocysteine, folate and pregnancy outcomes. J Obstet Gynaecol. 2012;32(6):520-524.
12. Kim YI. Folate and colorectal cancer: an evidence-based critical review. Mol Nutr Food Res. 2007;51(3):267–292.
13. Lamers Y, Prinz-Langenohl R, Bramswig S, Pietrzik K. Red blood cell folate concentrations increase more after supplementation with [6S]-5-methyltetrahydrofolate than with folic acid in women of childbearing age. Am J Clin Nutr. 2006;84(1):156–161.
14. Lumley J, et al. Periconceptional supplementation with folate and/or multivitamins for preventing neural tube defects. Cochrane Database of Systematic Reviews. 2007. Issue 4. Art. No.:CD001056.
15. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Circulating unmetabolized folic acid and 5-methyltetrahydrofolate in relation to anemia, macrocytosis, and cognitive test performance in American seniors. Am J Clin Nutr. 2010;91:1733–1744.
16. Pietrzik K, Bailey L, Shane B. Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin Pharmacok. 2010;49(8):535–548.
17. Prinz-Langenohl R, Bramswig S, Tobolski O, et al. (6S)-5-methyltetrahydrofolate increases plasma folate more effectively than folic acid in women with the homozygous or wild-type 677C,T polymorphism of methylenetetrahydrofolate reductase. Br J Pharmacol 2009;158:2014-2021.
18. Puri M, Kaur L, Walia GK, et al. MTHFR C677T polymorphism, folate, vitamin B12 and homocysteine in recurrent pregnancy losses: a case control study among north Indian women. J Perinat Med.2013;41(5):549-554.
19. Sauer J, Mason JB, Choi SW. Too much folate: a risk factor for cancer and cardiovascular disease? Curr Opin Clin Nutr Metab Care. 2009;12(1):30-36.
20. Takimoto H, Mito N, Umegaki K, et al. Relationship between dietary folate intakes, maternal plasma total homocysteine and B-vitamins during pregnancy and fetal growth in Japan. Eur J Nutrition. 2007;46(5):300–306.
21. Timmermans S, Jaddoe VW, Hofman A, et al. Periconception folic acid supplementation, fetal growth and the risks of low birth weight and preterm birth: the Generation R Study. Br J Nutr. 2009;102:777–785.
22. Van Guelpen B. Folate in colorectal cancer, prostate cancer and cardiovascular disease. Scand J Clin Lab Invest. 2007;67(5):459-447.
23. Vogel S, Meyer K, Fredriksen A, et al. Serum folate and vitamin B12 concentrations in relation to prostate cancer risk – a Norwegian population?based nested case?control study of 3000 cases and 3000 controls within the JANUS cohort. Int J Epidemiol. 2013;42(1):201–210.
24. Williams PJ, Bulmer JN, Innes BA, Pipkin F. Possible roles for folic acid in the regulation of trophoblast invasion and placental development in normal early human pregnancy. Biol Reprod. 2011;84:1148–1153.
25. Wong Y, Almenda OP, McCaul KA, et al. Homocysteine, Frailty, and All-Cause Mortality in Older Men: The Health in Men Study. J Gerontol A Biol
26. Xiao Y, Zhang Y, Wang M, et al. Plasma S-adenosylhomocysteine is associated with the risk of cardiovascular events in patients undergoing coronary angiography: a cohort study. Am J Clin Nutr November. 2013;98:1162-1169.
27. Yang IV, Schwartz DA. Epigenetic mechanisms and the development of asthma // J Allergy Clin Immunol. 2012;130(6):1243–1255.







