Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ТРАВМАТИЧЕСКАЯ БОЛЕЗНЬ. ОПРЕДЕЛЕНИЕ, ДИАГНОСТИКА, ЛЕЧЕНИЕ"
Автор: Лобанов Г.В.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Неврология, Ревматология, Семейная медицина/Терапия, Травматология и ортопедия
Просмотров: 6 191
Дата проведения: с 02.06.2015 по 02.06.2016
Политравма является одной из трех основных причин смертности населения, причем у пациентов в возрасте до 40 лет эта причина выходит на первое место.
По данным Международного Травматологического регистра 1993-1997 ( n -2069)
|
ТРАВМА: |
|
|
Головы |
39,2% |
|
Грудной клетки |
44,5% |
|
Брюшной полости |
18,9% |
|
Скелета |
42,1% |
 Под «политравмой» подразумевается одновременное ранение нескольких частей тела или органов, причем минимум одно из этих ранений или их комбинация угрожает жизни и здоровью пострадавшего. По определению немецкого общества неотложной хирургии, для диагноза политравма степень тяжести травмы должна быть больше или равной 16 баллам по Injury Severety Score (ISS). Последствия «тяжелых» изменений организма ассоциируются с понятием «травматическая болезнь».
Под «политравмой» подразумевается одновременное ранение нескольких частей тела или органов, причем минимум одно из этих ранений или их комбинация угрожает жизни и здоровью пострадавшего. По определению немецкого общества неотложной хирургии, для диагноза политравма степень тяжести травмы должна быть больше или равной 16 баллам по Injury Severety Score (ISS). Последствия «тяжелых» изменений организма ассоциируются с понятием «травматическая болезнь».
Наиболее системно понятие «травматическая болезнь» введено во врачебную практику советскими учеными Селезневым С.А. и Худайбереновым Г.С. в 1984 г. Так как они были известны как патофизиологи, то понятие «травматическая болезнь» несколько раз дополнялась позже клиницистами – анестезиологами, травматологами, хирургами, нейрохирургами и еще 15 основными специалистами, которые сталкиваются с этой группой пострадавших. Травматическая болезнь – нарушение жизнедеятельности организма, возникающее в результате повреждений, вызванных чрезмерными механическими воздействиями, проявляющееся сложным комплексом расстройств его функций, неодинаковыми в разные ее периоды, и совокупностью приспособительных (адаптивных) реакций, направленных на сохранение жизни организма и восстановление нарушенных функций и структур.
В ответ на массивное разрушение из клеток при травме в кровообращение попадает митохондриальная DAMPs (MTDs), которая формирует «митохондриальную бурю» в организме – при массивной травме резко снижается запас энергии в клетках, меняются метаболические процессы. Мобилизуются иммунные механизмы, запускаемые при сепсисе, и формируется данное состояние. «Митохондриальная буря» перерастает в «цитокиновый шторм» QinZhang, MustafaRaoof, YuChenetal. – Nature 464, 104-107 (4 March 2010).
Травматическая болезнь = Синдром системного воспалительного ответа
SIRS (Systemic Inflammatory Response Syndrome).
Синдром системного воспалительного ответа был открыт микробиологами при исследовании воспалительных процессов. В последние десять лет клиницисты, занимающиеся изучением травматической болезни, отметили ключевую связь между травмой, воспалением и SIRS (ССВО). ССВО – состояние, при котором иммунная система человека, и без того ослабленного тяжелой травмой, вырабатывает большое количество медиаторов воспаления – цитокинов (т.н. «цитокиновый шторм»). Из-за этого в воспалительный процесс вовлекается весь организм, появляются серьезные нарушения свертываемости крови, и, как следствие, расстройства микроциркуляции и недостаток кровоснабжения органов – формирование полиорганной недостаточности.
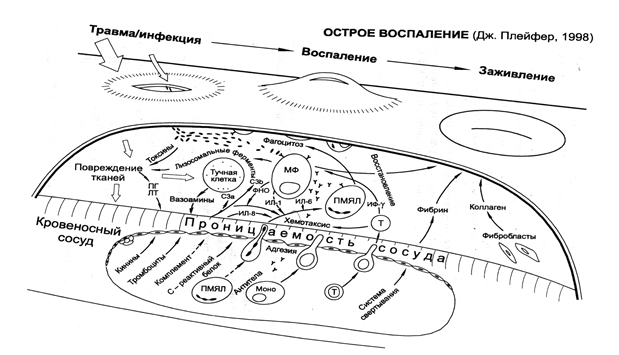
Рисунок 1. Острое воспаление
Объединение данных об изменениях в иммунном статусе, вызванные травмой, с клиническим течением и периодизацией травматической болезни позволило разработать концепцию «формирования полиорганной дисфункции при политравме». В ее основе лежит неадекватное функционирование систем иммунореактивности, именуемое иммунным дистресс-синдромом (рис. 1).
В функции цитокинов входит (рис. 2):
– участие в воспалительной реакции;
– участие в регуляции роста и дифференциации отдельных клеток;
– воздействие на опухолевый рост;
– обеспечение иммунной защиты;
– участие в регенерации поврежденных тканей.
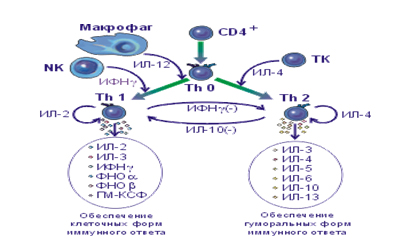
Рисунок 2. Функции цитокинов
Патофизиологические проявления травматической болезни:
1. Кровопотеря.
2. Гипоксия.
3. Ацидоз.
4. Ишемия органов.
Чаще в литературе это представлено триадой летальности (рис. 3).
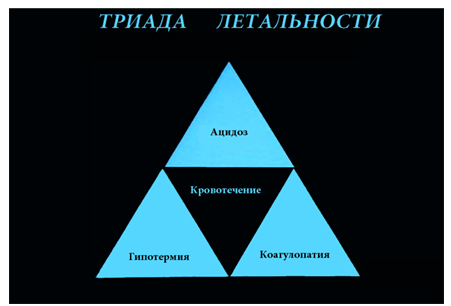
Рисунок 3. Триада летальности
Травматическая болезнь, как и любое другое заболевание, характеризуется по следующим критериям:
1) причина;
2) морфологический субстрат;
3) основные патогенетические механизмы;
4) динамика;
5) степень тяжести;
6) клинические формы и проявления.
Основными синдромами, отражающими нарушения жизненно важных функций организма у пострадавших с тяжелой травмой, в том числе, с политравмой, являются перфузионный дефицит с развитием реперфузионного синдрома (синдром гемодинамических нарушений); синдром дыхательных нарушений; синдром неврологических и психоэмоциональных расстройств. С учетом перечисленных основных синдромов должен строиться весь процесс оказания помощи пострадавшим.
Первичный осмотр пострадавшего с тяжелой травмой на месте происшествия (догоспитальный этап) предусматривает следующий алгоритмизированный порядок действий:
А (Airway) – обеспечение проходимости дыхательных путей (удаление инородных тел, предупреждение «западения» языка, аспирации крови, рвотных масс и др.) и контроль положения шейного отдела позвоночника.
В (Breathing) – борьба с явлениями гиповентиляции, выявление и устранение опасных осложнений повреждений грудной клетки.
С (Circulation) – оценка адекватности кровообращения, остановка наружного кровотечения, лечение гиповолемии (инфузионная терапия).
D – (Disability / neurology) – оценка степени нарушения сознания и других неврологических нарушений (парезы, параличи).
При оказании неотложной помощи в первую очередь устраняется непосредственная опасность жизни пострадавшего, при наличии показаний выполняется сердечно-легочная реанимация. Выполняется транспортная иммобилизация поврежденных сегментов конечностей. Обеспечивается транспортировка пострадавшего в стационар для оказания госпитального этапа неотложной помощи.
При наличии признаков повреждения сегментов опорно-двигательного аппарата (переломы, вывихи и др.) на догоспитальном этапе, помимо отмеченных выше мероприятий, входящих в алгоритм оказания помощи (А, В, С, D), следует выполнить остановку наружного кровотечения, адекватное обезболивание, транспортную иммобилизацию, наложение асептических повязок при наличии повреждений кожных покровов.
Госпитальный этап лечения политравмы включает повторное выполнение (контроль) мероприятий первичного осмотра (А, В, С, D), после чего выполняется следующий этап осмотра – E (Exposure) –- обнажение больного и осмотр с головы до пят.
В большинстве случаев политравма сопровождается шоком, нарушением общего состояния пациента, возможно нарушение сознания, особенно когда составной частью политравмы является черепно-мозговая травма. Важнейшим аспектом является выделение так называемого доминирующего повреждения, под которым понимается повреждение, наиболее опасное для жизни пострадавшего на данном этапе лечения. Современная концепция «damagecontrol» требует формирования тактики ведения пострадавшего, предусматривающей лечение доминирующих повреждений в первую очередь. В отношении прочих травм помощь в неотложном порядке оказывается в объеме, обеспечивающем предупреждение значимых осложнений, прочие мероприятия осуществляются по мере стабилизации состояния пострадавшего.
Исходя из упомянутых выше ведущих патогенетических факторов, определяющих течение и исход травматической болезни, задачи реанимационного и лечебно-диагностического комплекса для пострадавших с политравмой современные исследователи формулируют следующим образом:
– нормализация и стабилизация центральной гемодинамики путем восстановления ОЦК;
– восстановление периферического кровообращения (микроциркуляции и реологических свойств крови);
– компенсация дефицита жидкости в интерстициальных пространствах и нормализация процессов ультрафильтрации и реабсорбции в транскапиллярном обмене;
– восстановление кислородной емкости крови и коррекция искусственной гемодилюции;
– коррекция синдрома эндогенной интоксикации;
– компенсация расстройств метаболизма, восстановление тканевого обмена и иммунокоррекция.
В организационном и практическом плане порядок осуществления мероприятий, обеспечивающих выполнение этих задач, исходя из известных работ по вопросам политравмы, может быть сформулирован следующим образом.
1. Определение АД, пульса, дыхания; общий осмотр, выявление грубых повреждений; по показаниям – закрытый массаж сердца, ИВЛ.
2. Катетеризация вены, измерение центрального венозного давления, взятие крови для лабораторных анализов; интубация трахеи (по показаниям), катетеризация мочевого пузыря; по показаниям – эвакуация желудочного содержимого. Реализуется так называемое правило «трех катетеров» (внутривенный (по показаниям могут быть задействованы 2-3 вены), уретральный, назо(оро)гастральный).
3. Инфузионно-трансфузионная терапия (ИТТ); иммобилизация поврежденных сегментов, выполнение адекватной анестезии, в том числе, по показаниям, новокаиновых блокад. При наличии показаний производятся: ИВЛ, пункция плевральной полости, лапароцентез, что позволяет оценить необходимость и характер экстренных и срочных оперативных вмешательств.
По выполнении перечисленных мероприятий появляется возможность выполнения системного осмотра; коррекции гемодинамики с учетом выявленной клинической картины (и наблюдения за ее динамикой) и полученных данных лабораторных показателей; соответствующей коррекции метаболизма; выполнения рентгенологической диагностики и (по показаниям) других видов диагностики (ультразвуковое исследование, компьютерная томография и др.). Получение необходимых диагностических данных позволяет сформулировать диагноз, количественно оценить тяжесть травмы и состояния пострадавшего на основе одной из существующих оценочных шкал. Формулировка диагноза и оценка динамики статуса с учетом проведенных мероприятий неотложной помощи дают основания для разработки программы лечения пострадавшего на ближайший период.
В условиях оказания неотложной помощи пострадавшему с политравмой имеются определенные особенности в проведении рентгенологической диагностики. Так, в случае, когда сознание пострадавшего нарушено, сбор жалоб затруднен или невозможен, а обстоятельства травмы и объективные данные не позволяют исключить соответствующее повреждение, назначаются в обязательном порядке рентгенография шейного отдела (как минимум, в боковой проекции), обзорная рентгенография таза, обзорная рентгенография грудной клетки. Прочие рентгенограммы выполняются по показаниям (деформация сегмента, патологическая подвижность и др.).
После установленной тяжести разрушения организма возникает необходимость прогноза дальнейшего течения процесса. Наиболее удачную, с нашей точки зрения, периодизацию травматической болезни предложили С.А. Селезнев и Г.С. Худайберенов (1984), выделив 4 периода: острой реакции на травму (до 2-х суток); ранних проявлений (до 14 суток); поздних проявлений (свыше 14 суток); реабилитации (табл. 1).
Таблица 1. Периоды травматической болезни
(по С.А. Селезневу и Г.С. Худайберенову, 1984)
|
Периоды |
Патологические процессы, возникающие на разных стадиях травматической болезни |
|
1. Острая реакция на травму (до 2 суток) |
Острая кровопотеря. Травматический шок. Травматический токсикоз. Жировая эмболия. |
|
2. Ранние проявления (до 14 суток) |
Выраженные нарушения функции органов и систем: нарушение функций центральной нервной системы; расстройства дыхания; циркуляторные нарушения, печеночно-почечная недостаточность; нарушение водного и электролитного баланса; угнетение иммунологической реактивности |
|
3. Поздних проявлений (свыше 14 суток) |
Развитие дистрофических и склеротических процессов. Замедление консолидации переломов, образование ложных суставов |
|
4. Период реабилитации |
Частичное или полное восстановление функций организма |
Стимулы, которые возбуждают провоспалительные медиаторы и приводят к LIRS и SIRS, параллельно индуцируют и противоположную группу медиаторов, названную Роджером Боуном («отец» SIRS) противовоспалительными, вызывают так называемый CARS (Сompensatory Antiinflammatory Response Syndrome) – компенсаторный противовоспалительный синдром. CARS клинически проявляется иммунодепрессией и повышенной чувствительностью к инфекции, которые особенно заметны после больших операций и травм.
SIRS, MARS и CARS – составляющие (стадии) системной воспалительной реакции, одного патологического процесса, именуемого иммунным дистресс-синдромом. Временной разрыв между SIRS и CARS, клинически проявляющийся в период относительного благополучия, некоторые исследователи именуют термином MARS – (Mixed Antagonistic Response Syndrome) – синдром смешанного антагонистического ответа.
При анализе периоды протекания травматической болезни и иммунного дистресс-синдрома совпадают. Острый период ТБ соответствует периоду воспалительного процесса при SIRS, а далее наступает депрессия иммунной системы (CARS). Между ними – MARS – синдром уравновешенных систем. На воспалительный ответ организм, как правило, запускает противовоспалительный ответ. И если больной находится в равновесии между SIRS и CARS, есть возможность вернуться к процессу выздоровления. Если равновесие смещается в сторону CARS – депрессии, то развивается тяжелое осложнение инфекционного характера.
Периоды травматической болезни с позиций иммунного дистресс-синдрома представлены в таблице 2. Эти данные определяют стратегию и тактику лечебных мероприятий, как консервативных, так и оперативных.
Таблица 2. Периоды травматической болезни (по С.А. Селезневу и Г.С. Худайберенову, 1984) с позиций иммунного дистресс-синдрома
|
Периоды ТБ |
Характеристика периода (основные проявления) |
|
1. Острой реакции на травму (до 2 суток) |
Период перфузионного дефицита с последующим развитием реперфузионного синдрома и инициации синдрома системного воспалительного ответа (SIRS). Иммунотоксикоз – 2-я подстадия SIRS. |
|
2. Ранних проявлени й ТБ (до 14 суток) |
Стадия иммунодефекта (MARS). Проявление полиорганных нарушений (от дисфункции до несостоятельности). При неблагоприятном течении развитие иммунопаралича (CARS) и прогрессирование ПОН. |
|
3. Поздних проявлений ТБ (свыше 14 суток ) |
Развитие дистрофических и склеротических процессов. Замедление консолидации переломов. Образование ложных суставов. Посттравматический остеомиелит. |
|
4. Период реабилитации |
Частичное или полное восстановление функций организма. |
В мировой литературе понятию «травматическая болезнь» отвечает термин «синдром полиорганной недостаточности». Понятие «синдром полиорганной недостаточности» (ПОН) применяется в том случае, чтобы лучше описать совокупность изменений, которые возникают в больше чем одной системе органов. При этом подчеркивается особая роль иммунологических нарушений в формировании полиорганной недостаточности при критических состояниях. Проведение полной аналогии между концепциями ТБ и ПОН невозможно. Они различаются и в клиническом и в методологическом плане, но их объединяют общие взгляды на механизмы формирования полиорганной недостаточности (рис. 4).
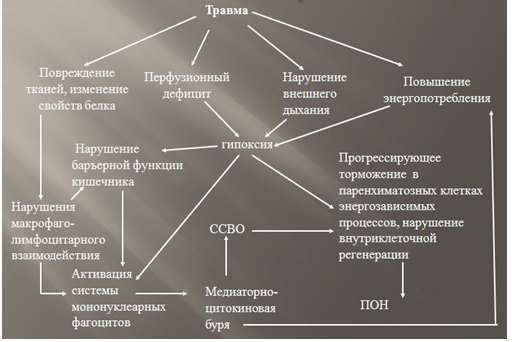
Рисунок 4. Формирование полиорганной недостаточности у больных с полисистемными повреждениями
C ПОН (синдром полиорганной недостаточности) – клинический «парадокс»
формируется при нарушениях функции органов, которые непосредственно не подвергаются прямому повреждению; органная недостаточность наступает одновременно или последовательно; рано или поздно развивается бактериемия; лечение инфекции не увеличивает выживаемости (пусковой механизм ПОН не обязательно инфекция).
Запуск механизмов иммунного дистресс-синдрома и его первой фазы – ССВО происходит при условии избыточного поступления антигенов.
Их основными источниками являются:
• поврежденные ткани;
• избыток в системном кровотоке цитокинов с цитотоксической активностью;
• органная ишемия и гипоксия тканей;
• воздействие на клетки «окислительного стресса»;
• антигены и факторы вирулентности этиопатогенов;
• микротромбоз сосудов;
• переливание крови.
Приобретенный нами опыт свидетельствует о том, что, несмотря на проводимую, казалось бы, адекватную кровопотере гемотрансфузионную терапию в остром периоде травмы и продолжение ее в последующем, в раннем периоде достичь нормальных показателей красной крови не удается. Операция по пересадке ткани (переливание крови) – сама становится условием развития иммунного дистресс-синдрома. Это в свою очередь изменяет метаболизм при синдроме системного воспалительного ответа (по И.Н. Лейдерман и др., 1997), что сопровождается формированием типовых ответов организма, которые мы уже в состоянии проконтролировать (табл. 3).
Таблица 3.
|
Метаболизм углеводов |
Толерантность клеток к глюкозе. Скорость продукции глюкозы гепатоцитами возрастает с 2,5 до 4,4-5,1 мг/кг/мин. Мобилизация аминокислот из миоцитов скелетной мускулатуры и висцеральных клеток для глюконеогенеза. |
|
Метаболизм протеинов |
Перераспределение протеинов для глюконеогенеза, синтез «острофазовых» белков, цитокинов. Несмотря на повышенный синтез белка, преобладает распад белковых субстанций (катаболизм) – отрицательный азотистый баланс. |
|
Метаболизм липидов |
Активация липолиза. Снижение утилизации жирных кислот и триглициридов тканей. Снижение активности липопротеинлипазы. |
Согласно данным С.Е. Гурьева, развитие полиорганной недостаточности в виде подострых системных процессов и дегенеративно дистрофических процессов, составляет 65%, а инфекционные процессы составляют 82%.
Следом возникает вопрос: что можно считать стабилизацией адаптации при политравме? Чем ее проконтролировать? Где критерии, по которым можно сказать, что это – «стабилизация адаптации», и ее можно оперировать, а это – «декомпенсация», и оперировать нельзя, больной может умереть.
Следует отметить, что разработанная совместными усилиями клиницистов и патофизиологов современная концепция травматического шока позволила внедрить в клиническую практику комплекс организационных и противошоковых мероприятий, что дало возможность во многих случаях предотвратить гибель пострадавших в остром периоде травмы. Однако, как показала практика, выведение пострадавшего из шока не является завершением лечения. Часть больных, успешно выведенных из шока, погибает спустя несколько суток от различных осложнений, прямо не связанных с травмой. Стало очевидным, что выведение из шока не решает окончательно проблему выздоровления больного после травмы, но открывает новую проблему – предупреждение и лечение полиорганной недостаточности как основной причины смерти в постшоковом периоде. Эта проблема усугубляется тем, что политравма относится к области междисциплинарных знаний. Для оказания помощи больным с этой патологией привлекаются специалисты различного профиля. Высокая летальность и инвалидность пострадавших может объясняться не только тяжестью травмы, но и решением локальных проблем (выбор методов, сроков и объема оперативного вмешательства при лечении травм отдельных локализаций) врачами «узких специальностей» в отрыве от общих закономерностей развития реакции организма на тяжелую травму без учета существования синдрома взаимного отягощения. Результаты наблюдений позволяют разработать тактические подходы к лечению через концепцию метаболической реабилитации организма в тяжелом иммунном дистресс-синдроме.
Метаболическая реабилитация – представляет собой восстановление суммарного метаболического ответа организма на генерализованную воспалительную реакцию, обусловленную гиперметаболизмом, проявляющуюся дисэлектролитемией, белковой недостаточностью и прогрессирующим травматическим истощением.
Принципы «метаболической реабилитации» при травматической болезни включают:
¨ Предложен и теоретически обоснован принцип «допустимой гипотензии», обеспечивающей перфузию тканей при субнормальных цифрах АД (100 мм рт.ст.) и способствующей остановке кровотечения.
¨ Доказано, что в остром и раннем периодах ТБ сердечная деятельность и оксигенация тканей не страдает при снижении показателей красной крови (в условиях обеспечения нормоволемии) до: эритроцитов 2,8 т/л, Нb 80г/л, Нt 32 об.%.
¨ Ранняя малоинвазивная хирургическая ресусцитация, обеспечивающая остановку кровотечения из костной раны и прекращение болевой эфферентной импульсации из зон повреждений (фиксация повреждений с использованием концепции «отдельно управляемого стержня»).
¨ Оперативное лечение сопровождается ранней опережающей интенсивной терапией с применением продленной искусственной вентиляцией легких.
¨ В разгар ССВО (3–7 суток) операции на костях исключаются, во избежание развития феномена «второго удара».
Постараемся системно обосновать эти принципы. Существует так называемое правило «золотого часа», суть которого заключается в том, что наиболее эффективной является помощь, оказанная до наступления тяжелых (тем более, необратимых) микроциркуляторных и метаболических расстройств в органах и тканях. Именно потому важнейшее значение имеет не только госпитальная, но и догоспитальная помощь. То есть опережающая метаболическая поддержка страдающих процессов позволяет изменить их тяжесть и направленность.
При политравме концепция травматической болезни как иммунного дистресс-синдрома и вытекающие из нее практические рекомендации имеют особое значение. Рассмотрим основные принципы лечения пострадавших с политравмой в остром периоде и периоде ранних проявлений травматической болезни, которые во многом определяют прогноз течения травматической болезни и ее исход.
Первостепенной задачей в остром периоде травматической болезни является коррекция нарушений гемодинамики и обеспечение гемостаза. Наряду с устранением гемодинамических нарушений и гипоперфузии тканей, важными вопросами являются: остановка кровотечения, восстановление поврежденных органов и целостности сегментов опорно-двигательного аппарата, а также вопрос о сроках их проведения.
Инфузионно-трансфузионная терапия в остром периоде травматической болезни.
У больных с травмой таза обязательными мероприятиями в остром периоде являются определение дефицита ОЦК (наиболее простыми методами являются индекс Альговера) и его восполнение; адекватное обезболивание; стабилизация поврежденных костных сегментов; профилактика жировой эмболии; устранение тканевой гипоксии.
Программа и режим проведения ИТТ зависит от состояния гемодинамики. Для оценки гемодинамики необходимо исследовать: шоковый индекс (ШИ), сердечный индекс (СИ), удельное периферическое сопротивление (УПС), артериальное давление (АД), разности гематокритных показателей венозной и капиллярной гемодинамики крови, кожно-ректальный градиент, поминутный диурез. На основе этих показателей, а также принимая во внимание, что уровень артериального давления зависит от величины ОЦК, производительности сердца, сосудистого сопротивления, на основе этой зависимости нами предложена и используется классификация, которая, по нашему мнению, наиболее полно отражает состояние гемодинамики при травме. Для удобства практического применения мы выделили три основных состояния гемодинамики: компенсированное, субкомпенсированное и декомпенсированное (табл. 4).
Таблица 4. Классификация состояния гемодинамики при политравме (О.Г. Калинкин, А.О. Калинкин, Авторское право № 25385, 20.08.2008)
|
Обеспечивается |
Компенсированное |
Субкомпенсированное |
Декомпенсированное |
|
Преимущественно за счет сосудистого компонента |
АД сист. > 100 мм рт. ст. УПС > 40,4 усл. ед СИ < 2,5 л/мин * м2 ШИ 0,8 ЦВД 6 – 12 см водн. ст. Ht v-c 1 об% t oC r-c 7oC Минутный диурез 20 кап. Лактат<4,0 млмоль/литр |
АД сист. <100 мм рт. ст. УПС > 32,6 усл. ед СИ < 2,7 л/мин * м2 ШИ 0,7 – 0,9 ЦВД <6 но <3 см водн. ст. Htv–c 2-3 об% toCr–coC Минутный диурез <20 кап. Лактат< 4,0 млмоль/литр |
АД сист. <80 ммрт.ст. УПС >24,2 усл. ед СИ < 2,5 л/мин * м2 ШИ 1,1 –1,4 ЦВД 3.0 и <см.водн. ст. Ht v-c t oC r-c10-12 oC Минутный диурез 0 кап. Лактат> 4,0млмоль/литр |
|
Преимущественно за счет сердечного компонента |
АД сист. >100 мм рт. ст. УПС > 32,4 усл. Ед. СИ < 4,2 л/мин * м2 ШИ 0,8 ЦВД 6 – 12 см водн.ст. Ht v-c 1 об% t oC r-c 7oC Минутный диурез 20кап. Лактат< 4,0 млмоль/литр |
АД сист. <100 мм рт. ст. УПС > 30,7 усл. ед СИ < 2,9 л/мин * м2 ШИ 0,7 – 0,9 ЦВД <6 но <3 см водн. ст. Htv–c 2-3 об% toCr–coC Минутный диурез < 20 кап. Лактат< 4,0 млмоль/литр |
|
|
Равным соотношением компонентов |
АД сист. >100 мм рт. ст. УПС 34,4 усл. ед СИ 3,5 л/мин * м2 ШИ 0,8 ЦВД 6 – 12 см водн.ст. Htv-c 1 об% t oC r-c 7oC Минутный диурез 20 кап Лактат< 4,0 млмоль/литр |
Согласно предложенной классификации, компенсированное состояние гемодинамики характеризуется сохранением уровня систолического АД на цифрах, превышающих 100 мм рт.ст. В свою очередь компенсация в зависимости от величин, характеризующих сосудистый тонус (УПС) и производительность сердца (СИ), может обеспечиваться преимущественно за счет сосудистого компонента или преимущественно за счет сердечного компонента, а также содружественно – за счет равных соотношений этих компонентов.
Субкомпенсированное состояние гемодинамики – это такое состояние, при котором уровень систолического АД ниже 100 мм рт.ст., но выше уровня, при котором нарушается перфузия тканей, прекращается фильтрация мочи.
Декомпенсированное состояние гемодинамики – это такое состояние, при котором компенсаторные возможности организма истощаются, и он не в состоянии поддерживать ни минутный объем сердца, ни периферический сосудистый тонус на уровне, обеспечивающем перфузию тканей.
Терапию начинают со струйного введения кристаллоидов или коллоидов, не допуская резкого подъема АД с тем, чтобы не срывать первичные тромбоцитарные рыхлые тромбы. Повышение ЦВД до 6-8 см водн.ст., нормализация кожной температуры, диуреза 20 и более капель в минуту, выравнивание гематокритных показателей венозной и капиллярной крови, стабилизация артериального давления свидетельствуют об устранении выраженной гиповолемии. При таких показателях переходят на капельный метод введения жидкости. По данным публикаций, существуют различия во взглядах на эту проблему, отечественные рекомендации предполагают начинать инфузионную терапию с введения кристаллоидов, с последующим присоединением коллоидов и, по показаниям, других растворов. Темп введения и количество жидкости зависят от состояния гемодинамики.
При компенсированном состоянии гемодинамики восполнение ОЦК (рис. 5) проводится с применением растворов гидроксиэтилкрахмалов (10% рефортан плюс, стабизол – 7-10 мл/кг), гелофузина (7-10 мл/кг) или кристаллоидов (изотонический раствор натрия хлорида, раствор Рингер-Локка – 15-30 мл/кг). Декстраны в настоящее время применяются значительно реже в связи с имеющимися сведениями об их нефротоксичности в результате накопления в канальцах нефрона. Темп инфузионной терапии составляет 8-15 мл/мин. Учитывая высокий риск развития жировой эмболии легких при переломах костей таза и перегрузки малого круга кровообращения, оптимальным при такой травме является катетеризация подключичной вены, проведение инфузионной терапии под контролем ЦВД. Нужно учитывать, что высокий темп инфузий может привести к резкому подъему АД и усилению кровотечения за счет выдавливания тромбов из поврежденных сосудов таза.
При субкомпенсированном состоянии гемодинамики восполнение ОЦК проводится сочетанным применением растворов гидроксиэтилкрахмалов (10% рефортан плюс, стабизол – 10-15 мл/кг), гелофузина (10-15 мл/кг), кристаллоидов (изотонический раствор натрия хлорида, раствор Рингер-Локка – 20-40 мл/кг). Скорость инфузий – 10-20 мл/мин. С целью связывания свободных жирных кислот возможно переливание 10-20% раствора альбумина в дозе 2мл/кг и скоростью введения 2-3 мл/мин.
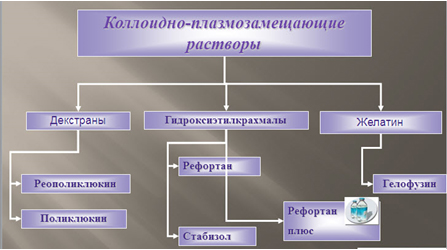
Рисунок 5
При декомпенсированном состоянии гемодинамики восполнение ОЦК осуществляется растворами гидроксиэтилкрахмалов (10%рефортан плюс, 20-25 мл/кг), кристаллоидов (изотонический раствор натрия хлорида, раствор Рингера-Локка – 30-50 мл/кг), а также препаратов крови (эритроцитарная масса, размороженные или отмытые эритроциты). Восполнение кислородной емкости крови проводят одногруппной эритроцитарной массой, размороженными или отмытыми эритроцитами.
Следует отметить, что применение трансфузий донорской крови и ее компонентов может приводить к ряду последствий иммунологического, инфекционного и технического характера – это несовместимость как по резус-принадлежности, так и по системе АВ0; передача инфекционных заболеваний бактериальной и вирусной этиологии (гепатит В, ВИЧ-инфекция, цитомегаловирусная и ретровирусная инфекции, сифилис, малярия и пр.е); синдром массивных трансфузий, попадание в кровоток больного микротромбов, образование комплексных соединений кальция, гиперкалиемия, усугубление посттравматического иммунодефекта и др. Все перечисленные факторы обусловили интенсивный поиск путей ограничения использования донорской крови и ее компонентов.
В остром и раннем периодах травматической болезни пределом снижения показателей красной крови (в условиях обеспечения нормоволемии) считали: эритроциты – 2,8 т/л, Нb – 80 г/л, Нt – 32 об.%. Нашими исследованиями доказано, что при таких условиях сердечная деятельность и оксигенация тканей не страдают. Ниже этого предела развивается гипоксия (Калинкин О.Г., Курапов Е.П., Калинкин А.О. и др., 2007). Для восстановления кислородной емкости крови использовали эритроцитарную массу и/или отмытые, размороженные эритроциты. С целью пополнения факторов свертывания переливали одногруппную свежезамороженную плазму (3-10мл/кг). Скрытую коагуляцию купировали введением бемипарина натрия 2500 (пк 1 раз в сутки).
Если нормализация гемодинамики и прежде всего АД не достигается восполнением потерянного объема крови, может потребоваться вазопрессорная поддержка (допамин 10-15 мкг/кг/час).
Важнейшей задачей в лечении больного с политравмой является адекватное мультимодальное обезболивание Kehlet&Dahl, 1993 (рис. 6). В остром периоде применяются фармакологические средства, являющиеся агонистами эндогенной антиноцицептивной системы: морфин 0,3-0,5 мг/кг/сутки. Выраженным анальгетическим эффектом обладают трамадол – 1,5 мг/кг/сутки, декскетопрофен (50 мг (2 мл) в 30 мл физиологического раствора, раствора глюкозы или раствора Рингера в течение не менее 15 секунд каждые 8-12 часов). С целью охранительного торможения головного мозга и уменьшения нейровегетативной реакции назначают диазепам 0,15-0,25 мг/кг/сутки, дроперидол 0,7-1,5 мг/кг.
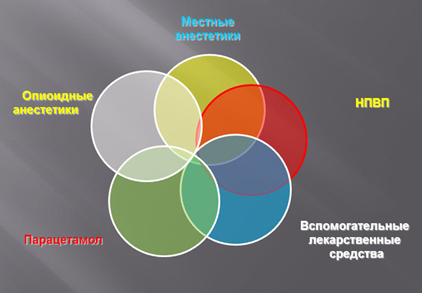
Рисунок 6.
S-(декс) кетопрофен–высокая эффективность обезболивающего действия:
Высокая липофильность обеспечивает проникновение через ГЭБ.
Способность оказывать центральное действие на уровне задних столбов спинного мозга – деполяризация нейронов.
Способность селективно блокировать рецепторы NMDA (N-метил D-аспартат), которые участвуют в модуляции болевого импульса – ингибирует образование кинуреновой кислоты – антагониста NMDA.
Прямое и быстрое действие на трансмиссию боли.
Для быстрого купирования болевого синдрома препаратом выбора является диклофенак, обладающий следующим свойствами:
Быстрое купирование боли.
Быстрое восстановление нарушенных функций.
Разнообразие форм выпуска и дозировок.
Высокая безопасность.
Диклофенак – производное арилуксусной кислоты. Является органической кислотой со сравнительно низким рН, благодаря чему активно связывается с белками плазмы и накапливается в очаге воспаления. Хорошо проникает в полость суставов, достигая максимума концентрации на 2-4 час.
Препарат выгодно отличается от других НПВП тем, что выпускается в различных лекарственных формах – таблетированной обычной, пролонгированной, инъекционной, ректальных свечах, а также для локальной терапии.
Способность купировать боль разного происхождения является главным фактором широкого применения препарата Диклофенак в терапевтической, хирургической и ревматологической практике. Механизм действия связан с угнетением экссудативной и пролиферативной фазы воспаления. При этом снижается образование различных простагландинов, простациклинов в очагах воспаления и предупреждается образование свободных радикалов из циклических эндоперекисей и перекисей липидов в клеточных мембранах, что приводит к снижению воспаления.
Оптимизация тканевого дыхания достигается введением антигипоксантов, природных переносчиков электронов – мексидол 2-6 мл/сутки, цитохром С в дозе 0,5 – 1мг/кг в сутки. Патогенетически обоснованным является введение ингибиторов протеаз в дозах 100 000 ЕИК), эндотелиопротекторов (тиоктовая кислота 300-600мг/сутки, этамзилат 4-8 мл в сутки).
С целью покрытия возросших потребностей организма как в пластическом, так и энергетическом материале и снижения синдрома гиперкатаболизма-гиперметаболизма («аутоканнибализма»), уменьшения протеолиза собственных структурных белков (мышц, висцеральных), улучшения синтеза альбумина, рекомендуется ранняя нутритивная поддержка с применением сбалансированных растворов аминокислот 10% – 7-10 мл/кг/сутки). Проведение парентерального питания показано при выраженном катаболизме (потери более 15 г азота мочевины в день) и невозможности полноценного питания per os. Нутритивная поддержка метаболизма – основная задача питания. Необходимо обеспечить поступления белка в большем количестве, чем количество расщепляемого белка (рис. 7).
Воздействие энтерального питания на гастроинтестинальный тракт
– улучшение интерстициональной перфузии;
– стимуляция пролиферации клеток слизистой;
– стимуляция интестинальной иммунной системы.
– снижение воспалительной реакции;
– стимуляция энтеральной нервной системы и моторики;
– нормализация интестинальной микрофлоры;
– стимуляция желчной и панкреатической секреции;
– стимуляция секреции трофического интерстициального гормона.
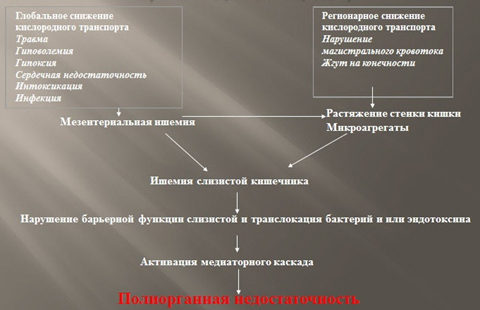
Рисунок 7. Роль кишечной трубки в развитии полиорганной недостаточности у больных с тяжелой механической травмой (модифицировано по Mythen M.G., Webb A.R., 1994)
Инфузионно-трансфузионная терапия в период ранних проявлений травматической болезни (2–14-е сутки).
Объем необходимой на сутки жидкости включает:
– физиологическую суточная потребность – 30 мл/кг/сутки (для больных с ожирением рассчитывается по «идеальной» массе тела);
– жидкость текущих патологических потерь – объем жидкости, теряемой больным перспирацией, с рвотой, отделяемым из ран и полостей (по дренажам и в повязки). Гипертермия на каждый 1°С свыше 37°С более 8 часов увеличивает объем на 7,5 мл/кг/сутки. Одышка на каждые 10 дыхательных движений выше нормы – на 7,5 мл/кг/сутки.
Поддержка проводится внутривенным (приоритетно в подключичную вену) и энтеральным путем. Скорость введения жидкости составляет 4-6 мл/мин. В состав инфузионной терапии входят растворы электролитов, растворы аминокислот. Несмотря на существующие рекомендации об ограничении применения альбумина в связи с прогрессированием синдрома «капиллярной утечки», у больных с политравмой таза его использование оправдано – с целью замещения гипоальбуминемии и связывания свободных жирных кислот (10-20% 1,5-3 мл/кг).
Причинами анемии являются:
– дефицит факторов свертывания;
– нестабильность и повторное смещение костных фрагментов;
– массивные вливания крови и ее препаратов;
– токсическое повреждение эритроцитов продуктами эндотоксемии.
Следует особо отметить, что в поддержании анемии в период ранних осложнений травматической болезни особую роль приобретает белковая недостаточность. Гемоглобин является типичным представителем лабильных белков, используемых в условиях белкового дефицита для синтеза более необходимых белковых структур, а функциональный резерв эритроцитов в условиях нормоволемии позволяет сохранить при этом эффективную транспортировку кислорода к тканям. Снижение содержания гемоглобина является характерным проявлением гипопротеинемии, которая приобретает решающее значение в сдвигах гомеостаза и, в частности, обусловливает неполный эритропоэз.
Наибольшие изменения изучаемых показателей выпадают на ранний период травматической болезни (5-14 сутки). Согласно классификации острых нарушений функции органов и систем, предложенной В.В. Чаленко показатели: креатинина, соотношений АСТ/АЛТ, тромбоцитов, имевшие место на 5-7 сутки, можно расценивать как показатели компенсированной недостаточности почек, печени, системы коагуляции. В период с 5 по 14 сутки имевшийся лейкоцитоз с палочкоядерным-нейтрофильным сдвигом и лимфопенией можно было рассматривать как проявление системного воспалительного ответа на травму и ее последствия. В этом же промежутке отмечались наибольшее проявление дыхательной недостаточности, вызванной РДСС и пневмонией. Интересно отметить, что в этот период меняется и характер компенсации гемодинамической нагрузки.
В связи с изложенным необходимо подчеркнуть, что предупредить развитие посттравматической анемии одними гемотранфузиями невозможно. Их роль сводится к временному замещению потерянной крови и устранению острой анемии, в дальнейшем неминуемо развивается анемия, степень выраженности и продолжительность которой зависят от выраженности и продолжительности нарушения белкового обмена. Следовательно, коррекция посттравматической анемии – это прежде всего коррекция белкового обмена. В свою очередь, о выраженности белковой недостаточности можно судить по степени выраженности анемии.
На фоне инфузионной терапии вводятся также диуретики.
С целью устранения гипоксемии показана обязательная оксигенотерапия при показателях насыщения артериальной крови кислородом (SpO2), измеряемого методом пульсоксиметрии ниже 90%. ИВЛ проводится при наличии показаний по А.П. Зильберу. При необходимости проведения длительной ИВЛ и обеспечения наилучшего доступа для систематической санации трахеобронхиального дерева показана трахеостомия. Важным фактором лечения ОДН является улучшение дренирования легких путем перкуссионного массажа, введения муколитиков, бронходилататоров, сурфактант-протекторов (липин 1-2 г в сутки). Обязательным компонентом терапии является введение средств, направленных на уменьшение образования токсических метаболитов кислорода и обезвреживание продуктов перекисного окисления липидов (мексидол 4-6 мл/ сутки, вит. С – до 1 г/с).
Следует отметить, что больные с множественными и сочетанными повреждениями опорно-двигательного аппарата являются группой риска в отношении развития такого грозного осложнения, как синдром жировой эмболии (СЖЭ), так как у подавляющего большинства пострадавших в первые сутки обнаруживаются жировые капли в крови в результате повреждения костного мозга и нарушения липидного обмена. Как показывает наш опыт (Е.И. Гридасова, 2005), у больных с переломами таза, в отличие от больных с переломами нижних конечностей, чаще развивается острая форма СЖЭ, проявляющаяся тяжелейшей легочной и сердечно-сосудистой недостаточностью в первые часы после травмы. При этом меры профилактики у пострадавших с политравмой должны быть направлены на нормализацию метаболизма, адекватное восполнение ОЦК и обезболивание, устранение гипоксемии (оксигенотерапия при показателях насыщения артериальной крови кислородом, измеряемого методом пульсоксиметрии, ниже 90%), назначение антигипоксантов и антиоксидантов (мексидол, витамин С, актовегин, цитохром,тиоктовая кислота 600 – 1200 мг/сутки). Тиоктовая кислота помимо отмеченного эффекта, подавляет процессы липолиза, снижает концентрацию свободных жирных кислот и триглицеридов. Традиционным в течение длительного времени являлось введение в 1-5-е сутки с момента травмы препаратов эссенциальных фосфолипидов, которые, согласно существующим представлениям, способствуют переходу крупных капель жира в более мелкие. В настоящее время в соответствии с принципами доказательной медицины убедительно подтверждена эффективность введения метилпреднизолона с целью профилактики СЖЭ (Cavallazzi R, Cavallazzi A.C., 2008). Следует учитывать, что действие препарата эффективно только при своевременном назначении препарата – 30 мг/кг двукратно (при поступлении больного и через четыре часа).
Следующая угроза, требующая учета в лечебном комплексе пострадавших с политравмой, высокий риск развития тромбоэмболических осложнений. Это обусловлено длительной иммобилизацией пострадавших (особенно при консервативном лечении), что способствует застою крови и повышению активности свертывающей системы. С целью профилактики тромбоэмболических осложнений всем больным с 3–5-х суток рекомендуется вводить препараты, улучшающие реологические свойства крови (пентоксифиллин), а также гепарины с низким молекулярным весом второй генерации в высоких профилактических дозах бемипарин натрия – дозирование соответственно риску возникновения венозной тромбоэмболии (умеренный/высокий). Введение первой дозы за 2 часа до начала или через 6 часов после операции. Профилактически применяют на протяжении всего периода риска развития тромбоэмболий или до полного восстановления двигательного режима пациента, как правило, не менее 7–10 дней после операции. Преимущества определяются как следующие:
• Обширная доказательная база, как для профилактики, так и для лечения тромбозов и ТЭЛА, применения при гемодиализе.
• Доступная цена в сравнении с другими прямыми антикоагулянтами.
• Удобство однократного суточного дозирования.
• Легкий и удобный режим дозирования для профилактики, лечения и гемодиализа (маленький объем инъекции – 0,2 мл; цветовая кодировка шприца).
Обязательным компонентом лечения пострадавших с политравмой является применение антибактериальных средств. Для профилактики и лечения гнойно-септических осложнений используется раннее назначение антибиотиков с широким спектром действия: карба- или имипенемы, цефалоспорины 3-4 поколения или фторхинолоны. После получения антибиотикограммы переходят на препараты, согласно чувствительности к ним микофлоры. Обязательным является применение противогрибковых средств (флуконазол 2 мг/кг 1 раз через 3-7 суток) параллельно с препаратами, восстанавливающими иммунный статус. Это естественным образом повышает эффективность лечения антибиотиками, усиливает противовоспалительный эффект, оказывает антианемичное действие.
Таблица 5. Фармакологические подходы к восстановлению цитоэнергетики
|
Переносящие электроны в дыхательной цепи |
Витамины К1 и К3, коэнзим Q10, янтарная кислота, цитохром С (цитомак) |
|
Кофакторы энергообмена |
Витамины РР, В1, В2, липоевая кислота, биотин, карнитин |
|
Уменьшающие степень лактат-ацидоза |
Димефосфон |
|
Антиоксиданты |
Витамины С, Е |
Наряду с мероприятиями анестезиологической и реанимационной помощи, интенсивной инфузионно-трансфузионной терапии, профилактикой жировой и тромбоэмболии, антибактериальной терапии, иммунокоррекции и др., важнейшее значение имеет проведение хирургических вмешательств. Следует подчеркнуть, что все ургентные операции, которые необходимо выполнять пострадавшим с тяжелой травмой, подразделяют на экстренные и срочные. Разница между этими группами состоит в том, что экстренные оперативные вмешательства выполняются по жизненным показаниям в первые 1-2 часа с момента травмы одновременно с реанимационными мероприятиями и противошоковой терапией. Срочные оперативные вмешательства, в отличие от экстренных, выполняются после достижения лечебного эффекта от проводимых противошоковых мероприятий, в среднем, в пределах 3-6 часов с момента травмы (В.А. Бабоша, В.Г. Климовицкий, Г.В. Лобанов и соавт., 2012).
С точки зрения травматолога особенно важен вопрос об объеме и сроке фиксации переломов крупных сегментов опорно-двигательного аппарата (срок, способ, временная или окончательная схема). В этом плане следует отметить, что характер и объем травматологического пособия определяется тяжестью общего состояния пострадавшего, анатомо-морфологическими структурами повреждения и осуществляется с учетом данных прогноза.
Общеизвестно, что у пострадавших с переломами костей предпочтительной является ранняя стабилизация костных отломков как с точки зрения стабилизации отломков (прекращение патологической подвижности, ограничение болевой импульсации из зоны перелома), так и в отношении ортопедических последствий (обеспечение консолидации перелома в правильном положении отломков).
Однако выполнение оперативных вмешательств у пострадавших с политравмой в полном объеме, исходя из характера перелома (погружной остеосинтез, ЧКО по полной схеме) во многих случаях не представляется возможным ввиду тяжести общего состояния пациента. Поэтому при выборе способа фиксации костных отломков при оказании неотложной помощи пострадавшим с политравмой следует выделить своеобразную «задачу-минимум», т.е. мероприятия, которые позволят предотвратить наступление опасных для жизни осложнений, и мероприятия, которые могут быть отложены до стабилизации состояния пациента.
Учитывая изложенные выше ведущие патогенетические факторы, определяющие течение и исход травматической болезни, к задачам неотложной помощи следует отнести надежную иммобилизацию сегмента, способную ограничить болевую импульсацию из зоны перелома, исключить возможность повреждения фрагментами сосудисто-нервных образований или возникновения вторично-открытого перелома. Точная репозиция и остеосинтез по полной схеме (отвечающий современным требованиям относительно стабильности и функциональности) могут быть выполнены после стабилизации общего состояния пациента. При этом для временной стабилизации следует использовать минимально инвазивные методики, чтобы не усугубить тяжесть состояния пострадавшего.
Опыт показывает, что из существующих вариантов остеосинтеза наиболее полно условиям острого периода травматической болезни отвечает наружный чрескостный остеосинтез (ЧКО). Его преимуществами в условиях политравмы являются следующие.
1. Операция ЧКО не ведет к дополнительной кровопотере.
2. Болевые ощущения при этом незначительны по сравнению с иными вариантами вмешательства.
3. Наложение аппарата связано с минимальной травматизацией тканей.
4. ЧКО может быть разделен на два этапа: 1) временная стабилизационная схема (только стабилизация, репозиция на этом этапе может либо не производиться вообще, либо ограничиться минимальной коррекцией положения фрагментов для исключения повреждения крупных сосудисто-нервных образований или перфорации кожи фрагментами); 2) полная схема с точной репозицией и стабильной фиксацией отломков, что обеспечивает возможность функции суставов и осевой нагрузки вплоть до полной.
Нетрудно заметить, что возможности стабилизационной схемы в полной мере отвечают задачам неотложной помощи при переломах в остром периоде травматической болезни. Этим обусловлено предпочтительное применение ЧКО у пострадавших с политравмой при наличии показаний к остеосинтезу в ургентном порядке как части противошокового комплекса. В дальнейшем возможны два варианта действия: 1) доведение схемы аппарата до полной; 2) замена внешней конструкции на один из вариантов внутреннего остеосинтеза.
Вместе с тем, восстановление в остром периоде травмы анатомической целостности отдельных сегментов опорно-двигательного аппарата – достаточно сложная задача, требующая зачастую решения ее для каждого больного, а в известной мере и для переломов отдельных локализаций, индивидуально.
Остеосинтез переломов костей таза – тяжелое оперативное вмешательство, способное усугубить тяжесть состояния больного. В то же время, откладывание оперативного лечения нестабильных переломов таза на более поздние сроки травматической болезни способствует длительному кровотечению; формированию забрюшинных и предбрюшинных гематом; аутоинтоксикации; возникновению нагноений; вынужденному и длительному положению в постели, затруднявшему уход за больным и поддержание санитарного режима; длительному болевому синдрому. В такой ситуации в случае переломов костей таза мы имеем опыт использования двухэтапного подхода к лечению собственно костных повреждений. Первый этап включает обязательную стабильную фиксацию фрагментов в первые часы после травмы минимальным по травматичности и времени методом. Этим требованиям отвечает метод наружной внеочаговой фиксации отломков. При этом стабилизация отломков способствует и оптимизации условий для гемостаза, снижению посттравматической интоксикации, связанной с распадом гематом. Второй этап оперативного лечения включает окончательную репозицию отломков и их фиксацию в анатомически правильном положении, что осуществляется после стабилизации состояния пострадавшего путем доведения схемы аппарата до полной либо замены ЧКО на внутренний остеосинтез погружными конструкциями.
Следует почеркнуть, что ЧКО перелома костей таза даже по временной схеме, принимая во внимание анатомические особенности, является достаточно специфическим и ответственным вмешательством, которое должно выполняться врачом, имеющим соответствующую подготовку. При отсутствии подготовленного специалиста, остеосинтез, при всех его достоинствах, выполняться не должен, следует ограничиться скелетным вытяжением.
Закрытые переломы костей предплечья, голени и более мелких сегментов опорно-двигательного аппарата в остром периоде травматической болезни могут быть эффективно иммобилизированы глубокими гипсовыми лонгетами. Однако если перелом костей голени сочетается с переломом бедренной кости (или имеются переломы костей предплечья и плечевой кости на одной конечности), такая иммобилизация не обеспечивает должной стабильности, и переломы обоих сегментов следует стабилизировать методом ЧКО.
При открытых переломах у всех пострадавших ЧКО является наиболее обоснованным вариантом стабилизации отломков в остром периоде травматической болезни. Его применение дает возможность не только надежно стабилизировать отломки и предотвратить дальнейшую травматизацию мягких тканей, но и визуально контролировать в динамике состояние конечности, не нарушая стабильности фиксации при выполнении перевязок.
Таким образом, при использовании ЧКО у пострадавших с политравмой при переломах бедра, голени и плечевой кости в остром периоде травматической болезни первый этап вмешательства должен включать обязательную стабильную фиксацию фрагментов в первые часы после травмы стержневым или спице-стержневым аппаратом. Целью вмешательства на данном этапе является стабилизация отломков как составная часть противошокового комплекса. Достижение репозиции желательно, если позволяют условия и состояние пострадавшего, однако на данном этапе не является обязательным требованием.
В разгар синдрома системного воспалительного ответа (ССВО), на 3–7 сутки после травмы, проводить операции на костях мы не рекомендуем, стремясь избежать развития феномена «второго удара». После стабилизации состояния пострадавшего до уровня, позволявшего выполнять вмешательства не по жизненным показаниям, создаются условия для осуществления окончательного остеосинтеза. В этот момент целесообразна локально-аппликационная терапия повреждений. Для этого мы используем комбинацию гелей кетопрофена и гепарина натрия 1000. По мере нарастания внутритканевых кровоизлияний, асептического воспаления, тромбоза мелких сосудов и отека постепенно усиливается, нарушается функция смежных суставов и опорность конечности, обостряется сопутствующая сосудистая патология. В местном лечении повреждений мягких тканей одновременно с иммобилизацией, локальной гипотермией, ограничением нагрузки используют противовоспалительные мази и гели. Среди них важное место занимает гель кетопрофена – нестероидный противовоспалительный препарат, действующим веществом которого является кетапрофен. Благодаря специальной основе препарат быстрее и в большей концентрации проникает через кожу и тем самым обеспечивает больший противовоспалительный и аналгезирующий эффект. Имеются сообщения о местном применении антикоагулянтов при повреждениях мягких тканей для профилактики сосудистых нарушений. Гель Гепарин натрия 1000 нашел применение при лечении тромбофлебита и постфлебитическом синдроме. Входящий в состав геля диэтаноламин обеспечивает активный равномерный транспорт молекул гепарина через кожный барьер. Гель Гепарин натрия 1000 обеспечивает терапевтическую концентрацию гепарина во всех слоях кожи и подкожной клетчатке до 12 часов.
Таким образом, преимущества наружного чрескостного остеосинтеза в минимальной травматичности, возможности разделения остеосинтеза на этапы, возможность применения при открытых переломах и повреждениях мягких тканей травмированного сегмента делают предпочтительным выбор именно ЧКО в условиях, когда надежная малотравматичная стабилизация костных отломков необходима в ургентном порядке.
Накопленный в НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М. Горького многолетний опыт лечения пострадавших с политравмой свидетельствует о том, что малоинвазивная хирургическая стабилизация переломов таза и костей конечностей, проведенная в остром периоде травмы, не только не увеличила летальность, но и способствовала снижению объемов кровопотери. При этом существенно сократился объем ИТТ, необходимый для устранения гиповолемии и восстановления перфузии органов и тканей, на 60% сократился объем гемотрансфузий. В свете концепции травматической болезни важнейшим принципом интенсивной терапии, способствовавшим получению столь благоприятных результатов, являлся ее опережающий характер с применением принципов «хирургической» или «ортопедической реанимации». Это подразумевало уже в остром периоде травмы, наряду с восстановлением жизненно важных функций, проведение мероприятий по профилактике дисфункции иммунной системы, связанной с антигенемией (избыточным поступлением антигенов). В основе этих мероприятий лежали: ранняя хирургическая фиксация переломов длинных костей конечностей и таза; обеспечение гемостаза; снижение посттравматической интоксикации, связанной с распадом гематом; а также ранняя активизация пострадавших. Только комплексный подход при разработке и практической реализации отмеченных принципиальных моментов дает возможность улучшить результаты лечения данной категории пострадавших.







