Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Тромбоэмболия легочной артерии: подходы к диагностике и лечению в 2016 г."
Автор: Багрий А.Э., Приколота О.А., Хоменко М.В.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Кардиология, Ревматология, Семейная медицина/Терапия
Просмотров: 6 362
Дата проведения:
 В этом семинаре нами рассматриваются вопросы диагностики и лечения больных, имеющих тесно взаимосвязанные между собой состояния – тромбоз глубоких вен (ТГВ) нижних конечностей и тромбоэмболию легочной артерии (ТЭЛА). В настоящее время зарубежные авторы обычно объединяют эти состояния общим термином «венозные тромбоэмболии» («venous thromboembolism»); их примеру нередко следуют и специалисты стран СНГ. Подобный подход кажется вполне оправданным, с учетом единых факторов риска и механизмов развития, а также во многом сходных стратегических подходов к лечению.
В этом семинаре нами рассматриваются вопросы диагностики и лечения больных, имеющих тесно взаимосвязанные между собой состояния – тромбоз глубоких вен (ТГВ) нижних конечностей и тромбоэмболию легочной артерии (ТЭЛА). В настоящее время зарубежные авторы обычно объединяют эти состояния общим термином «венозные тромбоэмболии» («venous thromboembolism»); их примеру нередко следуют и специалисты стран СНГ. Подобный подход кажется вполне оправданным, с учетом единых факторов риска и механизмов развития, а также во многом сходных стратегических подходов к лечению.
Тем не менее, в предлагаемой работе авторы сочли целесообразным изложить информацию об этих состояниях раздельно (более кратко – для ТГВ, и подробнее – для ТЭЛА), обоснованно полагая, что это облегчит восприятие материала для читателя (хотя при этом и не избежать ряда повторений).
При рассмотрении этих вопросов широко использованы два наиболее подробных действующих сейчас международных регламентирующих документа: 1) Рекомендации European Society of Cardiology, 2014, по диагностике и лечению легочных эмболий (далее – ESC, 2014) и 2) Рекомендации American College of Chest Physicians, 9-го пересмотра, 2012, по антитромботической терапии при венозных тромбоэмболиях (далее – АССР, 2012).
Материал представлен в виде четырех разделов: Раздел I. Общие вопросы ТГВ / ТЭЛА; клиническая картина, диагностика и выбор лечебной стратегии при ТЭЛА; Раздел II. ТГВ – диагностика и лечение; Раздел III. Лечение ТЭЛА; Раздел IV. Характеристика прямого ингибитора тромбина дабигатрана и возможности его использования при ТГВ / ТЭЛА.
Раздел I. Общие вопросы ТГВ / ТЭЛА.
клиническая картина, диагностика и выбор лечебной стратегии при ТЭЛА
Эпидемиология ТГВ / ТЭЛА
- ТГВ / ТЭЛА представляют достаточно частую проблему, однако в целом ряде случаев имеются значительные сложности с их диагностикой. Многим поколениям врачей ТЭЛА известна как «великий притворщик» («great masquerader»); врачу необходимо постоянно быть настороже и учитывать ТЭЛА в структуре дифференциального диагноза у лиц с самыми разными вариантами клинической картины.
- Распространенность ТГВ / ТЭЛА составляет ≈ 1,5 случая на 1000 человек в год; при этом количество случаев ТГВ примерно в 2 раза превосходит число случаев ТЭЛА.
- Развитие ТГВ / ТЭЛА возможно в любых возрастных группах, однако распространенность увеличивается с возрастом. Полагают, что более 50% всех эпизодов ТЭЛА возникает у лиц в возрасте ≥ 65 лет.
- ТЭЛА является одной из трех наиболее распространенных сердечно-сосудистых причин смерти в мире (наряду с инфарктом миокарда и мозговым инсультом). Смертность при ТЭЛА в целом достигает 15%, превосходя таковую при инфаркте миокарда.
- Согласно эпидемиологическим данным, общая смертность при ТЭЛА в течение 30 дней в западных странах составляет 9-11%, в течение 3 месяцев – может достигать 17%.
- Современная антикоагулянтная профилактика и терапия способны существенно улучшить прогноз при ТГВ / ТЭЛА.
- Серьезной проблемой после ТГВ / ТЭЛА является высокая частота рецидивов, в т.ч. после завершения стандартного по продолжительности курса антикоагулянтной терапии (особенно если их развитие не было связано с транзиторными факторами риска, например, травмой или оперативным вмешательством).
- Лица, выжившие после ТЭЛА, нередко имеют сниженное качество жизни, что обусловлено развитием хронической тромбоэмболической легочной гипертензии и/или хронической венозной недостаточности нижних конечностей (также обозначаемой как посттромбофлебитический синдром).
 Факторы риска и патогенез ТГВ / ТЭЛА
Факторы риска и патогенез ТГВ / ТЭЛА
Факторы риска
- Примерно в 50% случаев ТГВ / ТЭЛА являются идиопатическими (т.е. возникают без связи с какими-либо явными провоцирующими факторами / факторами риска). У остальных выявляются различные модифицируемые и не-модифицируемые факторы риска (нередко представлены их комбинации).
- Ведущие модифицируемые факторы риска ТГВ / ТЭЛА включают ожирение (повышает риск в 2,3 раза), артериальную гипертензию (повышает риск на 50%), сахарный диабет (на 40%), курение (на 20%), гиперлипидемию (на 20%), а также употребление «нездоровой пищи» (с низким содержанием свежих фруктов и овощей) и персистирующий эмоциональный стресс. Как видно, это – те же факторы, которые повышают риск развития иных сердечно-сосудистых поражений, включая инфаркты миокарда и инсульты. Таким образом, давая больному совет по изменению образа жизни с коррекцией перечисленных выше факторов, врач может надеяться на одновременное снижение риска ишемической болезни сердца, и инсультов, и ТГВ / ТЭЛА.
- Значительная часть среди факторов риска ТГВ / ТЭЛА относится к не-модифицируемым.
- Более подробно факторы риска ТГВ / ТЭЛА представлены в таблице 1. Эти факторы могут быть постоянными и транзиторными. Связь ТГВ / ТЭЛА с транзиторными факторами риска (такими как хирургическое вмешательство, травма, иммобилизация, прием контрацептивов или эстроген-замещающей терапии) эксперты рекомендуют рассматривать как установленную, если действие этих факторов приходилось на период времени в пределах 6 недель – 3 месяцев до возникновения симптоматики ТГВ / ТЭЛА.
- Риск ТГВ у пациентов, подвергавшихся ортопедическим хирургическим вмешательствам, обычно выше, чем после неортопедических операций.
- Вероятность возникновения ТГВ / ТЭЛА наиболее высока в течение первых 2 недель после вмешательства; риск также считается повышенным еще в течение 2-3 месяцев после операции.
- Антитромботическая профилактика значительно уменьшает риск периоперационных ТГВ / ТЭЛА.
- Частота ТГВ / ТЭЛА снижается с увеличением продолжительности тромбопрофилактики после крупных ортопедических вмешательств, а также (но в меньшей степени) онкологических операций. Такая ассоциация не продемонстрирована для общехирургических вмешательств.
- У большинства больных с клиническими проявлениями ТГВ имеются проксимально расположенные тромбы, которые могут осложняться ТЭЛА (нередко – бессимптомной) в 40-50% случаев.
- Развитию ТГВ / ТЭЛА могут способствовать острые инфекции мочевого и респираторного тракта.
- У больных с онкологическими заболеваниями риск развития ТГВ / ТЭЛА примерно в 2 раза выше, чем у лиц без таких заболеваний. Риск этот возрастает по мере увеличения срока жизни онкологических больных. Риск ТЭЛА повышен не только у пациентов с опухолями поджелудочной железы, желудка, легких, пищевода, предстательной железы, кишечника, но и у лиц с миело- и лимфопролиферативными опухолями.
- У лиц с «неспровоцированными» ТГВ / ТЭЛА повышен риск выявления онкологических заболеваний de novo (он составляет около 1-2% в год).
- В последнее время в западных странах отмечается увеличение частоты развития ТГВ верхних конечностей (вследствие более частой имплантации искусственных водителей ритма, кардиовертеров-дефибрилляторов, катетеров для химиотерапии и парентерального питания). Этот вариант ТГВ также может быть ассоциирован с развитием ТЭЛА (хотя и существенно реже, чем ТГВ нижних конечностей); кроме того, он может сочетаться с развитием синдрома верхней полой вены.
 Таблица 1. Факторы риска ТГВ / ТЭЛА (адаптировано из ESC, 2014)
Таблица 1. Факторы риска ТГВ / ТЭЛА (адаптировано из ESC, 2014)
|
Факторы, ассоциированные со значительным повышением риска ТЭЛА: · Перелом нижней конечности. · Госпитализация по поводу сердечной недостаточности или фибрилляции / трепетания предсердий в течение последних 3 месяцев. · Протезирование тазобедренного или коленного сустава. · Перенесенные обширные травмы. · Перенесенный в течение последних 3 месяцев инфаркт миокарда. · Перенесенные ранее эпизоды ТЭЛА. · Повреждения позвоночника. |
|
Факторы, ассоциированные с умеренным повышением риска ТЭЛА: · Артроскопическое вмешательство на коленном суставе. · Системные заболевания соединительной ткани. · Трансфузии крови. · Установленный центральный венозный катетер. · Химиотерапия в анамнезе. · Хроническая сердечная недостаточность, дыхательная недостаточность · Применение эритропоэз-стимулирующих препаратов. · Использование эстроген-замещающей терапии (зависит от препарата) или оральных контрацептивов. · Процедура искусственного оплодотворения (особенно в 1 триместре беременности). · Инфекции (особенно – пневмонии, инфекции мочевого тракта, ВИЧ). · Неспецифический язвенный колит, болезнь Крона. · Онкологические заболевания (особенно с метастазированием; наиболее высокий риск имеется при гематологических опухолях, раке легкого, желудочно-кишечного тракта, поджелудочной железы и головного мозга). · Перенесенный инсульт с параличами. · Тромбоз поверхностных вен. · Повышенная склонность к тромбообразованию (тромбофилии). |
|
Факторы, ассоциированные с небольшим повышением риска ТЭЛА: · Постельный режим длительностью более 3 дней. · Сахарный диабет. · Артериальная гипертензия. · Иммобилизация в положении сидя (например, при длительной поездке в автомобиле или длительном авиаперелете). · Возраст. · Перенесенные лапароскопические операции (например, холецистэктомия). · Ожирение. · Беременность (особенно в 3 триместре и в течение 6-12 недель после родов). · Варикозная болезнь нижних конечностей. |
Патогенез ТГВ / ТЭЛА
- Напомним читателю о так называемой «триаде Вирхова», предрасполагающей к внутрисосудистой коагуляции; она включает: 1) локальную травматизацию сосудистой стенки; 2) гиперкоагуляцию; 3) стаз крови.
- В развитии ТГВ / ТЭЛА важную роль отводят комбинации действия перечисленных выше факторов риска, возможно также в сочетании с врожденной или приобретенной предрасположенностью к гиперкоагуляции (иногда используется термин «тромбофилия»).
- Гиперкоагуляция. Среди врожденных тромбофилий с ТЭЛА наиболее часто ассоциированы мутации генов фактора V Leiden и протромбина, реже – состояния с врожденным дефицитом антитромбина, а также протеинов С и S. Клиническая значимость тестирования этих факторов коагуляции у лиц с ТЭЛА пока не доказана. Среди приобретенных тромбофилий наиболее частой является антифосфолипидный синдром (характеризуется венозными и/или артериальными тромбозами, повторными прерываниями беременности, выявлением в крови антифосфолипидных аутоантител).
- Связь ТГВ нижних конечностей и ТЭЛА. Уже упоминалось об очень тесной связи между ТГВ нижних конечностей и ТЭЛА. Тромб, сформировавшийся локально в системе глубоких вен ног, может отделяться от места своего образования и переноситься током крови сначала в нижнюю полую вену, затем в правое предсердие, правый желудочек и, наконец, обтурировать структуры пульмонального артериального русла. Тромб очень большого размера может вызывать эмболизацию в области общего ствола или бифуркации легочной артерии; однако чаще развивается эмболия менее крупных ее ветвей. Отсутствие ультразвуковых данных о ТГВ у значительной части пациентов с ТЭЛА может быть связано с тем, что сам тромб в месте своего первоначального нахождения уже отсутствует, а локальные изменения стенки вены просто не удается визуализировать.
- Дисфункция правого желудочка (рис. 1). Наиболее важными факторами, определяющими развитие дисфункции правого желудочка у лиц с ТЭЛА, являются степень выраженности обструкции пульмонального сосудистого русла, а также наличие предсуществующих сердечно-сосудистых и респираторных заболеваний. С увеличением тяжести обструкции в системе легочной артерии давление в ней возрастает; его дальнейшему росту могут также способствовать секреция вазоактивных медиаторов, таких как серотонин, рефлекторная пульмональная вазоконстрикция и гипоксемия. Все это способствует развитию острой (а в последующем, возможно, и хронической) перегрузки правого желудочка давлением, увеличению напряжения его стенок и нарушению сократимости.
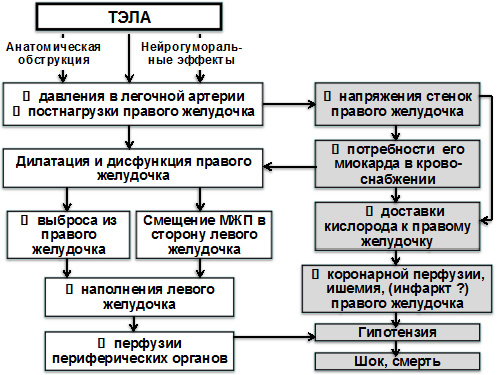
Рисунок 1. Патофизиологические изменения правого и левого желудочков при ТЭЛА. é – увеличение; ê – снижение; МЖП – межжелудочковая перегородка)
- Межжелудочковое взаимодействие, коронарная перфузия. При ТЭЛА вследствие острой дилатации правого желудочка происходит смещение межжелудочковой перегородки в сторону левого желудочка, что может способствовать нарушению его диастолического наполнения. В свою очередь, это способствует снижению сердечного выброса и уровня артериального давления, а также уменьшению коронарной перфузии и развитию ишемии миокарда. Повышенное напряжение правого желудочка при массивной ТЭЛА, с одной стороны, существенно уменьшает кровоток в бассейне правой коронарной артерии, а с другой стороны, увеличивает потребность миокарда правого желудочка в кровоснабжении. Сочетание этих механизмов создает предпосылки для развития ишемии в этой зоне миокарда. Персистенция такого состояния потенциально угрожает развитием циркуляторного коллапса и летального исхода.
- Некоторые иные патофизиологические эффекты ТЭЛА:
- повышение сосудистого сопротивления в системе легочной артерии из-за сосудистой обструкции, гиперпродукции нейрогуморальных факторов и активации сосудистых барорецепторов;
- нарушение газообмена вследствие увеличения альвеолярного «мертвого пространства» из-за сосудистой обструкции;
- гипоксемия, связанная с альвеолярной гиповентиляцией;
- вентиляционно-перфузионные нарушения;
- дефекты транспорта СО из-за уменьшения площади поверхности газообмена;
- бронхоконстрикция;
- отек легких, легочные геморрагии, нарушение образования сурфактанта.
Клиническая картина ТЭЛА
Клиническая картина ТЭЛА неспецифична. Как уже отмечалось, необходима постоянная настороженность врача в отношении ТЭЛА у больных с самыми разными клиническими проявлениями (в особенности, у лиц с перечислявшимися выше факторами риска ТГВ / ТЭЛА, но также и при их отсутствии).
В таблице 2 представлены наиболее частые клинические проявления ТЭЛА.
Таблица 2. Наиболее частые клинические проявления при ТЭЛА (адаптировано из Braunwald’s Heart Disease, 2012)
|
Жалобы: · Одышка, которую нельзя объяснить иными причинами. · Боль в грудной клетке (может быть «плевральной» или «атипичной»). · Тревога. · Кашель. |
|
Объективные данные: · Тахипноэ. · Тахикардия. · Субфебрилитет. · Мелодия трикуспидальной регургитации. · Акцент II тона над легочной артерией. · Кровохарканье. · Отечность, уплотнение, эритема, болезненность при пальпации в области голени / бедра (при ТГВ). |
- Проявлениями ТЭЛА, которые наиболее часто ассоциированы с неблагоприятным прогнозом, считают тяжелую одышку, синкопы и цианоз (часто без боли в грудной клетке). Парадоксально, тяжелая «плевральная» боль часто свидетельствует о локализации эмбола в дистальном отделе ветвей легочной артерии и об относительно небольшом объеме эмболизации.
- Среди лиц с гипотензией наличие ТЭЛА следует в первую очередь предполагать у следующих категорий пациентов: 1) у имеющих клинические проявления ТГВ или факторы риска ТГВ / ТЭЛА (табл. 1); 2) с признаками острой правожелудочковой недостаточности (набуханием / пульсацией яремных вен, протодиастолическим ритмом галопа, гепатомегалией, тахикардией, тахипноэ), особенно если также имеются 3) эхокардиографические данные о дилатации и гипокинеза правого желудочка или электрокардиографические признаки острого легочного сердца (внезапно возникший феномен SIQIIITIII, инверсия зубцов Т с V1 по V4, вновь возникшая блокада правой ножки пучка Гиса, отклонение электрической оси сердца вправо, ишемия правого желудочка).
- Существенную помощь в установлении диагноза может оказать выделение групп больных, имеющих (с учетом клинических данных) высокую или невысокую вероятность развития ТЭЛА. Для этого могут быть использованы различные варианты достаточно простых международно-признанных шкал (показаны в таблице 3). Их ценность для диагностики ТЭЛА подтверждена в серьезных исследованиях.
Таблица 3. Классические и упрощенные критерии Wells для оценки клинической вероятности ТЭЛА
|
Признаки |
Классическая шкала Wells |
Упрощенная шкала Wells |
|
Клинические проявления ТГВ |
3 |
1 |
|
Альтернативный диагноз менее вероятен, чем ТЭЛА |
3 |
1 |
|
ЧСС > 100 в мин |
1,5 |
1 |
|
Иммобилизация или хирургическое вмешательство на протяжении последних 4 недель |
1,5 |
1 |
|
ТГВ или ТЭЛА в анамнезе |
1,5 |
1 |
|
Гемофтизис (отхождение мокроты с кровью) |
1 |
1 |
|
Онкологические заболевания, требовавшие лечения в течение последних 6 месяцев, либо метастатические |
1 |
1 |
|
Для классической шкалы: высокая вероятность ТЭЛА – если > 4 баллов, невысокая – если ≤ 4 баллов |
||
|
Для упрощенной шкалы: высокая вероятность ТЭЛА – если > 1 балла, невысокая – если 1 или 0 баллов |
||
Клинические синдромы при ТЭЛА
- В спектре клинических вариантов массивная ТЭЛА представлена относительно нечасто; субмассивная – чаще; наиболее частой является небольшая / умеренная ТЭЛА.
- Массивная ТЭЛА клинически может характеризоваться развитием кардиогенного шока и полиорганной недостаточности (часто имеются снижение функции почек и печени, нарушения сознания). Имеется распространенная эмболизация с вовлечением не менее половины пульмонального сосудистого русла. Типично наличие тромбов с обеих сторон. Наиболее выраженным симптомом является одышка, часто представлен цианоз. Обычна гипотензия, требующая введения вазопрессоров. Боли в грудной клетке обычно не выражены. Прогноз весьма серьезный. Лечебная тактика обычно включает реперфузию (тромболизис, эмболэктомию, установку инфракавальных фильтров) в сочетании с антикоагуляцией.
- Субмассивная ТЭЛА (умеренная / большая): часто имеются умеренный / выраженный гипокинез правого желудочка, повышение уровней кардиальных биомаркеров, однако гипотензия / шок отсутствуют. При этом варианте имеется эмболизация ≥ 1/3 пульмонального сосудистого русла. При отсутствии сопутствующих сердечно-сосудистых и респираторных заболеваний на начальном этапе эти пациенты могут иметь неплохое самочувствие, однако оно часто обманчиво (в последующем могут требоваться и введение вазопрессоров, и респираторная поддержка). В основе лечебной тактики – антикоагулянтные препараты; реперфузионные подходы резервируют для лиц, у которых наблюдается персистирование умеренных / тяжелых нарушений функции правого желудочка. Больные, перенесшие субмассивную ТЭЛА, имеют высокий риск повторения ТЭЛА даже несмотря на проведение адекватной антикоагуляции.
- Небольшая / умеренная ТЭЛА: имеются нормальные уровни артериального давления, нет повышения концентраций кардиальных биомаркеров и нарушения функции правого желудочка. Клинически пациенты достаточно стабильны. При адекватном применении антикоагулянтов прогноз благоприятный.
- Инфаркт легкого. Развитие этого синдрома обусловлено эмболизацией периферического отдела пульмональной артериальной системы тромбом небольшого размера. В клинической картине доминирует «плевральная» боль в грудной клетке (постоянного или интермиттирующего характера), возможно в сочетании с кровохарканьем. Часто также присутствуют лихорадка, лейкоцитоз, ускорение СОЭ, рентгенологические данные, свидетельствующие об инфаркте легкого. Клиническая картина инфаркта легкого обычно развивается на 3-7 день после эпизода ТЭЛА.
- Парадоксальная эмболия является следствием эмболизации артериальных сосудов большого круга кровообращения (обычно кровоснабжающих головной мозг) тромбом, происходящим из глубоких вен нижних конечностей, вследствие его прохождения через незакрытое овальное окно (foramen ovale). Клиническая картина представлена инфарктом головного мозга. ТГВ нижних конечностей у лиц с парадоксальной эмболией диагностируется редко вследствие того, что размер тромба при этом небольшой, и после его отрыва от места образования резидуальных признаков тромбоза, которые могли бы быть обнаружены при ультрасонографии вен нижних конечностей, чаще всего не остается. С учетом этого, у больных с «криптогенными» инфарктами мозга обычно считают необходимым проведение тщательного обследования для выявления незаращения овального окна (контрастная эхокардиография). Лечебная тактика в подобных случаях может требовать выбора между постоянной (неопределенно долгой) антикоагулянтной терапией и оперативным вмешательством с закрытием овального окна (в настоящее время обычно с использованием катетерных методов).
Дифференциальная диагностика ТЭЛА
В таблице 4 представлен перечень заболеваний, с которыми наиболее часто следует проводить дифференциальную диагностику ТЭЛА. Не следует забывать, что ТЭЛА может сочетаться с другими заболеваниями. Так, при отсутствии адекватного ответа на лечение пневмонии или декомпенсации сердечной недостаточности необходимо иметь в виду возможность их комбинации с ТЭЛА.
Таблица 4. Дифференциальная диагностика ТЭЛА (адаптировано из Braunwald’s Heart Disease, 2012)
|
· Пневмония · Перикардит · Плеврит · Инфаркт миокарда · Межреберная невралгия, перихондрит |
· Обострение хронического обструктивного заболевания легких · Повышенная тревожность, паническая атака · Декомпенсация сердечной недостаточности · Идиопатическая легочная гипертензия |
Диагностические методы при ТЭЛА
Оценка уровней D-димера
- Этот скрининговый тест основан на принципе выявления признаков эндогенного фибринолиза, степень выраженности которого не позволяет предотвратить развитие тромбоза / эмболизации, но достаточна для расщепления части содержащегося в тромбе фибрина на D-димеры.
- Повышение содержания D-димера в плазме является чувствительным, но малоспецифичным тестом при ТЭЛА. Значения этого показателя обычно повышены в течение не менее чем недели после оперативного вмешательства, а также у больных с острым инфарктом миокарда, сепсисом, онкологическими заболеваниями, при ряде других хронических заболеваний, а также у беременных. Ввиду этого, скрининговое исследование уровня D-димера обычно подходит для тех лиц с предполагаемой ТЭЛА, которые не имеют серьезных заболеваний в стадии обострения / декомпенсации (т.к. у них они и без ТЭЛА будут повышены).
- Отрицательные результаты исследования содержания D-димера имеют достаточно высокую информативность для пациентов с невысокой клинической вероятностью ТЭЛА.
- Этот метод находит применение, главным образом, у лиц с невысокой клинической вероятностью ТЭЛА; при его отрицательном результате обычно не считают необходимым проводить дополнительные исследования и диагноз ТЭЛА исключают. При положительном результате требуется подтверждение диагноза с помощью томографических методов. У лиц с высокой клинической вероятностью ТЭЛА (табл. 3) исследование уровней D-димера не считают информативным, поскольку его отрицательный результат не позволяет исключить наличие ТЭЛА.
- Исследование D-димера неинформативно для исключения диагноза ТЭЛА у беременных.
Пульсовая оксиметрия
- Пульсовая оксиметрия не относится к методам диагностики ТЭЛА.
- Используется в качестве вспомогательного инструментального метода, применяемого с целью оценки сатурации кислорода.
- Предположение о ТЭЛА может возникнуть при внезапном необъяснимом уменьшении этого показателя.
Электрокардиография
- Является малоспецифичным методом диагностики ТЭЛА, позволяет установить наличие признаков перегрузки правых отделов сердца.
- У значительной части лиц с ТЭЛА (даже массивной) изменения на электрокардиограмме могут отсутствовать.
- Является важным инструментом дифференциальной диагностики для исключения альтернативных диагнозов (инфаркт миокарда, перикардит).
- Электрокардиографически при ТЭЛА могут быть представлены:
- синусовая тахикардия;
- неполная или полная блокада правой ножки пучка Гиса;
- отклонение электрической оси сердца вправо;
- инверсия зубца Т в отведениях III и avF, либо в V1-V4;
- феномен SIQIIITIII (зубец S в отведении I, зубец Q и инверсия зубца Т в отведении III);
- фибрилляция / трепетание предсердий.
Компьютерная томография (КТ) органов грудной клетки +
КТ-пульмональная ангиография
- Это – стандартно рекомендуемый начальный метод диагностики у большинства больных с подозрением на ТЭЛА (рис. 2).
- Даже компьютерные томографы ранних моделей позволяют получать достаточно четкие и качественные изображения проксимальных отделов пульмонального сосудистого русла, что дает возможность адекватной визуализации массивных тромботических масс и определяться с выбором хирургической или катетерной интервенционной тактики. Более современные мультидетекторные КТ-сканеры обеспечивают визуализацию пульмонального сосудистого русла всех отделов грудной клетки с разрешением менее одного миллиметра. Что же касается последних поколений КТ-сканеров, то они могут выявлять тромбы в пульмональных сосудах шестого порядка (такие тромбы настолько малы, что их клиническая значимость подвергается сомнению).
- У лиц с ТЭЛА данные КТ, наряду с важной диагностической, несут также ценную прогностическую информацию. Так, увеличение размера правого желудочка является критерием повышенного риска развития осложнений.
- КТ-пульмональная ангиография также позволяет выявлять и иные поражения органов грудной клетки, которые могут сочетаться с ТЭЛА, или характеризоваться клинической картиной, напоминающей ТЭЛА (пневмония, ателектаз, пневмоторакс, плевральный выпот, карцинома).
- В таблице 5 перечислены особенности, на которые рекомендуется обращать особое внимание при анализе результатов КТ-пульмональной ангиографии у лиц с подозрением на ТЭЛА.
Таблица 5. Что требует специального внимания при оценке данных КТ-пульмональной ангиографии у больного с подозрением на ТЭЛА
|
· Технические особенности: тип КТ-сканера, разрешение, адекватность вводимого болюса контрастного вещества, использование специфичного для диагностики ТЭЛА протокола выполнения КТ-пульмональной ангиографии, возможность визуализации вен таза и нижних конечностей. · Размер, локализация и протяженность тромба · Иные нарушения, которые могут сочетаться с ТЭЛА или должны быть учтены при дифференциальной диагностике с ТЭЛА (пневмония, ателектаз, перикардиальный выпот, пневмоторакс, увеличение левого желудочка). · Расширение легочной артерии, возможно связанное с легочной гипертензией. · Давность выявленного тромба (острый, подострый, хронический). · Более подробно – локализация тромба (ветви легочной артерии, если есть данные, то вены таза, нижних и верхних конечностей). · Увеличение правого желудочка. · Контур межжелудочковой перегородки (его выпячивание в сторону левого желудочка свидетельствует о перегрузке давлением правого желудочка). · Случайно выявляемые образования и лимфоузлы в легких. |
Эхокардиография
- С учетом того что примерно у половины больных с ТЭЛА при эхокардиографическом исследовании не выявляется отклонений от нормы, этот метод не рассматривается в качестве рутинного диагностического теста, подтверждающего наличие ТЭЛА.
- Однако он представляет собой быстрый, удобный и чувствительный метод выявления перегрузки правого желудочка, в особенности у больных с достаточно большим объемом эмболизации.
- Этот метод ценен в дифференциальной диагностике ТЭЛА с инфарктом миокарда и перикардитом.
- В части случаев, при недостаточно высоком качестве изображений, получаемых при трансторакальном расположении ультразвукового датчика, может быть использована чреспищеводная эхокардиография.
- Эхокардиографические изменения, которые могут выявляться при ТЭЛА:
- дилатация и гипокинез правого желудочка (особенно гипокинез его свободной стенки при сохранной подвижности верхушки);
- парадоксальное движение межжелудочковой перегородки в сторону левого желудочка, что приводит к изменению его формы в поперечном сечении на D-образную;
- трикуспидальная регургитация;
- легочная гипертензия;
- дилатация нижней полой вены без ее респираторного коллапса (на вдохе);
- непосредственная визуализация тромба (более вероятна при чреспищеводном исследовании).
Ультрасонография вен
- Является, в первую очередь, методом диагностики ТГВ. У лиц с подозрением на ТЭЛА выявление ТГВ – важный аргумент в пользу наличия ТЭЛА.
- Однако примерно половина лиц с установленным диагнозом ТЭЛА не имеют ультрасонографических признаков ТГВ. В этой связи ультрасонография вен обычно не считается показанной лицам, имеющим умеренную или высокую вероятность наличия ТЭЛА.
- Основным диагностическим критерием ТГВ является потеря способности вены к компрессии ниже области ее пережатия.
Менее часто применяемые методы:
- Сканирование легких. Пульмональная радионуклидная вентиляционно-перфузионная сцинтиграфия позволяет при ТЭЛА выявлять дефекты перфузии в микрососудистом русле легочной артерии. Однако применение этого метода в диагностике ТЭЛА, по мнению экспертов, сейчас ограничивает достаточно высокая частота ложно-отрицательных результатов у лиц с высокой клинической вероятностью наличия ТЭЛА (у которых диагноз затем подтверждается при пульмональной ангиографии).
- Магнитно-резонансная пульмональная ангиография с гадолинием в диагностике ТЭЛА считается заметно менее чувствительным методом по сравнению с компьютерной томографией. В части случаев она может быть использована для оценки размеров и функции правого желудочка. Достоинством метода является то, что он не требует использования ионизирующей радиации и введения рентген-контрастных препаратов.
- Инвазивная (катетерная) пульмональная ангиография. Ранее этот метод рассматривался как «золотой стандарт» диагностики ТЭЛА, но сейчас (ввиду инвазивного характера, связанного с этим повышением риска кровотечений и необходимости введения рентген-контрастных средств) используется существенно реже. Обычно его резервируют для случаев, когда предполагается выполнение интервенционных вмешательств, включая катетерную эмболэктомию, фрагментацию тромба и др. Также может применяться в диагностических целях у части больных с хронической тромбоэмболической легочной гипертензией.
- Контрастная флебография ранее являлась стандартным методом диагностики ТГВ; сейчас из-за инвазивного характера метода и необходимости применения рентген-контрастных средств используется реже. Эксперты также констатируют достаточно существенные сложности в воспроизводимости интерпретации получаемых данных. Применяется преимущественно в случаях, когда предполагается выполнение соответствующих интервенционных вмешательств (эмболэктомии, ангиопластики, стентирования, установки инфракавального фильтра).
Подходы к диагностике ТЭЛА
и выбору лечебной стратегии
Общие принципы диагностики
- Как указывалось выше, для диагностики ТЭЛА наиболее часто применяются КТ-пульмональная ангиография, эхокардиография, электрокардиография, рентгеновское исследование органов грудной клетки и оценка уровней D-димера; также могут быть использованы и другие методы.
- На рисунке 2 представлен предлагаемый международными экспертами примерный алгоритм диагностики ТЭЛА.
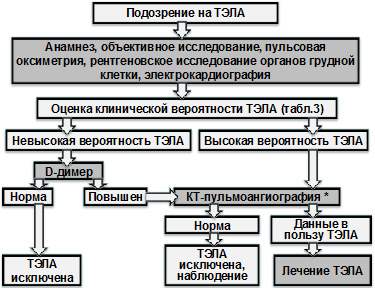
Рисунок 2. Диагностический подход при подозрении на ТЭЛА (адаптировано из Braunwald’s Heart Disease, 2012; ESC, 2014)
Примечание: * – эксперты ESC, 2014 указывают, что при невозможности выполнения КТ-ангиографии (в т.ч. из-за критически тяжелого состояния больного), то при высокой вероятности ТЭЛА для подтверждения ее наличия может быть выполнено эхокардиографическое исследование
- Первым шагом является оценка жалоб, целенаправленный сбор анамнеза, а также объективное исследование, в сочетании с несколькими достаточно доступными рутинными инструментальными методами (электрокардиография, пульсовая оксиметрия и рентгеновское исследование органов грудной клетки), которые желательно выполнить быстро. С учетом этих данных принципиально важно разделить больных на две группы: 1) с невысокой вероятностью наличия ТЭЛА и 2) с высокой вероятностью ее наличия (при этом рекомендуют учитывать критерии Wells из таблицы 3).
- В случае если больной отнесен в группу с невысокой вероятностью наличия ТЭЛА, то у него рекомендуют оценить уровень D-димера в плазме крови. Если он не повышен, то диагноз ТЭЛА маловероятен. При повышенной концентрации D-димера необходимо выполнение КТ-пульмональной ангиографии, которая обычно с высокой точностью позволяет подтвердить или опровергнуть ТЭЛА. В отсутствие изменений при КТ-пульмональной ангиографии не считается необходимым рутинное проведение ультрасонографии вен нижних конечностей для исключения ТЭЛА.
- Для лиц из группы с высокой вероятностью наличия ТЭЛА (а также для лиц с наличием гипотензии / шока) исследование уровней D-димера не проводится, им сразу же рекомендуют выполнять КТ-пульмональную ангиографию. В тех случаях, когда ее проведение невозможно (в т.ч. из-за тяжести состояния), специалисты ESC, 2014 считают целесообразным проведение эхокардиографического исследования. В редких случаях, когда данные КТ-пульмональной ангиографии в отношении ТЭЛА оказываются сомнительными, помощь в диагностике могут оказать ультрасонография вен нижних конечностей и катетерная пульмональная ангиография.
- Полагают, что сканирование легких может быть альтернативой КТ-пульмональной ангиографии лишь в двух случаях: 1) при значимом снижении функции почек; 2) при гиперчувствительности к внутривенно вводимым контрастным веществам, которая не может контролироваться высокими дозами глюкокортикоидов.
Оценка степени прогностического риска (стратификация риска)
- Спектр тяжести клинических проявлений ТЭЛА весьма широк. Быстрая и тщательная оценка особенностей пациента с определением уровня риска играет важнейшую роль для выбора лечебной стратегии.
- Для стратификации риска ключевыми считают учет трех основных компонентов: 1) клинических данных (в особенности – уровней артериального давления, проявлений шока, признаков перегрузки правого желудочка – набухания шейных вен, трикуспидальной регургитации, протодиастолического ритма галопа); 2) размера и функции правого желудочка; 3) уровней кардиальных биомаркеров – тропонина и мозгового натрийуретического пептида (либо самого BNP, либо аминотерминального фрагмента его предшественника – NT pro-BNP).
- В таблице 6 представлены подходы к оценке степени прогностического риска при ТЭЛА, а в таблице 7 – критерии неблагоприятного прогноза при ТЭЛА.
Таблица 6. Оценка степени прогностического риска при ТЭЛА (индекс тяжести ТЭЛА – Pulmonary Embolism Severity Index – PESI)
|
Параметры |
Баллы |
|
Возраст, годы |
Баллы = годы |
|
Мужской пол |
10 |
|
Онкологические заболевания в анамнезе |
30 |
|
Сердечная недостаточность в анамнезе |
10 |
|
Хронические обструктивные заболевания легких в анамнезе |
10 |
|
Пульс ≥ 110 ударов в минуту |
20 |
|
Систолическое артериальное давление < 100 мм рт.ст. |
30 |
|
Частота дыханий ≥ 30 в минуту |
20 |
|
Температура тела < 36оС |
20 |
|
Нарушения сознания |
60 |
|
Сатурация кислорода < 90% |
20 |
|
Низкий прогностический риск – если ≤ 85 баллов |
|
Таблица 7. Критерии неблагоприятного прогноза при ТЭЛА
|
· Гемодинамическая нестабильность (гипотензия / шок) · Гипокинез правого желудочка при эхокардиографическом исследовании · Дилатация правого желудочка при эхокардиографическом исследовании или КТ-исследовании · Перегрузка правого желудочка при электрокардиографическом исследовании · Повышение уровней кардиальных биомаркеров (тропонина*, мозгового натрийуретического пептида**) |
Примечания: * – повышение тропонина может свидетельствовать о развитии микроинфарктов правого желудочка; ** – повышение уровней может отражать выраженную перегрузку давлением правого желудочка.
Выбор лечебной стратегии
- На основании оценки указанных в таблицах 6 и 7 данных среди лиц с уже установленным диагнозом ТЭЛА выделяют (рис. 3) группу больных с низким прогностическим риском (у них основу лечебной тактики составляет антикоагулянтная терапия) и группу, имеющую высокий риск, т.е. с уровнем баллов PESI > 85 (табл. 6), а также с наличием гипотензии / шока (этим пациентам показано проведение реперфузии с использованием тромболизиса или интервенционных катетерных манипуляций, в сочетании с применением антикоагулянтных препаратов).
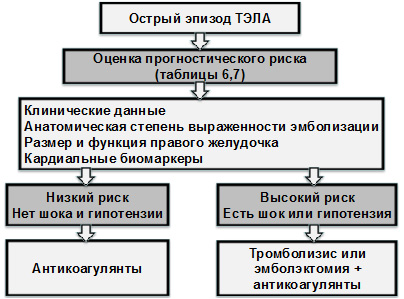
Рисунок 3. Выбор лечебной стратегии с учетом степени прогностического риска и наличия шока / гипотензии (адаптировано из Braunwald’s Heart Disease, 2012; ESC, 2014)
Раздел II.
диагностика и лечение тгв
Общий взгляд на диагностику и лечение ТГВ
- ТГВ нижних конечностей характеризуется формированием одного или нескольких тромбов в глубоких венах конечности и, возможно, таза, с частичным или полным блокированием кровотока, нередко в сочетании с воспалением сосудистой стенки (тромбофлебит глубоких вен).
- Основные факторы риска ТГВ включают: пожилой возраст, иммобилизацию конечности, перенесенный инсульт, ТГВ в анамнезе, онкологические заболевания, перенесенные обширные оперативные вмешательства, травмы, ожирение, хроническую сердечную недостаточность, беременность. Более подробно факторы риска представлены в таблице 3.
- В большинстве случаев ТГВ нижних конечностей не представляет угрозы для жизни. Однако, ≈ у 1/3 пациентов с проксимальным ТГВ возможно развитие ТЭЛА. ТГВ может рецидивировать. Среди осложнений ТГВ также могут быть представлены гнойные поражения и посттромбофлебитический синдром.
- Типичные клинические проявления могут отсутствовать у значительной части пациентов (до 50%). Ввиду этого, необходима особая настороженность в отношении ТГВ / ТЭЛА у лиц, имеющих указанные выше (и перечисленные в таблице 3) факторы риска, особенно если представлено сочетание нескольких из них.
- Первым проявлением ТГВ может быть ТЭЛА.
- При наличии симптоматики ТГВ она обычно ограничена одной конечностью.
- Типичные проявления ТГВ включают: чувство тяжести в ногах, распирающую боль, стойкий отек голени или всей конечности, изменения цвета кожи (покраснение, побледнение, цианоз), локальная гипертермия, при тромбофлебите – лихорадка, интоксикационный синдром.
- Также могут быть представлены: подчеркнутый рисунок подкожных вен, «глянцевый» вид кожи, распространение боли по внутренней поверхности стопы, голени или бедра, боль в голени при тыльном сгибании стопы.
- Наиболее распространенным скрининговым методом диагностики является ультразвуковое / допплерографическое исследование вен нижних конечностей, при этом признаки ТГВ могут включать: 1) отсутствие изменений тока крови в бедренной вене при дыхании, указывающее на непроходимость венозной системы между бедренной веной и сердцем; 2) отсутствие увеличения кровотока по бедренной вене при быстром изгнании крови из вен голени, указывающее на непроходимость глубоких вен между голенью и бедром; 3) замедление скорости кровотока в бедренной, подколенной и передних большеберцовых венах; 4) различия между ультразвуковыми данными на пораженной и здоровой конечности.
- «Золотым стандартом» диагностики является дистальная восходящая флебография.
- Основу лечебной тактики при ТГВ составляют антитромботические препараты (рис. 4); также используются компрессионные чулки, анальгетики; обычно рекомендуется ранняя активизация пациента.
- Антитромботическая терапия при случайно выявленном бессимптомном ТГВ должна быть такой же по интенсивности и продолжительности, как и при ТГВ с клиническими проявлениями.
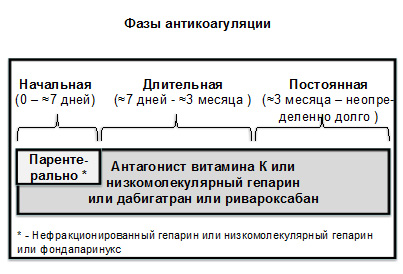
Рисунок 4. Фазы антикоагуляции при ТГВ и ТЭЛА (адаптировано из Braunwald’s Heart Disease, 2012; ESC, 2014)
Начальные лечебные антитромботические подходы
при проксимальном ТГВ нижних конечностей
- Больным с острым ТГВ нижних конечностей необходимо одновременное назначение парентерального антикоагулянта (низкомолекулярного гепарина или нефракционированного гепарина внутривенно или подкожно) и антагониста витамина К (варфарина). Парентеральный антикоагулянт рекомендуется принимать обычно не менее 5 дней и до момента, когда будет достигнут целевой уровень МНО в пределах 2,0-3,0
- Парентеральный антикоагулянт следует начать при высокой / умеренной вероятности наличия ТГВ еще в процессе ожидания результатов диагностических мероприятий, направленных на подтверждение диагноза ТГВ.
- Новые пероральные антикоагулянты – прямой ингибитор тромбина дабигатран и антагонисты Ха фактора коагуляции ривароксабан и апиксабан могут использоваться в начальном и последующем лечении ТГВ. Дабигатран назначается лицам, которые уже получали лечение парентеральным антикоагулянтом на протяжении 5-10 дней; ривароксабан и апиксабан могут быть использованы без предварительного применения парентерального антикоагулянта.
- Поскольку низкомолекулярные гепарины и новые ПОАК характеризуются существенным компонентом выведения через почки, их следует избегать или применять с высокой осторожностью при скорости клубочковой фильтрации (СКФ) < 30 мл/мин (для 70-летнего мужчины с весом 70 кг этому уровню СКФ примерно соответствует концентрация креатинина сыворотки крови > 200 мкмоль/л; для такой же женщины –>175 мкмоль/л). В этих случаях предпочтительно использование нефракционированного гепарина и варфарина.
- Для подсчета СКФ может быть использована известная стандартная формула:

В настоящее время более точной в определении СКФ считается формула CKD–EPI creatinine. Она весьма громоздка и непригодна для подсчета вручную, однако доступна онлайн:
(http://www.kidney.org/professionals/kdoqi/gfr_calculator.cfm); ее возможно перенести в электронные устройства индивидуального пользования (например, в мобильный телефон врача), что делает ее удобной для быстрого подсчета СКФ.
- Среди парентеральных антикоагулянтов низкомолекулярные гепарины предпочтительнее, чем нефракционированный гепарин.
- При использовании низкомолекулярного гепарина обычным является его назначение 1 раз в течение суток (если такой режим разрешен для соответствующего препарата).
- Начальное лечение ТГВ может проводиться в домашних условиях (если нет тяжелых симптомов и коморбидности, а также при наличии соответствующих возможностей, включая адекватный уровень комфортности дома, поддержку семьи, возможность быстрого возвращения в больницу в случае ухудшения).
- Больным с острым ТГВ рекомендована ранняя активизация (при возможности, без периода постельного режима) с целью уменьшения риска развития посттромбофлебитического синдрома и улучшения качества жизни.
- Постельный режим (с возвышенным положением пораженной конечности) может потребоваться у лиц с тяжелым болевым и/или отечным синдромом.
- Противопоказаны тепловые процедуры.
- Для контроля боли – анальгетики в минимальных эффективных дозировках; принимать во внимание повышение риска кровоточивости при сочетании нестероидных противовоспалительных препаратов и антитромботиков.
- Всем больным с острым ТГВ нижних конечностей с клиническими проявлениями рекомендуется применение компрессионных чулок.
Начальные лечебные антитромботические подходы
при изолированном дистальном ТГВ нижних конечностей
- Перечисленные ниже подходы используются у лиц с ТГВ при вовлечении вен голеней, включая малоберцовую, заднюю или переднюю большеберцовую, но без вовлечения подколенной или более проксимальных вен.
- При выполнении обязательных ультразвуковых (УЗ) исследований вен голени (или всей нижней конечности) у всех лиц с подозрением на ТГВ ≈ в 50% случаев выявляется изолированный дистальный ТГВ голеней. Без проведения обязательного УЗ-исследования вен нижних конечностей всем таким лицам изолированный дистальный ТГВ выявляется редко.
- Без лечения изолированный дистальный ТГВ примерно в 15% наблюдений имеет тенденцию к распространению на проксимальные вены (обычно в первые 2 нед от начала симптомов), что значимо увеличивает риск развития ТЭЛА. Ведущими факторами риска такого распространения являются: повышенный уровень D-димера, длина тромба >5 см, максимальный его диаметр >7 мм, вовлечение в тромбоз нескольких вен, близость тромба к проксимальным венам, активный онкологический процесс, ТГВ / ТЭЛА в анамнезе, иммобилизация.
- При изолированном дистальном ТГВ голени без тяжелых симптомов и без факторов риска распространения – рекомендуют серийное проведение УЗ-исследований вен голеней в течение 2 недель без начала антикоагулянтной терапии. При наличии перечисленных особенностей следует начать применять антикоагулянты (с учетом факторов риска кровоточивости – см. табл. 8).
- При отсутствии данных об увеличении размера тромба в течение 2 недель необходимости в проведении антикоагулянтной терапии не возникает; если его размер увеличился, но нет распространения на проксимальные вены – то такая терапия может быть назначена; если имеется распространение на проксимальные вены – назначение антикоагулянтов явно рекомендовано.
- Подходы к выбору и назначению антикоагулянтов, выбору режима и применению компрессионных чулок – те же, что и при проксимальном ТГВ.
Таблица 8. Факторы риска кровотечений при применении антикоагулянтной терапии и оценка степени риска (адаптировано из Рекомендаций АССР, 2012)
|
Факторы риска кровотечений* |
|
|
· Возраст 65 лет · Возраст 75 лет · Кровотечения в анамнезе · Онкологические заболевания · Метастазы при онкозаболеваниях · Нарушение функции почек · Нарушение функции печени · Тромбоцитопения · Сахарный диабет |
· Анемия · Перенесенный инсульт в анамнезе · Прием антитромбоцитарных препаратов · Плохой контроль при приеме антикоагулянтов · Иные сопутствующие заболевания · Недавние оперативные вмешательства** · Частые падения · Избыточное употребление алкоголя |
|
Оценка степени риска*** |
|
|
Низкий риск (нет ни одного из указанных выше факторов риска): исходная вероятность кровотечений без антикоагулянтной терапии – ≈ 0,6%; при антикоагулянтной терапии продолжительностью 0-3 месяца – ≈ 1,6%; при антикоагулянтной терапии длительностью >3 мес – ≈ 0,8%. |
|
|
Умеренный риск (1 из указанных выше факторов риска): исходная вероятность кровотечений без антикоагулянтной терапии – ≈ 1,2%; при антикоагулянтной терапии продолжительностью 0-3 месяца – ≈ 3,2%; при антикоагулянтной терапии длительностью >3 мес – ≈ 1,6%. |
|
|
Высокий риск (≥ 2 из указанных выше факторов риска): исходная вероятность кровотечений без антикоагулянтной терапии – ≈ 4,8%; при антикоагулянтной терапии продолжительностью 0-3 месяца – ≈ 12,8%; при антикоагулянтной терапии длительностью >3 мес – ≥ 6,5%. |
|
Примечания:
* – повышение риска кровоточивости, ассоциированное с действием фактора риска, может зависеть от 1) степени его выраженности (например, локализации и распространенности метастатического поражения, числа тромбоцитов); 2) интервала времени (например, промежутка времени, который прошел от момента хирургического вмешательства или предыдущего эпизода кровотечения); 3) того, насколько эффективно удалось взять под контроль предыдущую причину кровотечения (например, при желудочно-кишечном кровотечении).
** – особенно важно для парентеральной антикоагуляции (в течение первых 10 дней), несколько менее важно для длительной и постоянной антикоагуляции.
*** – приводимые ниже цифровые значения степени риска кровотечений отражают мнение экспертов АССР.
Подходы с устранением тромба
(тромболизис, венозная тромбэктомия) и фильтры в нижней полой вене при проксимальном ТГВ нижних конечностей
- Обычно при остром проксимальном ТГВ проведение антикоагулянтной терапии считают предпочтительным в сравнении с тромболизисом. Системный тромболизис обычно считают предпочтительным в сравнении с катетерным.
- У части больных с проксимальным ТГВ (особенно при наличии гангренозных поражений) катетерный или системный тромболизис могут быть рекомендованы (обычно для случаев илеофеморального ТГВ, длительности симптомов < 14 дней, низком риске кровоточивости, отсутствии коморбидности, ожидаемой продолжительности жизни ≥ 1 года).
- При наличии резидуальных поражений после тромболизиса могут быть использованы баллонная ангиопластика и стентирование.
- У большинства больных эксперты отдают предпочтение изолированному использованию антикоагулянтной терапии по сравнению с тромбэктомией.
- Оперативная венозная тромбэктомия резервируется только для больных, имеющих илеофеморальный ТГВ, длительность симптомов < 7 дней, хороший функциональный статус, ожидаемую продолжительность жизни ≥ 1 года.
- При использовании всех подходов с устранением тромба врачу необходим достаточный опыт проведения такого рода вмешательств.
- После любых манипуляций по устранению тромба (тромболизис, тромбэктомия) рекомендуется проведение антикоагулянтной терапии такой же интенсивности и продолжительности, как и у лиц с ТГВ, не подвергавшихся таким вмешательствам.
- Сферой использования интракавальных фильтров в лечении больных с проксимальным ТГВ являются лишь случаи, когда имеются противопоказания к применению антикоагулянтной терапии.
- Если после установки такого фильтра через какое-то время риск кровоточивости снижается и назначение антикоагулянтов становится возможным, то таким больным следует проводить обычную антикоагулянтную терапию. Наличие перманентного интракавального фильтра не является показанием к увеличению продолжительности применения антикоагулянтов.
Длительная терапия антикоагулянтами
после эпизода ТГВ нижних конечностей
- После перенесенного эпизода ТГВ нижних конечностей больным показана длительная антикоагулянтная терапия с целью 1) завершения лечения острого эпизода ТГВ (обычно этот компонент цели доминирует в течение первых 3 месяцев лечения); 2) предотвращения развития новых эпизодов ТГВ (эта составляющая, как правило, является основной в сроки > 3 месяцев лечения).
- Части пациентов после перенесенного ТГВ может требоваться неопределенно долгое применение антикоагулянтной терапии. При этом, однако, ежегодно необходимо переоценивать соотношение между потенциальной полезностью ее продолжения и возможным риском кровоточивости.
- Больным с эпизодом ТГВ, которые получают длительную терапию антагонистом витамина К (варфарином), при любой продолжительности лечения обычно рекомендуется поддержание значений МНО в пределах 2,0-3,0.
- Рекомендуемая продолжительность приема антикоагулянтов после ТГВ:
- проксимальный ТГВ, спровоцированный хирургическим вмешательством – обычно 3 месяца;
- проксимальный ТГВ, спровоцированный транзиторным фактором риска, не связанным с хирургическим вмешательством – обычно 3 месяца;
- изолированный дистальный ТГВ, спровоцированный транзиторным фактором риска – обычно 3 месяца;
- неспровоцированный транзиторными факторами риска дистальный или проксимальный ТГВ – обычно не менее 3 месяцев, а возможно – и неопределенно долго, если ожидаемая польза явно превышает риск;
- первый неспровоцированный эпизод проксимального ТГВ – обычно неопределенно долго, а при высоком риске кровоточивости – 3 месяца;
- первый неспровоцированный эпизод дистального ТГВ – обычно 3 месяца (как при низком, так и при умеренном, и высоком риске кровоточивости);
- второй неспровоцированный эпизод ТГВ – обычно неопределенно долго (при низком или умеренном риске кровоточивости), либо в течение 3 месяцев (если этот риск высокий);
- эпизод ТГВ на фоне активного онкологического заболевания – обычно неопределенно долго (как при низком / умеренном, так и, возможно, даже при высоком риске кровоточивости).
- Выбор вариантов антикоагулянтной терапии после эпизода ТГВ:
- ТГВ, не связанный с онкологическим заболеванием – антагонист витамина К (варфарин), или дабигатран или ривароксабан или низкомолекулярный гепарин;
- ТГВ, связанный с онкологическим заболеванием – низкомолекулярный гепарин или антагонист витамина К (варфарин) или дабигатран (Прадакса) или ривароксабан;
- при выборе антикоагулянта следует учитывать удобство для больного (для низкомолекулярного гепарина – необходимость в ежедневных инъекциях), важность лабораторного контроля (особенно для варфарина), стоимость. Применение низкомолекулярного гепарина, дабигатрана и ривароксабана может быть ограничено при СКФ < 30 мл/мин.
Подходы к профилактике и лечению
посттромбофлебитического синдрома
- Термином «посттромбофлебитический синдром» обозначается комплекс клинических проявлений, связанных с перенесенным ранее эпизодом ТГВ.
- Развитие этого синдрома наблюдается примерно у 1/3 больных, переносивших ТГВ в целом, и у 2/3 лиц, переносивших илеофеморальный тромбоз.
- Наиболее типичные симптомы включают хроническую боль и отечность конечности, дискомфорт при ходьбе, изменения окраски кожи; наиболее тяжелое проявление – изъязвление кожи голеней / стоп.
- Правильное использование компрессионных чулок способно снизить риск развития посттромбофлебитического синдрома примерно на 50%.
- Всем больным с острым ТГВ и клиническими проявлениями рекомендовано использование компрессионных чулок (создающих давление в области лодыжки в пределах 30-40 мм рт.ст., и несколько меньшее давление – в области бедра, т.е. со ступенчатым распределением давления); его следует начать по возможности сразу после начала антикоагулянтной терапии.
- Если на начальном этапе компрессионные чулки использовать невозможно, то в качестве исходной компрессионной терапии можно применить компрессионные бандажи.
- Использование компрессионных чулок должно быть длительным (не менее 2 лет, а возможно – и дольше, особенно при хорошей переносимости, а также при развитии посттромбофлебитичского синдрома).
- Если больной не заинтересован в профилактике посттромбофлебитического синдрома и/или очень плохо переносит компрессионные чулки, то велика вероятность отказа пациента от использования этого подхода.
- У лиц с уже развившимся посттромбофлебитическим синдромом данных об эффективности компрессионных чулок значительно меньше. Большинству больных можно рекомендовать попытку их применения (для большинства достаточны чулки, располагающиеся ниже уровня колена, но при значительной отечности бедра можно использовать и чулок на всю ногу).
- При отсутствии адекватного уменьшения симптомов пост-тромбофлебитического синдрома при применении компрессионных чулок можно сделать попытку применения устройств, обеспечивающих интермиттирующую компрессию нижних конечностей.
- В исследованиях не показано отчетливого эффекта от применения у лиц с посттромбофлебитическим синдромом таких веноактивных препаратов, как рутозиды, дефибротид и гидросмин / веносмин; их рутинное использование у таких пациентов не рекомендовано.
- Эксперты полагают, что эти лекарственные средства можно попытаться применить у больных, которые очень настроены на такое лечение (и согласны на сопряженный с ним возможный риск развития побочных эффектов).
Раздел III.
лечение тЭЛА
Начальные лечебные антитромботические подходы
при остром эпизоде ТЭЛА
- Больным с острым эпизодом ТЭЛА обычно необходимо одновременное назначение парентерального антикоагулянта (низкомолекулярного гепарина или фондапаринукса, или нефракционированного гепарина внутривенно или подкожно) и антагониста витамина К (варфарина). Парентеральный антикоагулянт рекомендуется продолжать обычно не менее 5 дней и до момента, когда МНО будет находиться на уровне ≥ 2,0 в течение не менее 24 часов.
- Парентеральный антикоагулянт следует применять еще в процессе ожидания результатов диагностических мероприятий, направленных на подтверждение диагноза ТЭЛА, при высокой вероятности ее наличия (см.табл.3), а также при умеренной вероятности (в этом случае – если время ожидания результатов диагностических тестов >4 ч). При низкой вероятности ТЭЛА начинать лечение парентеральным антикоагулянтом не следует до получения результатов обследования.
- Новые пероральные антикоагулянты – прямой ингибитор тромбина дабигатран (Прадакса) и антагонисты Ха фактора коагуляции ривароксабан и апиксабан могут использоваться в начальном и последующем лечении ТЭЛА. Дабигатран – Прадакса (по 150 мг 2 раза в день, а у лиц в возрасте ≥ 80 лет – по 110 мг 2 раза в день) назначается лицам, которые уже получали лечение парентеральным антикоагулянтом на протяжении 5-10 дней; ривароксабан и апиксабан могут быть использованы без предварительного применения парентерального антикоагулянта.
- Среди парентеральных антикоагулянтов у лиц с острым эпизодом ТЭЛА низкомолекулярные гепарины предпочтительнее, чем нефракционированный гепарин (вводимый как подкожно, так и внутривенно).
- При использовании низкомолекулярного гепарина обычным является его назначение 1 раз в течение суток (если такой режим разрешен для соответствующего препарата и если допустимо однократное введение его полной суточной дозы).
- Применение нефракционированного гепарина внутривенно может быть предпочтительным режимом парентеральной антикоагулянтной терапии у следующих категорий пациентов: 1) с уровнем СКФ <30 мл/мин; 2) при наличии сомнений в адекватности абсорбции подкожно вводимого препарата; 3) если предполагается использование тромболитической терапии.
- Эксперты США отмечают, что для лиц с ТЭЛА, имеющих низкий риск, при наличии адекватных домашних условий, возможно рассмотреть вопрос о более ранней выписке из стационара (примерно на 3-й день лечения) в сравнении с обычным сроком (после 5 дня). При этом оговариваются, что с учетом значительно более высокого риска, сопряженного с ТЭЛА в сравнении с ТГВ, вопрос о продолжении лечения в домашних условиях в каждом случае решается строго индивидуально. Также отмечают, что больные, предпочитающие более высокий уровень защищенности в условиях стационара более значимому уровню удобства и комфортности в домашних условиях, более вероятно предпочтут продолжение лечения в стационаре.
- Больным, у которых при случайном обследовании обнаружен бессимптомно протекающий эпизод ТЭЛА, начальную и длительную антикоагулянтную терапию следует проводить таким же образом, что и лицам с ТЭЛА, сопровождающейся клиническими проявлениями.
Тромболитическая терапия при остром эпизоде ТЭЛА
- По данным специалистов западных стран, среди лиц с диагностированной ТЭЛА, которым начато лечение, около 5% погибают от исходного или повторного эпизода ТЭЛА в течение ближайших 7 дней.
- Риск смерти при ТЭЛА варьирует в широких пределах. Он оценивается примерно в 70% у лиц, имеющих в клинической картине остановку сердца (такие составляют около 1% среди больных с ТЭЛА в целом); риск смерти определяют на уровне 30% при наличии шока, требующего инотропной поддержки (этих пациентов около 5%); и, наконец, риск смерти составляет примерно 2% у лиц, не имеющих гипотензии. При наличии нормальных уровней артериального давления прогноз также довольно вариабелен в зависимости от: 1) клинических особенностей; 2) уровня кардиальных биомаркеров (таких как тропонин и мозговой натрийуретический пептид); 3) размера и функции правого желудочка.
- В рандомизированных исследованиях отмечено, что применение тромболитических препаратов в течение 24 ч от начала клинических проявлений ТЭЛА способствует улучшению: 1) гемодинамических показателей в системе легочной артерии (со снижением средних уровней давления в ней); 2) оксигенации крови; 3) легочной перфузии; 4) функции правого желудочка. В то же время не доказано, что этот метод лечения приводит к уменьшению степени выраженности резидуального тромбоза в легочной артерии. Тромболизис при ТЭЛА может уменьшать риск смерти и рецидивирования ТЭЛА, но сопряжен с существенным повышением риска кровотечений.
- Полагают, что факторы риска кровоточивости при тромболизисе и противопоказания к его применению у лиц с ТЭЛА (они приведены в таблице 9) подобны тем, что разработаны для лиц с инфарктом миокарда с элевацией сегмента ST.
- С учетом того что при ТЭЛА имеется связь между выраженностью клинических проявлений и степенью тяжести эмболизации / обструкции легочной артерии, эксперты считают, что более значительную пользу от тромболизиса получат именно больные с наиболее тяжелой клинической картиной (табл. 10).
- Благоприятное соотношение между потенциальной пользой от тромболизиса и вероятным риском кровотечений, по данным рандомизированных исследований и мета-анализов, имеет место лишь для категории особенно тяжелых пациентов (имеющих гипотензию – при уровнях систолического АД<90 мм рт.ст. или при документированном снижении систолического АД на 40 мм рт.ст. и более в сочетании с признаками периферической гипоперфузии и гипоксии) при отсутствии высокого риска кровоточивости.
- В серьезных рандомизированных контролируемых исследованиях, проводившихся в мировой практике с тромболитиками при ТЭЛА, эти препараты применялись в сроки до 24 ч от начала симптомов. Убедительной «доказательной базы» их применения в более отдаленные сроки не имеется; в международных Рекомендациях четких указаний на предельные сроки применения этих препаратов при ТЭЛА нет. Однако ряд экспертов (в т.ч. отечественных) полагают, что, с учетом возможности рецидивирования тромбоэмболического процесса, использование тромболитических средств может быть оправдано при ТЭЛА и в более поздние сроки, особенно при наличии гипотензии и низком риске кровотечений. Так, в отечественной лечебной практике отмечают, что наилучшие результаты от введения тромболитика при ТЭЛА могут быть получены при его применении в сроки до 48-72 часов от момента эмболизации, а допустимым пределом времени считают сроки до 6 и даже до 14 дней от появления симптомов ТЭЛА.
Таблица 9. Факторы риска кровотечения и противопоказания к применению тромболитиков при ТЭЛА (адаптировано из Рекомендаций АССР, 2012)
|
Основные противопоказания (при их наличии тромболизис обычно не проводится): · Наличие структурных интракраниальных поражений. · Интракраниальные геморрагии в анамнезе. · Ишемический инсульт в течение ближайших 3 месяцев. · Активное кровотечение. · Недавние хирургические вмешательства на головном или спинном мозге. · Недавняя травма головы с переломом или повреждением головного мозга. · Геморрагические диатезы. |
|
Относительные противопоказания: · Систолическое АД > 180 и/или диастолическое АД > 110 мм рт.ст. · Недавнее неинтракраниальное кровотечение. · Недавнее хирургическое вмешательство или инвазивная процедура. · Ишемический инсульт в течение более чем 3 месяцев. · Прием антикоагулянтов (например, антагонистов витамина К). · Травматичная сердечно-легочная реанимация. · Перикардит или гидроперикард. · Диабетическая ретинопатия. · Беременность. · Возраст > 75 лет. · Низкая масса тела (< 60 кг). · Женский пол. |
|
Риск кровотечений: · Среди 32 тысяч лиц с инфарктом миокарда, которым в рамках программы Medicare, США проводилось лечение тромболитиками, независимыми факторами риска кровотечений явились возраст (повышение риска на 4% на каждый год жизни), черная раса (повышение риска на 40%), женский пол (на 50%), артериальная гипертензия (на 20%) и низкая масса тела. · Тромболитическая терапия ассоциирована с повышением риска кровоточивости примерно в 3,5 раза в течение 35 дней (для интракраниальных кровотечений это повышение риска примерно 7-кратное); около ¾ всех кровотечений развивается в первые 24 часа после введения препарата. · Степень риска кровотечений также зависит от: 1) выраженности факторов риска (например, объема оперативного вмешательства или тяжести травмы); 2) интервала между действием фактора риска и моментом тромболизиса (полагают, что риск кровотечения значимо снижается примерно через 2 недели после операции или после перенесенного ранее кровотечения). · Имевшиеся ранее кровотечения «критической локализации» (интракраниальной, интраокулярной, из участков, не подлежащих сдавлению) представляют более значимые противопоказания к тромболитической терапии. |
Таблица 10. Тромболитическая терапия при остром эпизоде ТЭЛА
|
Рекомендации экспертов АССР, 2012: · Тромболитическая терапия рекомендована лицам с острым эпизодом ТЭЛА, протекающим с развитием гипотензии (систолическое АД < 90 мм рт.ст.), если у них нет высокого риска кровотечений. · Тромболитическая терапия также может быть применена у части больных с острым эпизодом ТЭЛА, протекающим без гипотензии, при низком риске кровотечений, если с учетом исходных клинических данных или особенностей клинической картины после начала антикоагулянтной терапии у них имеется высокий риск развития гипотензии. · Большинству больных с острым эпизодом ТЭЛА, не имеющим гипотензии, проведение тромболитической терапии не рекомендуется. · Тромболитик рекомендуется вводить в периферическую вену на протяжении ≤ 2 часов (более длительное введение – в течение 12 и 24 ч ассоциировано с повышением риска кровотечений и более медленным лизисом тромба). · В рандомизированных исследованиях при ТЭЛА изучались урокиназа, стрептокиназа, ретеплаза / альтеплаза, десмотеплаза. |
|
Рекомендации экспертов ESC, 2014: · Тромболитическая терапия рекомендована пациентам с ТЭЛА, имеющим клинические проявления шока или гипотензии. · Рутинное применение тромболизиса не рекомендовано больным с ТЭЛА без шока или гипотензии. · Тромболитическая терапия может быть применена у лиц с ТЭЛА при умеренном / высоком уровне риска и клиническими проявлениями гемодинамической декомпенсации. · Среди тромболитиков могут быть использованы стрептокиназа (250.000 ед – нагрузочная доза в течение 30 минут, затем внутривенная поддерживающая инфузия со скоростью 100.000 ед/час на протяжении 12-24 ч), альтеплаза |
|
Применение алтеплазы при ТЭЛА: · Алтеплаза является разрешенным и рекомендованным к применению тромболитиком при ТЭЛА. Алтеплаза – стандартный и наиболее часто используемый сейчас тромболитик при ТЭЛА во многих странах мира. Наряду с применением у этих пациентов обладает огромным объемом «доказательной базы» улучшения прогноза при инфаркте миокарда с элевацией сегмента ST и при ишемическом инсульте. Указание на возможность использования при ТЭЛА присутствует в официальных инструкциях к Алтеплазе. · Режим применения Алтеплазы при ТЭЛА – 100 мг внутривенно в течение 2 часов. С учетом указанной выше рекомендации экспертов США о предпочтительности более короткого введения тромболитика перед более продолжительным Алтеплаза получает целый ряд ценных преимуществ по сравнению со стрептокиназой. |
Антикоагулянтная терапия на фоне тромболизиса при ТЭЛА
- Во всех исследованиях, которые проводились с тромболитиками при ТЭЛА, в качестве сопровождающей тромболизис антикоагулянтной терапии применялся внутривенный нефракционированный гепарин (рекомендации по подбору его дозы см. в таблице 11).
- Его рекомендуют начать в полной дозе еще до начала применения тромболитика и продолжать в ходе его введения (это, в особенности, касается стрептокиназы). Эксперты США на период 2-часовой инфузии алтеплазы предпочитают временно приостанавливать введение гепарина, а сразу же после завершения этой инфузии проконтролировать значение активированного частичного тромбопластинового времени и, если оно не более 80 с, то возобновить внутривенное введение нефракционированного гепарина без болюса с той же скоростью, какая была до введения тромболитика.
Таблица 11. Рекомендуемый подход к подбору дозы и скорости внутривенной инфузии нефракционированного гепарина с учетом данных активированного частичного тромбопластинового времени – по Рекомендациям ESC, 2014
|
Значения активированного частичного тромбопластинового времени* |
Изменения дозы / скорости внутривенной инфузии |
|
< 35 секунд (менее чем в 1,2 раза выше, чем контрольный уровень) |
Болюс 80 ед/кг, повысить скорость инфузии на 4 ед/кг/час |
|
35-45 секунд (в 1,2-1,5 раза выше, чем контрольный уровень) |
Болюс 40 ед/кг, повысить скорость инфузии на 2 ед/кг/час |
|
46-70 секунд (в 1,5-2,3 раза выше, чем контрольный уровень) |
Оставить дозу без изменений |
|
71-90 секунд (в 2,3-3,0 раза выше, чем контрольный уровень) |
Снизить скорость инфузии на 2 ед/кг/час |
|
> 90 секунд (более чем в 3,0 раза выше, чем контрольный уровень) |
Приостановить инфузию на 1 час, затем снизить ее скорость на 3 ед/кг/час |
Примечание: * – для подбора дозы / скорости внутривенной инфузии нефракционированного гепарина обычно рекомендуется оценка уровней этого показателя каждые 6 часов (интервал может быть меньше, при необходимости)
Катетерное устранение тромба
на начальном этапе лечения ТЭЛА
- Рекомендация (2012-2014): Катетерные методы устранения тромба могут быть использованы (при наличии соответствующих опыта и возможностей) у больных с острым эпизодом ТЭЛА, ассоциированным с гипотензией: 1) которым противопоказан тромболизис; 2) у которых тромболизис был неэффективен; 3) у которых имеется шок, угрожающий наступлением смерти еще до того, как может наступить эффект от тромболитической терапии (т.е. в течение нескольких часов).
- Интервенционные катетерные методы, применяемые при массивной ТЭЛА, включают: 1) механическую фрагментацию тромба стандартным катетером для легочной артерии; 2) пульверизацию тромба ротационным «корзиночным» катетером; 3) эмболэктомию с использованием ротационного катетера типа «свиной хвост» («pigtail»).
- В центрах, обладающих значительным опытом, может применяться комбинация катетерных методов и тромболизиса (если риск кровотечений не является высоким), либо же катетерные подходы используют при неуспехе тромболизиса.
- Рандомизированные исследования катетерных методов лечения ТЭЛА не проводились. Большинство работ на эту тему представлены ретроспективными анализами, которые включают менее 30 пациентов. Выбор катетеров и методики их применения должен базироваться на предпочтениях и ресурсах соответствующего интервенционного сосудистого центра.
Хирургическая эмболэктомия
на начальном этапе лечения ТЭЛА
- Рекомендация (2012-2014): Хирургическая эмболэктомия из системы легочной артерии может быть использована (при наличии соответствующих опыта и возможностей) у больных с острым эпизодом ТЭЛА, ассоциированным с гипотензией: 1) которым противопоказан тромболизис; 2) у которых тромболизис или катетерная эмболэктомия оказались неэффективными; 3) у которых имеется шок, угрожающий наступлением смерти еще до того, как может наступить эффект от тромболитической терапии (т.е. в течение нескольких часов).
- Хирургическая эмболэктомия также может быть использована у лиц с ТЭЛА, которым требуется хирургическое устранение тромба из правого предсердия, а также если необходимо закрытие овального окна (foramen ovale) при его незаращении (например, при «парадоксальной эмболии»).
- Рандомизированные исследования, где оценивался бы этот метод лечения ТЭЛА, отсутствуют.
Установка фильтра в нижнюю полую вену
на начальном этапе лечения ТЭЛА
- Рекомендации (2012-2014): Установка фильтра в нижнюю полую вену может быть рекомендована больным с острым эпизодом ТЭЛА при наличии противопоказаний к проведению антикоагулянтной терапии. Больным с острой ТЭЛА, которые получают лечение антикоагулянтами, не следует устанавливать такие фильтры (за исключением, возможно, лиц, у которых на этом фоне сохраняется гипотензия). Если после установки интракавального фильтра через какое-то время риск кровоточивости снижается и назначение антикоагулянтов становится возможным, то таким больным следует проводить обычную антикоагулянтную терапию. Вопрос об установке фильтра в нижнюю полую вену может быть рассмотрен у больных, имеющих повторные эпизоды ТЭЛА несмотря на поддержание терапевтических уровней антикоагуляции.
- Наличие перманентного интракавального фильтра не является показанием к увеличению продолжительности применения антикоагулянтов.
- Констатируется отсутствие рандомизированных исследований, где оценивалась бы эффективности интракавальных фильтров в лечении острой ТЭЛА.
Длительная терапия антикоагулянтами после эпизода ТЭЛА
- После перенесенного эпизода ТЭЛА больным обычно показана длительная антикоагулянтная терапия. Ее особенности достаточно подробно изучены в целом ряде авторитетных рандомизированных контролируемых исследований.
- Части пациентов после перенесенного эпизода ТЭЛА может требоваться неопределенно долгое применение антикоагулянтной терапии. При этом, однако, ежегодно необходимо переоценивать соотношение между потенциальной полезностью ее продолжения и возможным риском кровоточивости.
Больным, которые после эпизода ТЭЛА получают длительную терапию антагонистом витамина К (варфарином), при любой продолжительности лечения обычно рекомендуется поддержание значений МНО в пределах 2,0-3,0.
- Рекомендуемая продолжительность приема антикоагулянтов после ТЭЛА:
- эпизод ТЭЛА, спровоцированный хирургическим вмешательством – обычно 3 месяца;
- эпизод ТЭЛА, спровоцированный транзиторным фактором риска, не-связанным с хирургическим вмешательством – обычно 3 месяца;
- эпизод ТЭЛА, неспровоцированный транзиторными факторами риска – обычно не менее 3 месяцев; после этого срока у таких больных следует еще раз оценить соотношение между потенциальной пользой и возможным риском более длительной терапии;
- первый неспровоцированный эпизод ТЭЛА – обычно неопределенно долго, а при высоком риске кровоточивости – 3 месяца;
- второй неспровоцированный эпизод ТЭЛА – обычно неопределенно долго (при низком или умеренном риске кровоточивости), либо в течение 3 месяцев (если этот риск высокий);
- эпизод ТГВ на фоне активного онкологического заболевания – обычно неопределенно долго (как при низком / умеренном, так и, возможно, даже при высоком риске кровоточивости).
- Для длительной антикоагулянтной терапии после перенесенного эпизода ТЭЛА могут использоваться антагонист витамина К (варфарин) либо новые пероральные антикоагулянты – прямой ингибитор тромбина дабигатран – Прадакса (по 150 мг 2 раза в день, а у лиц в возрасте ≥ 80 лет – по 110 мг 2 раза в день) и антагонисты Ха фактора коагуляции ривароксабан и апиксабан.
- Лицам с ТЭЛА на фоне онкологических заболеваний в течение первых 3-6 месяцев рекомендуется антикоагулянтная терапия с использованием низкомолекуляного гепарина.
- При выборе антикоагулянта, как и в аналогичных случаях для ТГВ, следует учитывать удобство для больного (необходимость в ежедневных инъекциях – для низкомолекулярного гепарина), важность лабораторного контроля (особенно для варфарина), стоимость. Применение низкомолекулярного гепарина, дабигатрана, ривароксабана и апиксабана может быть ограничено при СКФ < 30 мл/мин.
- Если больной, перенесший эпизод ТЭЛА, не желает принимать антикоагулянты (или не имеет возможности их получать, например в силу экономических соображений или отсутствия контроля МНО – для варфарина), то в качестве антитромботического средства может быть назначена ацетилсалициловая кислота.
Раздел IV.
ХАРАКТЕРИСТИКА ДАБИГАТРАНА
ВОЗМОЖНОСТИ ЕГО ПРИМЕНЕНИЯ ПРИ ТГВ / ТЭЛА
Важность появления новых пероральных антикоагулянтов
- Длительное время стандартом пероральной антикоагулянтной терапии считались препараты из группы антагонистов витамина К1, среди которых одним из наиболее изученных и востребованных являлся варфарин.
- Варфарин и близкие к нему препараты позволяют существенно снизить риск развития тромбоэмболических нарушений при целом ряде патологических состояний, включая фибрилляцию / трепетание предсердий, ТГВ / ТЭЛА и ряд других. Вместе с тем, эти препараты характеризуются наличием целого спектра серьезных недостатков, которые существенно ограничивают их применение. Среди проблем, сопряженных с применением варфарина, выделяют: 1) необходимость постоянного лабораторного контроля международного нормализующего отношения – МНО; 2) наличие многочисленных взаимодействий с лекарственными препаратами (амиодарона – особенно значимо!; в меньшей мере – метронидазола, рифампицина, цефалоспоринов 2 и 3 поколений, макролидов, тироксина, пенициллинов – в высоких дозах, а также многих других) и пищевыми продуктами (зелень, зеленые овощи и др.); 3) вариабельность ответа на варфарин, в силу чего в группе так называемых «неответчиков» не удается удерживать устойчивый контроль МНО в целевых пределах.
- С учетом этих недостатков, по данным экспертов западных стран, более 50% больных, которым показан прием варфарина, не могут его принимать из-за непереносимости, побочных эффектов, неудобств, связанных с его приемом, высокой вариабельности МНО («неответчики»), невозможности адекватного контроля МНО. Более того, констатируется, что довольно большая часть специалистов широкой практики (общей практики, семейной медицины), а также врачей более узких медицинских специальностей просто опасаются варфарина и из-за этого не используют его в своих назначениях (тем самым не обеспечивая должный уровень антитромботической протекции у своих больных).
- С учетом целого ряда присущих антагонистам витамина К1 недостатков, крайне позитивно оценивается появление и внедрение в широкую клиническую практику альтернативных им новых пероральных антикоагулянтов. Среди таких препаратов – дабигатран – прямой ингибитор тромбина (IIa фактора коагуляции, рис. 5), а также ривароксабан и апиксабан – ингибиторы Ха фактора коагуляции.
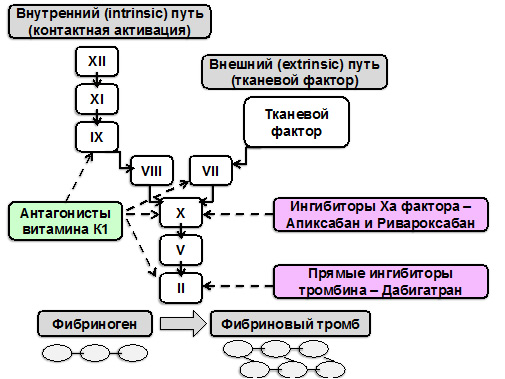
Рисунок 5. Коагуляционный каскад
Общий взгляд на дабигатран
- Дабигатран – селективный обратимый конкурентный прямой ингибитор тромбина. Препятствует образованию тромба путем ингибирования как свободного, так и связанного тромбина, при этом блокируется преобразование фибриногена в фибрин.
- Обладает важными преимуществами в сравнении с варфарином: 1) более предсказуемый терапевтический профиль; 2) значительно меньшее количество лекарственных взаимодействий; 3) отсутствие взаимодействий с пищевыми продуктами; 4) более низкий риск интракраниальных кровотечений.
- Характеризуется быстрым началом и прекращением антикоагулянтного эффекта. С учетом этого, в начале лечения дабигатраном (в отличие от варфарина) не требуется «мостик» из парентеральных антикоагулянтов. Может также не требоваться «мостик» у больных, уже получающих дабигатран, если нужно его прервать на короткое время для проведения инвазивных вмешательств.
- Однако с учетом быстрого начала и быстрого прекращения действия при использовании дабигатрана весьма важна высокая приверженность больного к лечению. Следует объяснить больному, что: 1) необходимо иметь запас препарата; 2) нужно избегать пропусков его приема; 3) при случайном пропуске – принять препарат столь быстро, сколько возможно; 4) не следует принимать удвоенную дозу препарата при случайном пропуске предыдущего его приема.
- Применение дабигатрана не требует контроля МНО или иных параметров гипокоагуляции.
- Лекарственная форма – капсулы по 150 и 110 мг; прием 2 р/сут (важна приверженность больного к лечению); при возникновении диспепсии – прием после еды.
- Необходимо инструктировать больного не разжевывать, не раздавливать и не открывать капсулы, запивать нужно полным стаканом воды.
- Выводится преимущественно почками. Не применяется при тяжелом снижении функции почек (СКФ < 30 мл/мин); при умеренном снижении функции почек требуется уменьшение дозы.
- Доза дабигатрана у большинства больных – по 150 мг 2 р/сут. Доза по 110 мг 2 р/сут рекомендована: 1) лицам ≥80 лет; 2) при сочетанном использовании с верапамилом; 3) при высоком риске кровоточивости (баллы HAS-BLED ≥ 3 – это шкала риска кровоточивости, которая используется у лиц с фибрилляцией предсердий); 4) при СКФ 30-49 мл/мин.
- Находит широкое применение для профилактики тромбоэмболических осложнений при фибрилляции / трепетании предсердий; включен с этим показанием во все действующие в настоящее время отечественные и международные Рекомендации.
- В ключевом исследовании RE-LY (включало >18 тысяч больных, средний возраст которых составил 71 год) в сравнении с варфарином у таких больных дабигатран продемонстрировал: 1) снижение риска «первичной конечной точки» (инсульт + тромбоэмболические осложнения) на 34%; 2) уменьшение риска развития всех видов инсультов на 36%, в т.ч. ишемических – на 24% и геморрагических – на 74%; 3) уменьшение частоты смертельных / жизнеугрожающих кровотечений на 19% и интракраниальных кровотечений – на 60% (все эти эффекты были статистически достоверными); 4) при отсутствии различий в частоте «больших кровотечений» и общей смертности.
- Проведение радиочастотной аблации по поводу фибрилляции / трепетания предсердий, а также кардиоверсии на фоне лечения дабигатраном считается безопасным.
- У больных с фибрилляцией предсердий, ранее переносивших инфаркт миокарда, не отмечено повышения коронарного риска при использовании дабигатрана. Применение дабигатрана уже разрешено (с 2015г.) в составе комплексной антитромботической терапии у лиц с фибрилляцией предсердий после коронарного стентирования (обычно в сочетании с ацетилсалициловой кислотой и клопидогрелем – в течение первых 12 месяцев, затем – изолированно).
- Использование дабигатрана, как и всех новых пероральных антикоагулянтов, изучено, главным образом, у лиц с фибрилляцией предсердий без значимых клапанных пороков. Лица с механическими протезами клапанов, с биопротезами, а также с гемодинамически значимым митральным стенозом не включались в основные рандомизированные исследования с новыми препаратами, вследствие чего эти больные в качестве перорального антикоагулянта должны получать только антагонист витамина К1 (обычно варфарин). Лица с аортальным стенозом или с аортальной или митральной недостаточностью, которые не требовали хирургического вмешательства, могли включаться в эти исследования.
- В случае развития кровоточивости на дабигатране или при его передозировке рекомендуют: 1) прекратить прием препарата; 2) первые антидоты уже разработаны, но данные об их широком клиническом применении пока отсутствуют; 3) для уменьшения абсорбции может быть применен активированный уголь; 4) может быть эффективен гемодиализ; 5) при жизнеугрожающем кровотечении – концентрат протромбинового комплекса или концентрат активированного протромбинового комплекса и рекомбинантный активированный фактор VII.
- Лекарственные взаимодействия: 1) не следует сочетать с рифампицином; 2) концентрации дабигатрана могут увеличиваться при сочетанном применении с кетоконазолом, верапамилом, амиодароном, хинидином, кларитромицином; 3) ингибиторы протонной помпы могут снижать всасывание дабигатрана.
Возможности применения дабигатрана при ТГВ / ТЭЛА
- Дабигатран, в соответствии с обновленными Рекомендациями по лечению ТЭЛА (ESC, 2014) рассматривается сейчас в качестве одного из основных препаратов для антикоагулянтной терапии у подобных больных. Его назначение целесообразно в качестве альтернативы варфарину больным с острыми ТГВ / ТЭЛА, которые уже получали парентеральный антикоагулянт на протяжении 5-10 дней. Дабигатран пригоден для длительной (в т.ч. постоянной) антикоагулянтной терапии у таких пациентов.
- В настоящее время применение при ТГВ / ТЭЛА включено в официальную инструкцию к дабигатрану.
- Столь серьезная позиция дабигатрана при ТГВ / ТЭЛА обусловлена позитивными результатами целого ряда серьезных исследований, в которых он оценивался у подобных больных. Кратко остановимся на некоторых результатах этих исследований.
- Суммарно в эти авторитетные рандомизированные двойные слепые исследования вошли 4.387 больных, перенесших ТГВ / ТЭЛА. В трех из исследований (RE-COVER, RE-COVER II и RE-MEDY) дабигатран в стандартной дозе по 150 мг 2 раза в сутки сравнивался с варфарином (с поддержанием МНО в пределах 2,0-3,0), а в одном (RE-SONATE) – с плацебо. В демографическом плане эти исследования были близки, около 60% из вошедших в них пациентов были мужчинами, средний возраст составил 55 лет.
- В RE-COVER и RE-COVER II дабигатран сравнивался с варфарином у лиц с ТЭЛА, которые на протяжении 5-10 дней уже получали парентеральный антикоагулянт (варфарин при этом начинали одновременно с ним). Средняя продолжительность наблюдения составила 164 дня. Общий результат: в «группе дабигатрана» в сравнении с «группой варфарина» оказалось достоверно меньше «больших кровотечений» (на 27%), клинически значимых кровотечений, не относящихся к «большим» (на 42%), а также кровотечений в целом (на 30%), все эти различия были статистически достоверны. Эффективность обоих препаратов в предупреждении развития венозных тромбоэмболий или связанных с ними смертей оказалась сравнимой.
- Исследование RE-MEDY было нацелено на оценку результатов более длительного применения дабигатрана после ТГВ / ТЭЛА, средняя продолжительность лечения дабигатраном или варфарином составила 473 дня (у части пациентов она превышала 3 года). При сравнимой эффективности в предупреждении рецидивов ТГВ / ТЭЛА, дабигатран в сравнении с варфарином в течение этого продолжительного периода вновь продемонстрировал уменьшение «больших кровотечений» (на 46%), клинически значимых кровотечений, не относящихся к «большим» (на 44%), а также кровотечений в целом (на 29%), различия оказались статистически значимыми.
- Наконец, в исследовании RE-SONATE стандартная доза дабигатрана сравнивалась с плацебо у лиц с ТГВ / ТЭЛА на протяжении в среднем 165 дней. Дабигатран оказался значительно эффективнее плацебо в предупреждении рецидивов венозных тромбоэмболий; естественно, что его применение было ассоциировано с некоторым повышением геморрагического риска (так, «больших кровотечений» было мало и различия между группами отмечены не были, а кровотечений в целом на дабигатране оказалось 72 из 684 больных, на плацебо – 40 из 659).
Заключение
В завершение обсуждения проблемы ТГВ / ТЭЛА еще раз подчеркнем ее крайнюю актуальность. Принимая во внимание полиморфизм клинических проявлений и сложности диагностики, следует учитывать возможность наличия ТГВ / ТЭЛА у больных с самыми различными клиническими проявлениями. Наиболее распространенным и точным методом диагностики ТЭЛА сейчас является КТ-пульмональная ангиография, определенную диагностическую ценность также имеют эхокардиография, электрокардиография, рентгеновское исследование органов грудной клетки, исследование уровней D-димера; реже используются другие методы. Современные лечебные и профилактические подходы при ТГВ / ТЭЛА способны существенно уменьшить сопряженный с ними риск. Основу лечебной стратегии у подавляющего большинства больных должна составлять длительная (обычно не менее 3 месяцев) антикоагулянтная терапия; следует отметить существенное расширение ее возможностей за последнее время с появлением новых пероральных антикоагулянтов (одной из весьма привлекательных возможностей здесь является использование дабигатрана. Использование реперфузионного лечения (тромболизис, катетерная и хирургическая эмболэктомия, инфракавальные фильтры) резервируется, главным образом, для лиц с высоким прогностическим риском (включая имеющих гипотензию / шок). Следование современным Рекомендациям международных экспертов может обеспечить существенное улучшение прогноза у лиц как с острым эпизодом ТГВ / ТЭЛА, так и у пациентов, имевших эти нарушения в анамнезе.
Литература
- Braunwld’s Heart Disease, 9th ed / R.O.Bonow, Mann D.L., ZipesP., Libby P – Elsevier, 2012. – 1961 p
- Greig S.L., McKeage K. Dabigatran Etexilate: A Review of Its Use in the Treatment of Acute Venous Thromboembolism and Prevention of Venous Thromboembolism Recurrence. Drugs. 2014; 74(15):1785-800
- Kearon C et al. Antithrombotic Therapy for VTE Disease/ Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST 2012; 141(2)(Suppl):e419S–e494S
- Konstantinides S. et al. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). European Heart Journal doi:10.1093/eurheartj/ehu283
- Opie L.H. Drugs for the heart / L. Opie, B.J. Gersh. – Elsevier, – 592 p
- Schulman S, Kearon C, Kakkar AK, et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med. 2009;361(24):2342–52.
- Schulman S, Kakkar AK, Goldhaber SZ, et al. Treatment of acute venous thromboembolism with dabigatran or warfarin and pooled analysis. Circulation. 2014;129(7):764–72.
- Schulman S, Kearon C, Kakkar AK, et al. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med. 2013;368(8):709–18.







