Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ЗНАЧЕНИЕ ФОЛАТОВ ВНЕ БЕРЕМЕННОСТИ"
Автор: Пустотина Ольга Анатольевна
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Акушерство и гинекология
Просмотров: 8 638
Дата проведения: с 01.06.2015 по 01.06.2016
 Определение фолатов
Определение фолатов
Фолаты представляют собой химические соединения на основе фолиевой кислоты и в целом составляют витамин В9. Они являются незаменимыми компонентами основных обменных процессов, важнейшие из которых – синтез нуклеотидов и репликация ДНК, обеспечивающие физиологическое деление и нормальный рост всех клеток в организме.
При дефиците фолатов процесс репликации нарушается, что в первую очередь отражается на быстропролиферирующих клетках, таких как кроветворные и эпителиальные. Повреждение кроветворных клеток приводит к нарушению гемопоэза в костном мозге с формированием мегалобластного типа кроветворения, проявлением которого является фолиеводефицитная мегалобластная анемия. В результате повреждения эпителиальных клеток ухудшается регенерация кожи и слизистых оболочек.
Также, фолаты принимают участие в реакциях метилирования всех субстратов обмена веществ.: белков, гормонов, липидов, нейромедиаторов и др. Важнейшим субстратом для метилирования в организме является ДНК. Метилирование ДНК обеспечивает функционирование клеточного генома, регуляцию онтогенеза и клеточную дифференцировку. Также с ним связана деятельность иммунной системы, которая через реакции метилирования распознает и подавляет экспрессию чужеродных генов. Результатом дефектов метилирования становятся такие патологические состояния, как рак, атеросклероз, нейродегенеративные, аутоиммунные и аллергические заболевания.
Наряду с кроветворными и эпителиальными клетками к быстропролиферирующим относятся ткани хориона у беременной женщины, которые также высокочувствительны к негативному влиянию фолатдефицита. Расстройство работы генома эмбриональных клеток во время их деления и дифференцировки приводит к нарушению эмбриогенеза, формированию пороков развития у плода и осложненному течению беременности.
Метаболизм фолатов в организме
Фолаты не синтезируются в организме и поступают к нам с пищевыми продуктами. Наибольшее количество фолатов содержится в зеленых листовых овощах, бобовых, цитрусовых и печени животных. С ограниченным потреблением таких продуктов питания в первую очередь обусловлена высокая частота дефицита фолатов среди населения, который выявляется почти у 90% популяции.
Для восполнения дефицита фолатов с 1998 г. в США, Австралии и многих Европейских странах проводятся программы фортификации продуктов питания фолиевой кислотой (хлеб, мука, макаронные изделия) из расчета ежедневного дополнительного ее приема около 100 мкг.
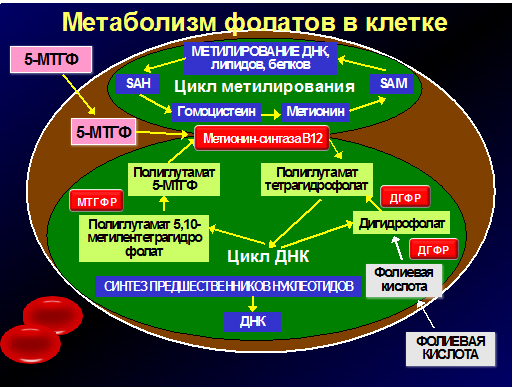
Фолиевая кислота, потребляемая населением в процессе фортификации продуктов питания, а также большинство пищевых фолатов являются биологически не активными. Всасывается из кишечника в систему кровообращения и затем потребляется клетками только одна форма фолиевой кислоты – моноглутамат 5-метилтетрагидрофолат (5-МТГФ) (рис.1). Остальные формы фолатов представляют собой полиглутаматы, которые при всасывании из кишечника в кровь, под воздействием фермента МТГФР тоже превращаются в моноглутамат 5-МТГФ. 5-МТГФ поступает в клетки организма и участвует в биологических процессах: циклах клеточной репликации и метилирования (рис.2).
Цикл метилирования включает трансформацию аминокислоты метионин, поступающей в организм с продуктами животного происхождения (мясом, молоком и яйцами), в S-аденозилметионин и, затем, гомоцистеин. S-аденозилметионин является донором метила для всех клеточных метилтрансфераз, метилирующих различные субстраты (ДНК, белки, липиды, ферменты и т.д.). После потери метильной группы он преобразуется в гомоцистеин, часть которого метаболизируется при участии В6-зависимого фермента цистатионинсинтазы и выводится почками, а часть повторно метилируется и превращается в метионин, что ведет к возобновлению клеточного цикла метилирования. Повторное метилирование гомоцистеина происходит за счет метильных групп поступившего в клетки моноглутамата 5-МТГФ, которые транспортируются с помощью В12-зависимого фермента метионинсинтазы. Таким образом фолаты обеспечивают постоянное снабжение метильными группами циклы метилирования.
После участия в цикле метилирования 5-МТГФ вновь превращается в полиглутаматы фолиевой кислоты. Полиглутаматы участвуют в другом не менее важном процессе обмена веществ: обеспечивают цикл синтеза нуклеотдов и репликацию ДНК, что позволяет клеткам делиться. В результате данных реакций образуются промежуточные формы фолиевой кислоты – полиглутамат дигидрофолат и 5,10-метилентетрагидрофолат. Дигидрофолаты с помощью фермента дегидрофолатредуктазы (ДГФР) обратно превращаются в полиглутаматы тетрагидрофолатов и вновь используются в синтезе предшественников нуклеотидов для образования ДНК и клеточного деления. 5,10-метилентетрагидрофолаты под воздействием фермента МТГФР повторно превращаются в активный моноглутамат 5-МТГФ, который вместе с поступившим из крови 5-МТГФ используется для повторного метилирования гомоцистеина в метионин и участия последнего в циклах метилирования.
Дефицит фолатов, гипергомоцистеинемия и риск сердечно-сосудистых заболеваний
Гомоцистеин – это аминокислота, которая образуется в организме из метионина в результате участия последнего в реакциях метилирования. В то же время, он является субстратом для возобновления цикла метилирования, превращаясь повторно в метионин с помощью переноса от фолатов новых метильных групп.
При недостатке фолатов нарушается процесс реметилирования гомоцистеина и происходит его накопление в организме. В последние годы стало очевидным, что любое увеличение уровня гомоцистеина в крови вызывает повышение риска тромбофилических осложнений, таких как инфаркт миокарда, инсульт и венозная тромбоэмболия. При этом непосредственного участия в деятельности свертывающей системы крови гомоцистеин не принимает и его эффект осуществляется опосредованно. Гипергомоцистеинемия вызывает повреждение сосудистого эндотелия, что активирует факторы свертывающей системы крови и приводит к повышению тромбообразования, в то время как деятельность антисвертывающего звена гемостаза ухудшается. Кроме того, в местах повреждения сосудистой стенки происходит отложение холестерина, кальция и продуктов распада клеток с образованием атеросклеротических бляшек, в результате которых просвет сосудов сужается, приводя к нарушениям кровообращения и развитию ишемической болезни сердца. Таким образом гипергомоцистеинемия является доказанным независимым фактором риска сердечно-сосудистых заболеваний.
Нижний уровень содержания гомоцистеина в сыворотке крови составляет 5 мкмоль/л, тогда как верхний предел варьирует между 10 и 20?мкмоль/л в зависимости от возраста, пола, этнической группы и особенностей потребления фолатов. В ряде крупномасштабных исследований показано, что при сывороточной концентрации гомоцистеина ? 10 мкмоль/л отмечается значительное увеличение риска развития ишемической болезни сердца, инсульта, инфаркта, а также злокачественных новообразований. Повышение уровня гомоцистеина крови всего на 5 мкмоль/л приводит к увеличению риска атеросклеротического поражения сосудов на 80%, острого инфаркта и инсульта – на 50%. Наряду с этим значительно повышается показатель общей смертности, включающий смертность как от сердечно-сосудистых заболеваний, так и не связанных с ними причин, в том числе злокачественных новообразований.
Гипергомоцистеинемия относится к смешанной форме тромбофилии, потому что может быть приобретенной и наследственной. Приобретенная гипергомоцистеинемия возникает при недостаточном потреблении пищевых продуктов, богатых фолиевой кислотой, а также при нарушении всасывания фолатов в кровь на фоне заболеваний кишечника. Алкоголизм, курение, применение ряда лекарственных средств (противосудорожные, гормональные контрацептивы, барбитураты, сульфаниламиды, противоопухолевые), гипотиреоз, сахарный диабет могут также приводить к дефициту фолатов и развитию гипергомоцистеинемии. Накопление сывороточного гомоцистеина может быть следствием нарушения его выведения при заболеваниях почек.
Немаловажную роль в метаболизме гомоцистеина также играют ферменты фолатного цикла: МТГФР, метионинсинтаза и цистатионинсинтаза. Они обеспечивают как реметилирование гомоцистеина и превращение в метионин, так и удаление его избытка через мочевыделительную систему. Функционирование метиленсинтазы и цистотионинсинтазы зависит от количества поступающих в организм витаминов В12 и В6. Также встречается наследственная недостаточность ферментов, возникающая в результате полиморфизмов в их геноме.
Наиболее частой причиной наследственной гипергомоцистеинемии является полиморфизм гена фермента МТГФР. МТГФР – это основной фермент метаболизма фолатов. Он преобразует все неактивные формы фолатов, как поступившие в организм, в том числе синтетическую фолиевую кислоту в таблетках, так и находящиеся в клетках, в биологически активный 5-МТГФ (рис.2). Нарушение функции данного фермента, которая при гомозиготной форме полиморфизма снижается на 75% от исходной и при гетерозиготной – на 30%, ведет к резкому снижению образования активных фолатов и развитию фолатдефицита. Женщины с полиморфизмом гена МТГФР относятся к группе высокого риска по развитию сердечно-сосудистых заболеваний.
Было установлено, что регулярный прием фолиевой кислоты (в дозе около 200 мкг/сут) достоверно снижает уровень гомоцистеина в крови и сокращает смертность от сердечно-сосудистых заболеваний. В ретроспективном когортном исследовании у 5056 пациентов с ишемической болезнью сердца был проанализирован уровень фолатов в крови с показателем смертности от инфарктов миокарда. Была выявлена достоверная обратная корреляция между сывороточной концентрацией фолатов и смертностью от инфарктов миокарда. Появилась отчетливая тенденция снижения частоты госпитализации по причине острого инфаркта миокарда в странах, реализующих программу фортификации фолатами пищевых продуктов.
На протяжении последних десятилетий частота острого инсульта снижается во всех странах. Но сравнение степени снижения данного показателя в США и Канаде в период 1990-2002 гг., применяющие программы фортификации пищевых продуктов, с аналогичным показателем в Великобритании, где фортификация не является обязательной, показало более значительные темпы снижения частоты инсультов в странах с обязательной фортификацией продуктов питания. Метаанализ, опубликованный в 2012 г., объединивший результаты обследования 59 тысяч пациентов, показал снижение риска инсульта при приеме фолиевой кислоты.
В то же время, метаанализ 8 исследований с участием 37485 пациентов заключил, что прием фолиевой кислоты в течение 5 лет оказал незначительный эффект на частоту инфарктов и инсультов. Более того, метаанализ, проведенный Wang с соавт. в 2007 г., не выявил протективный эффект фолатов в отношении развития инсульта. В противоположность данным выводам, касающихся приема фолиевой кислоты, авторы продемонстрировала эффект комбинированного применения витаминов группы В (фолиевой кислоты, витаминов В6 и В12), которое снизило риск инсульта на 18%.
Дефицит фолатов и онкологические заболевания
При недостатке фолатов в организме нарушается репликация и дифференцировка эпителиальных клеток, что сопровождается ухудшением регенерации кожи и слизистых оболочек. Кроме того, при дефиците фолатов происходит повреждение генома быстропролиферирующих клеток и повышается риск злокачественных заболеваний. Причем геном раковых клеток становится более чувствительным к нарушению метаболизма фолатов, чем геном нормальных клеток.
Гипергомоцистеинемия является независимым фактором риска активации канцерогенеза. Проведенные иммунологические и биохимические исследования показали, что недостаток фолатов способствует не только накоплению токсичного гомоцистеина, но и снижает Т-клеточную иммунную противораковую резистентность.
В последние годы появились публикации о связи фолатдефицита со злокачественными заболеваниями. Наиболее часто прослеживают связь с риском возникновения колоректального рака и раком молочной железы. Нарушение клеточной репликации и метилирования ДНК способствует развитию раковых и предраковых состояний шейки матки. У женщин с ВПЧ-инфекцией и низкой концентрацией фолиевой кислоты и витамина В12 в крови риск CIN на 70% превышал таковой у женщин с нормальной концентрацией фолатов.
Сравнительный метаанализ 12523 случаев злокачественных заболеваний различной локализации в период 1991-2009 гг. в Италии и Швейцарии в сравнении с 22828 случаями контроля показал, что потребление пищевых продуктов, содержащих 100 мкг фолатов в сутки, значительно снижает риск любых злокачественных заболеваний: пищевода, гортани, желудка, колоректального рака, поджелудочной железы, трахеи, молочной железы, эндометрия, яичников, почек и простаты.
В то время как для приема синтетической фолиевой кислоты были получены неоднозначные выводы. В результате эпидемиологических и клинических исследований и результатов внедрения программ фортификации пищевых продуктов синтетической фолиевой кислотой была выявлена двунаправленная связь между приемом фолиевой кислоты, уровнем фолатов в крови и онкологическими заболеваниями. Было установлено, что онкологический риск повышается как при дефиците фолатов, так и при передозировке синтетической фолиевой кислоты. Применение синтетической фолиевой кислоты в количестве более 400 мкг в сут было ассоциировано с достоверным увеличением риска злокачественных заболеваний, таких как рак молочных желез, колоректальный рак, рак легких, простаты и яичников.
Дефицит фолатов и невропатия
Одним из проявлений дефицита фолатов является невропатия. Она возникает в результате повреждения оболочки нервных окончаний и нарушения проводимости по ним нервных импульсов по причине сбоя метилирования ее основного белка миелина.
Еще в 1963 г. H.Gough и соавт. выявили ассоциацию низкой концентрации фолатов с тревогой и депрессией. В настоящее время доказано, что дефицит фолатов имеют более трети больных с депрессией, при этом тяжесть заболевания и эффективность лечения антидепрессантами обратно коррелирует с уровнем фолатов в эритроцитах. В популяционных исследованиях было продемонстрировано, что при адекватном потреблении фолатов с пищей, а также в результате фортификации пищи фолатами распространенность депрессии снижается.
В последние годы стала очевидной связь недостатка фолатов с развитием шизофрении и аутизма. Одной из основных теорий развития данных заболеваний является врожденная мальформация (малые пороки развития) нервной системы. Результаты 40-летнего исследования «Пренатальные факторы риска шизофрении», проведенного в США, показало, что высокий уровень гомоцистеина во время беременности в 2 раза повышает риск развития у ребенка шизофрении и аутизма.
Дефицит фолатов и возрастные изменения
В ряде исследований была показана ассоциация высокого уровня гомоцистеина в крови с дегенеративными изменениями сосудов глаза и ухудшением зрения у людей пожилого возраста. Ежедневное применение фолиевой кислоты в сочетании с витаминами В6 и В12 у 5000 пациентов на протяжении 7 лет показало снижение на 34% риска развития данных осложнений.
Низкий фолатный статус коррелирует со снижением слуха, особенно в пожилом возрасте. Исследование, проведенное в Нидерландах, показало улучшение слуха при дотации фолиевой кислоты (800 мкг/сут) у 700 пожилых пациентов.
В последние десятилетия во многих исследованиях описана взаимосвязь между снижением уровня фолатов, низким потреблением фолатов и когнитивными расстройствами у пожилых людей. Систематический обзор ретроспективных исследований, опубликованный в 2009 г., показал, что гипергомоцистеинемия увеличивает риск болезни Альцгеймера и старческого слабоумия.
Применение добавок фолиевой кислоты в количестве 800 мкг/сут на 26% снижает уровень гомоцистеина в крови в сравнении с плацебо и снижает уровень когнитивных расстройств. При сочетанном применении фолиевой кислоты с витаминами В6 и В12 у пациентов страдающих когнитивными расстройствами и гипергомоцистеинемией снижение сывороточной концентрации гомоцистеина произошло более значимо (на 32%) и на 53% замедлилось прогрессирование когнитивных расстройств по сравнению с плацебо.
Дефицит фолатов и анемия
С дефицитом фолатов традиционно связывают развитие анемии. Снижение уровня гемоглобина и эритроцитов происходит в результате нарушения кроветворения в костном мозге. Для нормального эритропоэза необходимо достаточное количество фолатов, витамина В12 и железа. Дефицит фолатов и/или витамина В12 приводит к нарушению деления кроветворных клеток, что сопровождается заменой нормобластного типа кроветворения на мегалобластный, при котором уменьшается количество клеток крови, увеличивается их объем и снижается функциональная активность.
Назначение синтетической фолиевой кислоты может значительно повысить уровень гемоглобина и эритроцитов в крови, но при условии нормального функционирования ферментов, отвечающих за метаболизм фолатного цикла. В случаях полимормизма в генах МТГФР и/или метионинсинтазы эффективность такой тактики значительно ниже.
Кроме того, назначение синтетической фолиевой кислоты маскирует недостаточность витамина В12, характерного для пернициозной анемии. С витамином В12 связана деятельность фермента метионинсинтазы, отвечающего за перенос метильной группы фолатов в циклы метилирования. Наиболее серьезным последствием этого является повреждение метилирование миелина – белка, обеспечивающего проводимость нервных импульсов. Синтетические фолаты приводят к восстановлению нормального гемопоэза и лечению анемии, но восстановление процессов метилирования не происходит. В результате происходит необратимое разрушение миелина и быстрое прогрессирование неврологической симптоматики: от депрессии к когнитивным расстройствам и болезни Альцгеймера.
Анемия, ассоциированная с дефицитом витамина В12, встречается у 20% взрослых людей и более часто у вегетарианцев, беременных и новорожденных детей. Количество людей с низким сывороточным уровнем витамина В12 в результате программ фортификации увеличилось на 70-87%. Обследование 1500 пожилых людей в США показало, что высокий сывороточный уровень фолатов на фоне потребления фортифицированных продуктов сочетался с низким уровнем витамина В12 и имел наивысший риск развития анемии и когнитивных нарушений.
Фолиевая кислота и метафолин
В результате полученных данных о неблагоприятных эффектах потребления высоких доз синтетической фолиевой кислоты отношение к дотации фолатов по принципу «много не бывает» в настоящее время считается спорным. Суточная потребность в фолатах составляет всего 400 мкг или 0,4 мг.
Кроме того, в связи с широкой распространенностью генетических полиморфизмов ферментов фолатного цикла эффективность назначения синтетической фолиевой кислоты не достаточная. Синтетическая фолиевая кислота также, как и большинство пищевых фолатов, является биологически не активной и только с помощью фермента МТГФР может превратиться в активный моноглутамат 5-МТГФ (рис.1, 2). Но, в отличие от пищевых фолатов, синтетическая фолиевая кислота в неметаболизированном виде также может поступать в системный кровоток и захватываться клетками. Появление неметаболизированной формы в крови происходит уже при суточном потреблении фолиевой кислоты более 200 мкг, что обусловлено ограниченными возможностями ферментативной системы слизистой оболочки кишечника. Поступающая в клетки синтетическая фолиевая кислота блокирует рецепторы и ферменты с которыми взаимодействуют эндогенные фолаты, которые в результате не могут реализовать свои эффекты. Видимо этим и обусловлено развитие неблагоприятных побочных эффектов при дотации высоких доз фолиевой кислоты.
Так, при высокой концентрации неметаболизированной фолиевой кислоты в сыворотке крови в результате потребления фортифицированных продуктов ингибируется активность натуральных киллеров – NK-клеток. NK-клетки являются важным компонентом неспецифического иммунного ответа, ограничивающего активность инфекционных агентов и опухолевых клеток.
В других исследованиях было показано увеличение когнитивных расстройств у пожилых людей при потреблении фолиевой кислоты более 400 мкг/сут. В когортном исследовании результатов программы фортификации было показано, что у каждого третьего пожилого американца в сыворотке крови обнаруживается неметаболизированная фолиевая кислота, которая была ассоциирована с повышением анемии и неудовлетворительными тестами когнитивных способностей в сочетании с низким уровнем витамина В12. Авторы пришли к выводы, что неметаболизированная фолиевая кислота в сыворотке крови может оказывать негативное влияние на деятельность нервной системы.
В отличие от нее, другая форма фолиевой кислоты – 5-МТГФ (L-метилфолата) или метафолин – является биологически активной и всасывается в кровь без участия ферментативных систем кишечника, в том числе фермента МТГФР. Она непосредственно захватывается клетками и используется в обменных процессах – репликации ДНК и циклах метилирования (рис.1, 2). При исследовании уровня фолатов в эритроцитах крови у женщин с полиморфизмом гена МТГФР с различным типом наследования показано, что метафолин значительно в большей степени повышает их содержание, чем фолиевая кислота, кроме того метафолин более значимо снижает уровень гомоцистеина.
Биологически активная форма фолиевой кислоты метафолин содержится в препарате Фемибион. В его состав входит всего 400 мкг фолатов, половина из которых представлена фолиевой кислотой и половина – биологически активным метафолином. Кроме того, в нем имеются другие представители витаминов группы В, в том числе В6 и В12, необходимые для деятельности ферментов, обеспечивающих метаболизм фолатов в организме, а также витамины С, Е, РР и йод.
Являясь поливитаминно-минеральным комплексом Фемибион выгодно отличается от большинства других представителей данной группы пищевых добавок. Фемибион оказывает ощутимо меньшую нагрузку на печень и ЖКТ за счет количества компонентов в своем составе, которое на 2/3 меньше, чем в обычной поливитаминной таблетке. Кроме того, содержание большинства витаминов и минералов не превышает 50-75% от суточной потребности, что в сочетании с пищевым поступлением, не приводит к избытку витаминов в организме, не менее опасному, чем их недостаток.
Заключение
Фолаты играют незаменимую роль в организме: участвуют в клеточной репликации и дифференцировке, обеспечивают метилирование всех субстратов обмена веществ. При этом у 9 из 10 человек в популяции имеется дефицит фолатов, который связан как с недостаточным потреблением пищевых продуктов, содержащих фолиевую кислоту, так и в следствие нарушения образования активных фолатов при полиморфизме ферментов фолатного цикла.
При наличии генетического полиморфизма генов фолатного цикла, наиболее частый из которых полиморфизм МТГФР, патогенетически обоснованным является применение поливитаминно-минерального комплекса Фемибион, в состав которого входит кроме 200 мкг фолиевой кислоты, 200 мкг активного фолата – метафолина, а также другие представители витаминов группы, необходимые для обеспечения активности ферментов фолатного цикла и реализации функции фолатов в организме.
Рис 1.
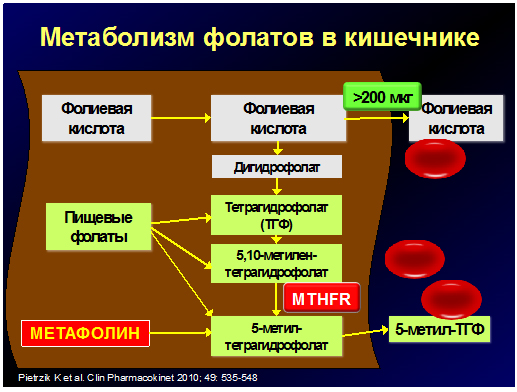
Рис.2
Список литературы:
1. Bailey RL, McDowell MA, Dodd KW et al. Total folate and folic acid intakes from foods and dietary supplements of US children aged 1-13 y. Am J Clin Nutr 2010; 92: 353-8.
2. Bailey RL, Mills JL, Yetley EA, et al. Unmetabolized serum folic acid and its relation to folic acid intake from diet and supplements in a nationally representative sample of adults aged > or =60 y in the United States. Am J Clin Nutr 2010; 92: 383-9.
3. Bekkers MB, Elstgeest LE, Scholtens S, et al. Maternal use of folic acid supplements during pregnancy and childhood respiratory health and atopy: the PIAMA birth cohort study. Eur Respir J 2011.
4. Bentley S, Hermes A, Phillips D, et al. Comparative effectiveness of a prenatal medical food to prenatal vitamins on hemoglobin levels and adverse outcomes: a retrospective analysis. Clin Therapeut 2011;33:204–210.
5. Christen WG, Glynn RJ, Chew EY et al. Folic acid, pyridoxine, and cyanocobalamin combination treatment and age-related macular degeneration in women: the Women’s Antioxidant and Folic Acid Cardiovascular Study. Arch Intern Med 2009; 169: 335-41.
6. Clarke R, Halsey J, Lewington S, et al. Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer, and cause-specific mortality: Meta-analysis of 8 randomized trials involving 37 485 individuals. Arch Intern Med 2010; 170: 1622-31.
7. Cotlarciuc I, Andrew T, Dew T, et al. The basis of differential responses to folic acid supplementation. J Nutrigenet Nutrigenomics 2011; 4: 99-109.
8. Crider KS, Bailey LB, Berry RJ. Folic acid fortification – its history, effect, concerns, and future directions. Nutrients 2011; 3: 370-84.
9. Crider KS, Yang TP, Berry RJ, Bailey LB. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate’s role. Adv Nutr. 2012;3(1):21–38.
10. Durga J, van Boxtel MP, Schouten EG, et al. Effect of 3-year folic acid supplementation on cognitive function in older adults in the FACIT trial: a randomised, double blind, controlled trial. Lancet 2007; 369: 208-16.
11. Duthie SJ. Folat and cancer: how DNA damage, repair and methylation impact on colon carcinogenesis. J Inherit Metab Dis. 2011;34:101-109.
12. EFSA. ESCO Report on Analysis of Risks and Benefits of Fortification of Food with Folic Acid. 2009
13. FIGO Working Group on Best Practice in Maternal–Fetal Medicine International Journal of Gynecology and Obstetrics 2015; 128: 80–82
14. Gibson TM, Weinstein SJ, Pfeiffer RM, et al. Pre- and postfortification intake of folate and risk of colorectal cancer in a large prospective cohort study in the United States. Am J Clin Nutr 2011.
15. Haberg SE, London SJ, Nafstad P, et al. Maternal folate levels in pregnancy and asthma in children at age 3 years. J Allergy Clin Immunol 2011; 127: 262-4, 4 e1.
16. Haberg SE, London SJ, Stigum H, qt al. Folic acid supplements in pregnancy and early childhood respiratory health. Arch Dis Child 2009; 94: 180-4.
17. Kalmbach RD, Choumenkovitch SF, Troen AP, et al. A 19-base pair deletion polymorphism in dihydrofolate reductase is associated with increased unmetabolized folic acid in plasma and decreased red blood cell folate. J Nutr 2008; 138: 2323-7.
18. Kidd PM. Alzheimer’s disease, amnestic mild cognitive impairment, and age–associated memory impairment: current understanding and progress toward integrative prevention. Altern Med Rev. 2008;13:85–115.
19. Kim YI. Folate and colorectal cancer: an evidence-based critical review. Mol Nutr Food Res. 2007;51(3):267–292.
20. Lamers Y, Prinz-Langenohl R, Bramswig S, Pietrzik K. Red blood cell folate concentrations increase more after supplementation with [6S]-5-methyltetrahydrofolate than with folic acid in women of childbearing age. Am J Clin Nutr. 2006;84(1):156–161.
21. Magdelijns FJ, Mommers M, Penders J, et al. Folic Acid use in pregnancy and the development of atopy, asthma, and lung function in childhood. Pediatrics 2011; 128: e135-44.
22. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Circulating unmetabolized folic acid and 5-methyltetrahydrofolate in relation to anemia, macrocytosis, and cognitive test performance in American seniors. Am J Clin Nutr 2010; 91: 1733-44.
23. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Circulating unmetabolized folic acid and 5-methyltetrahydrofolate in relation to anemia, macrocytosis, and cognitive test performance in American seniors. Am J Clin Nutr. 2010;91:1733–1744.
24. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Folate and vitamin B-12 status in relation to anemia, macrocytosis, and cognitive impairment in older Americans in the age of folic acid fortification. Am J Clin Nutr 2007; 85: 193- 200.
25. National Heart, Lung and Blood Institute,. Morbidity and mortality: 2009 chart book on cardiovascular, lung, and blood diseases. 2009
26. Pietrzik K, Bailey L, Shane B. Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin Pharmacok. 2010;49(8):535–548.
27. Piyathilake CJ, Macaluso M, Alvarez RD, et al. Lower risk of cervical intraepithelial neoplasia in women with high plasma folate and sufficient vitamin B12 in the post-folic acid fortification era. Cancer Prev Res (Phila) 2009; 2: 658-64.
28. Prinz-Langenohl R, Bramswig S, Tobolski O, et al. (6S)-5-methyltetrahydrofolate increases plasma folate more effectively than folic acid in women with the homozygous or wild-type 677C,T polymorphism of methylenetetrahydrofolate reductase. Br J Pharmacol 2009;158:2014-2021.
29. Sauer J, Mason JB, Choi SW. Too much folate: a risk factor for cancer and cardiovascular disease? Curr Opin Clin Nutr Metab Care. 2009;12(1):30-36.
30. Smith AD, Smith SM, de Jager CA, et al. Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment. A randomized controlled trial. PLoS ONE 2010; 5: e12244.
31. Troen AM, Mitchell B, Sorensen B, et al. Unmetabolized folic acid in plasma is associated with reduced natural killer cell cytotoxicity among postmenopausal women. J Nutr 2006; 136: 189-94.
32. Tu JV, Nardi L, Fang J, et al. National trends in rates of death and hospital admissions related to acute myocardial infarction, heart failure and stroke, 1994-2004. CMAJ 2009; 180: E118-25.
33. Van Guelpen B. Folate in colorectal cancer, prostate cancer and cardiovascular disease. Scand J Clin Lab Invest. 2007;67(5):459-447.
34. Vogel S, Meyer K, Fredriksen A, et al. Serum folate and vitamin B12 concentrations in relation to prostate cancer risk – a Norwegian population?based nested case?control study of 3000 cases and 3000 controls within the JANUS cohort. Int J Epidemiol. 2013;42(1):201–210.
35. Wien TN, Pike E, Wisloff T, et al. Cancer risk with folic acid supplements: a systematic review and meta-analysis. BMJ Open 2012; 2: e000653.
36. Wong Y, Almenda OP, McCaul KA, et al. Homocysteine, Frailty, and All-Cause Mortality in Older Men: The Health in Men Study. J Gerontol A Biol
37. Wyckoff KF, Ganji V. Proportion of individuals with low serum vitamin B-12 concentrations without macrocytosis is higher in the post folic acid fortification period than in the pre folic acid fortification period. Am J Clin Nutr 2007; 86: 1187-92.
38. Xiao Y, Zhang Y, Wang M, et al. Plasma S-adenosylhomocysteine is associated with the risk of cardiovascular events in patients undergoing coronary angiography: a cohort study. Am J Clin Nutr November. 2013;98:1162-1169.
39. Yang IV, Schwartz DA. Epigenetic mechanisms and the development of asthma // J Allergy Clin Immunol. 2012;130(6):1243–1255.
40. Yang Q, Botto LD, Erickson JD, et al. Improvement in stroke mortality in Canada and the United States, 1990 to 2002. Circulation 2006; 113:1335-43.







