Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Иммуномодуляторы в клинической практике педиатра"
Автор: В.А. Булгакова
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Педиатрия/Неонатология, Семейная медицина/Терапия
Просмотров: 3 997
Дата проведения: с 09.10.2014 по 09.10.2015
Актуальность. Современная патология характеризуется наличием двух взаимосвязанных и взаимообусловленных процессов: ростом числа хронических инфекционных заболеваний, вызываемых условно-патогенными или оппортунистическими микроорганизмами, и снижением иммунологической резистентности населения, наблюдаемых практически во всех развитых странах. Сегодня известно, что развитие и течение многих патологических процессов, в том числе инфекционно-воспалительного, сопровождается нарушениями функционирования иммунной системы организма. В то же время все чаще традиционное этиотропное лечение инфекционных болезней усложняется развитием устойчивости патогенов к противомикробным терапевтическим средствам. В связи с этим все более широкое применение в клинической практике получают методы терапии, основанные на модуляции иммунного ответа.
Современная стратегия иммуномодулирующей терапии базируется на результатах исследования различных способов, с помощью которых иммунная система уничтожает постоянно проникающие в организм чужеродные антигены (патогены и аллергены) или возникающие в нем опухолевые клетки – для этого она обладает сложнейшим набором постоянно взаимодействующих неспецифических (врожденных) и специфических (приобретенных) механизмов.
Главные компоненты неспецифического иммунитета – фагоциты: нейтрофилы, моноциты (в крови) и макрофаги (в тканях), альвеолярные макрофаги (в легких), купферовы клетки (в синусах печени), синовиальные клетки (в суставных полостях), мезангиальные фагоциты (в почках) и т.д., основная функция которых – захватывать и переваривать проникающие извне микроорганизмы. К факторам врожденного иммунитета относятся также белки комплемента, белки острой фазы и цитокины.
Специфический иммунитет приобретается в результате контакта организма с антигеном – «диким» (возбудителем заболевания) или «ослабленным» (входящим в состав вакцин) – и характеризуется формированием иммунологической памяти. Его клеточными носителями являются лимфоциты, а гуморальными – иммуноглобулины.
Иммуномодулирующая терапия – терапевтическая стратегия, основанная на модуляции иммунного ответа, обладает рядом преимуществ перед традиционным антимикробным лечением. Иммуномодулирующая терапия, не оказывая непосредственного воздействия на патоген, не вызывает развития множественной лекарственной устойчивости среди микробов. Благодаря этому применение иммуномодуляторов в клинической практике может стать возможным решением стремительного распространения антимикробной резистентности. Кроме того, иммуномодулирующая терапия позволяет значительно расширить подходы к терапии пациентов с иммунными расстройствами, у которых проведение антибактериальной терапии и вакцинации часто оказываются недостаточно эффективными. Наконец, иммуномодуляторы, обладая потенциально широким спектром активности в отношении вирусов, бактерий, грибов и простейших, могут использоваться в качестве неспецифической неотложной терапии и профилактики при появлении нового возбудителя или биологической атаке.
Методы иммуномодуляции можно разделить на специфические и неспецифические, активные и пассивные (рис. 1).

Рисунок 1. Методы иммуномодуляции
Конечная цель активной специфической иммунотерапии, к которой относится вакцинация, заключается в формировании адаптивного иммунного ответа. Главной проблемой при разработке эффективных методов в этом направлении является требование к сохранности иммунной системы пациента (т.е. отсутствие иммунодефицита). Неспецифическая иммунотерапия менее селективна по сравнению со специфической. Ее цель – активировать работу всей иммунной системы с расчетом на усиление, в том числе и иммунитета против конкретного антигена (патогена). Основными недостатками данного подхода являются кроме требования, как и в предыдущем случае, к иммунной системе ее способности к адекватному ответу на стимулятор, также и проблема возможной «распыленности» этого ответа, что может привести к неэффективному расходованию ресурсов иммунной системы и преждевременному ее истощению.
Иммуномодуляторы – лекарственные препараты, в терапевтических дозах восстанавливающие нарушенные функции иммунной системы, которые применяются с целью:
– повышения эффективности этиотропной противоинфекционной терапии;
– увеличения длительности ремиссии и снижения частоты обострений (и госпитализаций) при хронических рецидивирующих инфекционно-воспалительных заболеваниях;
– предупреждения развития инфекционных осложнений у лиц групп риска по развитию вторичной иммунной недостаточности;
– нормализации нарушенных параметров иммунного статуса при возможности его мониторинга.
В настоящее время в клинической практике используются 3 основные группы иммуномодуляторов: экзогенные, эндогенные и химически чистые (синтетические). К экзогенной группе относятся препараты микробного или растительного происхождения, нуклеиновые кислоты и др. К эндогенным препаратам относятся цитокины и иммунорегуляторные пептиды. В группу иммуномодуляторов цитокиновой природы входят, например, интерфероны, интерлейкины, колониестимулирующий фактор. К иммунорегуляторным пептидам принадлежат препараты тимического и костномозгового происхождения. Одним из наиболее эффективных и безопасных направлений клинического применения считается использование химически чистых (синтетических) иммуномодуляторов, среди которых выделяют низкомолекулярные и высокомолекулярные соединения (рис. 2).
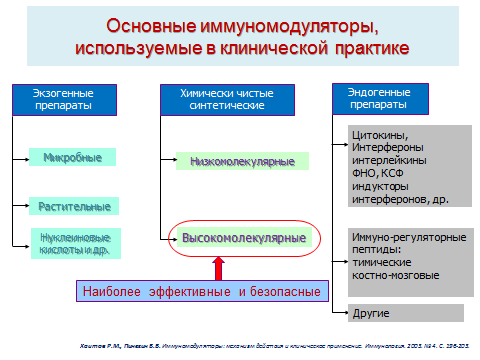
Рисунок 2. Классификация иммуномодуляторов
Принципы назначения иммуномодуляторов. Все имеющиеся к сегодняшнему дню в медицинской литературе положения о принципах назначения иммуномодулирующей терапии в клинической практике носят лишь рекомендательный характер и требуют обязательной коррекции у каждого конкретного пациента с учетом многих факторов (возраста, сопутствующих патологических состояний и их тяжести, особенностей проводимой базисной терапии основного заболевания и многие другие).
При назначении иммуномодуляторов учитывают общие принципы концепции рационального использования лекарств, согласно которой каждый пациент имеет право на проведение фармакотерапии, адекватной его клиническому состоянию; в дозах, соответствующих индивидуальным особенностям больного; в течение должного периода времени и по самой низкой цене.
Необходимыми качествами приемлемости препарата являются его доказанная эффективность и безопасность, отсутствие привыкания к нему, отсутствие побочных и канцерогенных эффектов, предсказуемость схемы метаболизма и пути выведения из организма, известная совместимость с другими препаратами, используемыми в комплексной терапии.
Иммуномодуляторы не должны вызывать чрезмерную сенсибилизацию и индукцию иммунопатологических реакций, а также потенцировать ее у других медикаментов.
Предпочтительным качеством считается легкость доставки препарата в область назначения и возможность энтерального пути введения.
Иммуномодуляторы в комплексной терапии инфекционно-воспалительных болезней у детей. Одна из основных проблем практической педиатрии – инфекционно-воспалительные болезни, в частности острые респираторные инфекции. Это связано с незрелостью иммунной системы у детей, так как анатомическое и функциональное формирование противоинфекционной защиты организма ребенка происходит постепенно. Поэтому дети, особенно дошкольного и младшего школьного возраста, составляют группу высокого риска в отношении инфекционных заболеваний. У них может быть нарушена элиминация чужеродных антигенов любого происхождения, повышена заболеваемость и может развиться торпидность к проводимой терапии. В этой ситуации врачи нередко переоценивают возможную роль антибактериальной терапии инфекционно-воспалительных заболеваний и назначают антибиотики чаще, чем это необходимо. Так, например, при респираторных заболеваниях (у 90–95% больных вызваны вирусами) антибиотики в настоящее время могут назначать 70–80% пациентов. Такое необоснованное назначение антибактериальных препаратов при вирусных острых респираторных заболеваниях (ОРЗ) – причина многих серьезных побочных эффектов: формирования лекарственной аллергии и псевдоаллергии к антибиотикам, развития устойчивых штаммов пневмотропных бактерий, нарушения микрофлоры кишечника, повышения затрат на лечение и др. Одна из наиболее уязвимых по этой причине групп детей – часто болеющие дети.
Часто болеющие дети (ЧБД) – это группа детей, выделяемая при диспансерном наблюдении, характеризующаяся более высоким, чем их сверстники, уровнем заболеваемости острыми респираторными инфекциями: для детей в возрасте 2-3 лет – 6 и более раз в год, 4 лет – 5 и более, 5-6 лет – 4 и более, 7-8 лет – 3 и более раз в год. У детей в возрасте старше 3 лет в качестве критерия включения в группу ЧБД предлагается также использовать инфекционный индекс (ИИ), определяемый как соотношение суммы случаев ОРИ в течение года к возрасту ребенка.
Термин ЧБД был предложен еще в середине 80-х годов прошлого столетия, когда с целью рациональной организации реабилитационных мероприятий в педиатрической службе сочли целесообразным выделить склонных к повышенной заболеваемости острой респираторной инфекцией детей в особую категорию диспансерного наблюдения. Установлено, что частые респираторные инфекции способствуют снижению иммунорезистентности организма, срыву компенсаторно-адаптационных механизмов, нарушениям функционального состояния организма (особенно органов дыхания, желудочно-кишечного такта, вегетативной нервной системы) и раннему развитию хронической патологии. Однако и в настоящее время активно обсуждаются как вопросы терминологии, так и зачастую формального подхода при отборе детей в группу ЧБД. Формальный подход при отборе детей в группу ЧБД определяет высокую вероятность диагностических ошибок. В результате этого нередко имеет место позднее выявление патологических состояний, требующих целенаправленной и/или специфической терапии (хронический тонзиллит, рецидивирующий аденоидит, аллергический ринит, бронхиальная астма и др.). Опубликованные проф. Заплатниковым А.Л. и соавт. (2007) результаты обследования 2436 ЧБД дошкольного возраста свидетельствуют, что в 65,4% случаев формальным был не только отбор в группу ЧБД, но и само диспансерное наблюдение. Так, практически у каждого 3 пациента, несмотря на длительный (1-3 года) период наблюдения в группе ЧБД, требовалось уточнения диагноза. Проведенное при этом комплексное клиническое обследование показало, что у большинства детей имела место поздняя диагностика различных заболеваний и функциональных нарушений. Среди впервые выявленной в ходе исследования патологии наиболее часто диагностировали хронические заболевания носоглотки. При этом было установлено, что 46,3% детей с рекуррентными респираторными инфекциями ранее вообще не были осмотрены врачом-оториноларингологом. Особо настораживал тот факт, что у 15,4% детей, несмотря на частые ОРИ, протекавшие с затяжным течением или с бактериальными осложнениями в виде среднего отита, гнойного ринита, также отсутствовало наблюдение у ЛОР-врача. В целом поздняя диагностика хронического тонзиллита имела место у 38,1% детей, рецидивирующего аденоидита – у 31,8%. Кроме этого в ходе исследования у 14,2% детей впервые был выявлен рецидивирующий бронхит, а у 8,1% – аллергические заболевания (аллергический ринит, бронхиальная астма). В единичных случаях впервые диагностировали и более редкую патологию (диффузный гранулематозный васкулит, иммунная нейтропения и др.). При этом во всех перечисленных случаях указанные заболевания на протяжении ряда лет ошибочно трактовались как ЧБД, что и определяло отсутствие эффекта от проводимых лечебно-реабилитационных мероприятий. В то же время было установлено, что своевременное уточнение диагноза значительно повышает эффективность оздоровительных мероприятий. Аналогичное исследование было проведено Зиновьевой Н.В. и соавт. (2007), по мнению которых формальный подход к отбору ребенка в группу ЧБД опасен тем, что в эту группу могут попадать как практически здоровые дети, так и дети с серьезными хроническими заболеваниями. В первом случае ребенок подвергается необоснованным диагностическим вмешательствам и получает эмпирическую «иммуномодулирующую» терапию, во втором – не получает необходимой патогенетической терапии в связи с отсутствием адекватного диагноза.
Неоднородность группы ЧБД обсуждается педиатрами давно, известно, что у части детей определяются признаки лимфатико-гипопластического диатеза, при детальном обследовании высока вероятность выявления аллергической патологии, могут быть обнаружены первичные иммунодефицитные состояния, пороки развития ЛОР-органов, бронхолегочной системы, муковисцидоз и др. Поэтому для своевременного и адекватного оказания помощи часто болеющему ребенку уже на самых ранних этапах наблюдения важно установить нозологические состояния и заболевания. В каждом случае для уточнения причин высокой восприимчивости к респираторным инфекциям необходимо проводить тщательный анализ семейного анамнеза, особенностей развития ребенка, клинических проявлений переносимых заболеваний, данных лабораторного и инструментального обследования, так как своевременное выявление основного заболевания позволяет обеспечить его эффективное лечение.
Выделение группы часто болеющих детей для диспансерного наблюдения чаще берет свое начало на втором году жизни. Проводимые исследования показали, что иммунная система у детей подвержена онтогенетической последовательности «созревания» различных иммунных факторов. В основном она завершается к 12-14 годам и к этому возрасту количественные и функциональные характеристики иммунитета соответствуют показателям у взрослых. Характерной особенностью функции иммунной системы детей 2-6 лет является высокая пролиферативная активность лимфоцитов, при этом фракция недифференцированных, «наивных» лимфоцитов у детей больше, чем у взрослых. Характерен и более высокий уровень клеточной цитотоксичности. Кроме того, именно в этом возрасте происходит переориентация иммунного ответа на инфекционные антигены с превалирования Th2-лимфоцитарного ответа, свойственного плодам, новорожденным и детям первых месяцев жизни, на Th1-лимфоцитарный ответ, типичный для инфекционного ответа взрослых. Таким образом, возрастные особенности иммунной системы организма ребенка также являются фактором, обуславливающим более высокую его чувствительность к инфекциям и менее дифференцированный (по сравнению с взрослыми) ответ иммунной системы в целом на воздействие инфекции.
Нередко у ЧБД заболевание движется по «порочному кругу»: на фоне снижения иммунной защиты у пациента чаще возникают инфекционно-воспалительные заболевания; в свою очередь, рецидивирующие инфекции приводят к еще большему ослаблению иммунитета. Наиболее часто рецидивирующие инфекции респираторного тракта встречаются у детей, проживающих в индустриально-развитых странах, особенно в экологически неблагоприятных регионах. Кроме того, на заболеваемость влияет осеннее похолодание, непосредственно связанное со снижением влажности в отапливаемых помещениях, что способствует высушиванию слизистых оболочек, снижает их защитные функции в борьбе с инфекцией и способствует вспышкам острых респираторных заболеваний в этот период.
Иммунопрофилактика и иммунотерапия респираторных инфекций. Эффективным методом профилактики любой инфекции является вакцинация, приводящая к развитию специфической резистентности. В отношении большого числа респираторных возбудителей специфическая иммунопрофилактика ограничена и проводится против гриппа, пневмококковой инфекций и Haemophilus influenza типа b, сегодня также возможно проведение специфической пассивной иммунопрофилактики РС–вирусной инфекции. Но даже вакцинация только против этих перечисленных инфекций позволяет существенно сократить бремя острых респираторных инфекций у детей. Все современные противогриппозные вакцины разрабатываются с учетом рекомендаций ВОЗ. Иммуноадъювантная противогриппозная вакцина, которая содержит высокоочищенные поверхностные гликопротеины – гемагглютинин (H) и нейраминидазу (N), связанные с иммуномодулятором азоксимера бромидом, что обеспечивает высокую специфическую защиту от гриппа и способствует снижению частоты ОРВИ и других инфекций. Для профилактики острых инфекционных заболеваний органов дыхания кроме вакцинопрофилактики используются методы неспецифической активации иммунной системы с применением иммуномодулирующих препаратов.
Хорошо известно, что 90-95% всех острых респираторных инфекций имеют вирусное происхождение. Процессы, вызванные вирусной инфекцией, в значительной степени определяют характер течения инфекционного процесса и его исход. Важной биологической особенностью вирусов является также возможность персистирования в организме и развитие хронической или латентной вирусной инфекции. Персистенция вирусов вызывает дефекты иммунной реактивности и создает благоприятные условия для бактериальной инфекции. Ускользая от иммунной системы, персистирующие вирусы вынуждены пользоваться различными механизмами иммуносупрессии, способствуя при этом снижению резистентности хозяина к воздействию агентов, для которых персистенция не характерна, в том числе и возбудителей острых респираторных заболеваний. Показано, например, что в результате взаимодействия большинства герпесвирусов с макрофагами секретируются иммуносупрессивные факторы, приводящие к формированию стойкого иммунодефицита. Вместе с тем установлено, что и вирусы гриппа, парагриппа, аденовирусы, РС-вирус могут длительное время персистировать в организме после перенесенной острой респираторной инфекции. Воздействие патогенных факторов усиливается при развитии повторных инфекционных заболеваний органов дыхания. Острые респираторные инфекции, чаще вирусные (грипп, парагрипп, аденовирус), персистирующие возбудители, чаще герпесвирусы, у детей, склонных к рецидивирующим респираторным инфекциям, способствуют хроническому течению инфекционно-воспалительного процесса, протекающему на фоне продолжительного иммунного дисбаланса, а нередко развитию иммунных нарушений.
Применение иммуномодуляторов – одно из направлений в стратегии профилактики и лечения острых респираторных инфекций у часто болеющих детей. В большинстве случаев детям с рекуррентными респираторными инфекциями иммуномодуляторы назначаются по клиническим показаниям, а выбор препарата осуществляется эмпирически. Предпочтение следует отдавать наиболее проверенным иммуномодуляторам с многоцелевым механизмом действия. Иммуномодуляторы применяются вместе с этиотропными препаратами, но не заменяют их. Иммуномодуляторы назначаются в виде монотерапии только при проведении сезонной профилактики или для иммунореабилитации в период выздоровления после тяжелого течения острого респираторного заболевания.
Наиболее перспективные и эффективные иммунотропные средства – химически чистые иммуномодуляторы.
Примером иммуномодулятора, сочетающего высокую клиническую эффективность и высокий профиль безопасности, является азоксимера бромид. Его основные эффекты: иммуномодулирующий, антиоксидантный, антитоксический, мембранопротекторный и хелатирующий. Очень важно, что в отличие от иммуномодуляторов микробного или растительного происхождения молекула препарата не имеет чужеродной антигенной нагрузки.
Иммуномодулирующая активность азоксимера бромида обусловлена его прямым воздействием на фагоцитирующие клетки, естественные киллеры и стимуляцией антителообразования, прием препарата способствует более быстрой элиминации из организма чужеродных агентов.
Антиоксидантные свойства азоксимера бромида связаны с его способностью к перехвату в водной среде активных форм кислорода, супероксидного аниона, перекиси водорода, гидроксильного радикала; уменьшением концентрации каталитически активного двухвалентного железа. Он защищает клетки от повреждающего действия ряда токсических веществ, что определяет мембранопротекторные свойства препарата.
Для использования в клинической практике доступны две лекарственные формы препарата: лиофилизат для приготовления раствора для инъекций и местного применения (с 6 мес) – во флаконах по 3 и 6 мг, суппозитории по 3 и 6 мг (с 6 лет). Способ приготовления раствора для интраназального/сублингвального применения: дозу 6 мг растворяют в 1 мл дистиллированной воды или 0,9% раствора хлорида натрия, или кипяченой воды комнатной температуры (20 капель) и используют в течение суток.
Исследования показали, что азоксимера бромид повышает иммунную резистентность организма в отношении разнообразных возбудителей болезней верхних и нижних дыхательных путей. При этом препарат оказывает неспецифическое защитное действие от широкого спектра патогенов, основанное не на прямом угнетении микроорганизмов, а на стимуляции иммунитета макроорганизма. Кроме того, азоксимера бромид обладает выраженной антитоксической активностью, которая не определяется активацией иммунных механизмов. Препарат способен блокировать как растворимые токсические вещества, так и микрочастицы, оказывающие токсическое действие в отношении живых клеток, что особенно важно при развитии респираторной инфекции.
Измененные параметры иммунного статуса, выявляемые у длительно и часто болеющих респираторными инфекциями пациентов, запускают механизм формирования хронической воспалительной патологии. Профилактические мероприятия, направленные на усиление защитных свойств слизистых оболочек верхних дыхательных путей, должны осуществляться с помощью местного (сублингвального) применения иммуномодуляторов вследствие ведущей роли местной системы защиты, препятствующей проникновению патогенных микроорганизмов в организм. В открытом сравнительном исследовании на большой выборке пациентов (n=280) в возрасте 12–18 лет показана эффективность использования азоксимера бромида в сочетании с витаминным комплексом для профилактики острых инфекционных заболеваний верхних дыхательных путей. Включение азоксимера бромида в схему предсезонной иммунопрофилактики ОРЗ (сублингвально 10 дней) совместно с приемом витаминного комплекса способствовало снижению заболеваемости острыми респираторными заболеваниями (ОРЗ) в 3 раза по сравнению с подростками, не получавшими иммуномодулятор (p<0,05), а также уменьшению частоты других воспалительных заболеваний (ангины, бронхиты, пневмонии).
Для часто болеющих респираторными инфекциями лиц характерна хроническая воспалительная патология лимфоглоточного кольца (хронический тонзиллит, гипертрофия небных миндалин), которая сопровождается изменением ключевых иммунологических показателей. Аденотонзиллярная гипертрофия рассматривается как следствие хронического антигенного раздражения. При объективном обследовании этой группы пациентов отмечаются изменение назоцитограммы, увеличение микробного обсеменения. Иммуномодулятор успешно применяется в комплексном лечении гнойно-воспалительных заболеваний околоносовых пазух, среднего уха, носоглотки, в т.ч. и у детей при хроническом аденоидите, гиперплазии глоточных миндалин и при сочетании хронического аденоидита и хронического тонзиллита. При монотерапии азоксимера бромидом у детей с хронической ЛОР-инфекцией у 85% пациентов был получен отличный и хороший клинический эффект. После курса терапии у пациентов с хроническим тонзиллитом, хроническом аденоидитом ( азоксимера бромид интраназально по схеме 0,15 мг/кг в сутки ежедневно 10 дней) отмечены нормализация носового дыхания, исчезновение катаральных явлений; улучшение самочувствия (уменьшение головной боли, симптомов интоксикации); уменьшение степени гипертрофии глоточной миндалины; уменьшение бактериальной колонизации слизистой оболочки верхних дыхательных путей; нормализация показателей местного гуморального иммунитета, активация неспецифических факторов защиты слизистых (лизоцим); снижение частоты ОРВИ, уменьшение тяжести их течения. Ни в одном случае применения препарата не было зарегистрировано общих и местных побочных реакций.
Доказана эффективность, безопасность и селективность иммуномодулятора при применении в комплексной терапии у детей, страдающих рецидивирующим обструктивным бронхитом (назначался в дозе 0,1 мг на 1 кг 1 р/сут с интервалом 2–3 дня, курсом 5 инъекций). При купировании обострений, возникающих после проведенного курса азоксимера бромидом, в 2 раза уменьшилось использование бронхоспазмолитиков, в 3 раза – глюкокортикостероидов.
Было установлено, что включение азоксимера бромида в комплексную терапию внебольничной пневмонии способствует уменьшению длительности интоксикационного периода; сокращению времени регрессирования очага пневмонии по данным рентгенологических исследований (время достоверной положительной динамики начала рассасывания пневмонической инфильтрации сокращается на 19%, а время практически полного рассасывания пневмонической инфильтрации – на 26%, у больных с абсцедирующей пневмонией образуется участок пневмосклероза); снижению числа возможных осложнений (острой инфекционной деструкции легочной паренхимы, синдрома острого повреждения легкого, острого инфекционного миокардита, синдрома токсической почки и т.д.); нормализации параметров иммунного статуса; уменьшению длительности койко-дней на 25%. Результаты комплексного лечения с применением азоксимера бромида больных с тяжелым течением внебольничной пневмонии показали преимущественное влияние препарата на клеточные эффекторные механизмы системы иммунитета, а также на нормализацию содержания провоспалительных цитокинов. Дезинтоксикационное действие препарата проявилось устранением развития бактериальной эндотоксинемии и влиянием на факторы антиэндотоксинового иммунитета. Таким образом, несомненен тот факт, что повреждающее действие инфекционного фактора на легочную ткань зависит не только от вирулентности микроорганизма, но и от значительно измененной системы иммунитета человека. В этой связи при острой пневмонии обосновано назначение азоксимера бромида по 6–12 мг в/м или в/в через день в зависимости от тяжести состояния, курсом в 10 инъекций .
Одной из важнейших составляющих доказанной эффективности и безопасности любого препарата, в том числе иммуномодулятора, является изученность молекулярных механизмов его действия. Установлено, что клинический эффект иммуномодуляторов зависит от особенностей химического состава и механизмов их воздействия на различные звенья иммунного ответа. В этом отношении азоксимера бромид имеет преимущества в отличие от многих других иммунотропных средств.
Различают два направления иммунного ответа на воздействие инфекционного антигена:
– центробежный механизм развития иммунного ответа (от центра к периферии), когда происходит одновременная активация иммунокомпетентных клеток от макрофага до В-лимфоцитов, сопровождающаяся каскадом выработки цитокинов и интерлейкинов, инициирующих развитие как неспецифического, так и специфического иммунитета. Примером такого иммуномодулятора является азоксимера бромид;
– центростремительный (от периферии к центру), в основе которого лежит последовательная активация и дифференцировка Т-клеточного звена, моноцитарно-макрофагальной системы, выработкой интерлейкина 2 (IL-2) и фактора некроза опухоли-альфа (TNF-α), обладающих плейотропным действием на различные компоненты иммунной системы, вызывая в конечном итоге повышение активности В-звена иммунной системы. Такой способностью, например, обладают иммуномодуляторы тимического происхождения.
Некоторые обладают способностью активировать иммунную систему в обоих направлениях. Однако избирательность действия иммунотропных препаратов относительна. Вне зависимости от исходной направленности иммуномодулятора в конечном итоге в той или иной степени изменяется функциональная активность всех звеньев иммунной системы. Это обусловлено тем, что главными регуляторами иммунитета, опосредующими действие на различные звенья (неспецифические и специфические) иммунной системы, являются цитокины, а они обладают множественными и разнообразными эффектами на иммунную систему. Такие особенности функционирования иммунной системы делают практически невозможным существование иммуномодулятора с абсолютно селективным конечным эффектом на иммунитет. Таким образом, любой препарат, избирательно действующий на соответствующий компонент иммунитета, помимо эффекта на этот компонент, будет оказывать и общее неспецифическое воздействие на иммунную систему в целом. В связи с этим выбор иммуномодулирующего препарата в реальной клинической практике вызывает особые трудности. Для активации противоинфекционного иммунитета наиболее целесообразно применение иммуномодуляторов, воздействующих на клетки моноцитарно-макрофагальной системы, т.е. вызывающих центробежную активацию иммунитета, соответствующую естественному ходу развития иммунных реакций [12]. Кроме того, элиминация большинства патогенных микробов из макроорганизма осуществляется в конечном итоге с помощью клеток фагоцитарной системы. Следовательно, азоксимера бромид можно рекомендовать препаратом первого выбора при лечении инфекций, особенно у часто болеющих пациентов (рис. 3).
Рисунок 3. Механизм иммуномодулирующего действия азоксимера бромида
Азоксимера бромид активирует все факторы естественной резистентности: клетки моноцитарно-макрофагальной системы, нейтрофилы и NK-клетки, вызывая повышение их функциональной активности только при исходно сниженных показателях. Активация макрофагов ведет к усилению синтеза практически всех цитокинов, вырабатываемых этими клетками. Следствием этого является усиление функциональной активности факторов как клеточного, так и гуморального иммунитета. В конечном итоге под влиянием азоксимера бромида в движение приходит вся иммунная система организма, но это движение соответствует естественному ходу активации иммунитета, наблюдаемого при развитии любого иммунного ответа. В то же время уникальной особенностью азоксимера бромида является то, что при взаимодействии с моноцитами периферической крови человека он активирует синтез TNF-α только у людей с исходно низкими или средними уровнями его продукции. У лиц с исходно высокими уровнями препарат не оказывает влияния или несколько понижает продукцию этого цитокина. Такие свойства азоксимера бромида исключают минимальную возможность гиперактивации иммунной системы под его влиянием, что является важным условием применения любого иммунотропного препарата. Серьезным преимуществом по сравнению с другими препаратами являются его детоксицирующие, антиоксидантные и мембраностабилизирующие свойства, что делает азоксимера бромид идеальным препаратом для лечения и профилактики хронических инфекционных процессов. Указанные свойства азоксимера бромида, обладающего преимущественным эффектом на клетки фагоцитарной системы, определяют и тактику его применения для лечения хронических инфекционно-воспалительных процессов у часто болеющих пациентов (хронический тонзиллит, хронический риносинусит, латентная персистирующая вирусная инфекция и др.). В этих случаях препарат должен назначаться одновременно с антибактериальной и противовирусной терапией, поскольку антибактериальный препарат или другое лекарственное средство снижают функциональную активность микроба, а иммуномодулятор повышает функциональную активность фагоцитарных клеток, за счет чего достигается более эффективная элиминация возбудителя из организма.
В недавно проведенных исследованиях установлена способность азоксимера бромида стимулировать образование интерферона (IFN), что связывают с его воздействием на антиген-презентирующие клетки: макрофаги и дендритные клетки. Было обнаружено, что при совместном культивировании азоксимера бромид усиливает экспрессию на мембране дендритных клеток ко-стимулирующих молекул CD80 и CD86 , играющих исключительно важную роль в образовании иммунологического синапса с Т- и В-лимфоцитами. Азоксимера бромид стимулирует процесс презентации дендритными клетками специфических антигенов Т-клеткам, что проявляется в повышенной их пролиферации и синтезе IFN-γ. Дендритные клетки, нагруженные смесью гемагглютининов и молекулы азоксимера бромида, обладали способностью стимулировать пролиферацию аутологичных CD4 Т-клеток и индуцировать синтез CD4 Т-клетками IFN-γ. Причем в последнем случае продукция этого цитокина была более интенсивной, чем при активации дендритных клеток смесью гемагглютининов и липополисахаридов (ЛПС). А как известно, ЛПС – одни из наиболее сильных стимуляторов системы интерферонов.
Важным в вопросах иммунокоррекции является возможность применения иммуномодуляторов при острых бактериальных и вирусных инфекциях. Их назначение не рекомендуется при острых процессах, так как это может утяжелить течение основного заболевания за счет срыва компенсаторных иммунологических реакций. Так, при вирусной инфекции происходит естественная активация Т-киллеров. Дополнительная активация последних иммуномодулятором может вызвать массивное разрушение тканей, инфицированных вирусом, что усугубит явления интоксикации и может привести к летальному исходу. Высокой степенью активации Т-киллеров обладают иммуномодуляторы тимического и бактериального происхождения, являющиеся также мощными индукторами провоспалительных цитокинов. В отличие от других системных иммуномодуляторов азоксимера бромид, благодаря структурному строению его молекулы, может назначаться не только с иммунопрофилактической целью, но и в острый период инфекционно-воспалительного заболевания. Это, как уже указывалось, связано с его выраженным иммуномодулирующим, детоксицирующим и антиоксидантным эффектами.
Высокий профиль безопасности и клинико-иммунологическая эффективность азоксимера бромида позволяет применять его у детей. При рецидивирующих респираторных инфекциях с целью иммунопрофилактики и иммунотерапии эффективно назначение препарата:
– интраназально или сублингвально в виде раствора лиофилизата в суточной дозе 0,15 мг/кг ежедневно в течение 5-10 дней (с 6 мес.);
– в свечах по 1 супп. через день 10-15 супп. (с 6 лет).
Для приготовления раствора с целью интраназального или сублингвального введения рекомендуется использовать кипяченую или дистиллированную воду комнатной температуры или 0,9% раствор хлорида натрия (после разведения 1 флакон по 3 мг 1 мл растворителя содержит 20 капель препарата; 1 флакон по 6 мг 2 мл растворителя – 40 капель препарата). Приготовленный раствор хранится в холодильнике не более 7 дней, перед употреблением пипетка с раствором должна быть нагрета до комнатной температуры (20-25°С).
Иммуномодулятор азоксимера бромид, обладающий многофакторным действием, не только иммуномодулирующим (в том числе и интерферониндуцирующим), но детоксицирующим и антиоксидантным эффектами, можно отнести к препаратам выбора в острый период респираторной инфекции при его назначении одновременно с этиотропной терапией. Препарат хорошо изучен, доказана его высокая эффективность и безопасность, оптимальна продолжительность курса введения.
Способность азоксимера бромида улучшать показатели фагоцитарной активности может быть полезна при лечении детей, больных бронхиальной астмой (с инфекционной зависимостью), гнойно-воспалительными заболеваниями, и детей, инфицированных рядом возбудителей оппортунистических инфекций ( с первого года жизни в дозе 0,1–0,15 мг/кг один раз в сутки через 2–3 дня курсом 5–7 инъекций).
Другая область эффективного применения азоксимера бромида – модулирование иммунного ответа при атопических заболеваниях – атопическом дерматите и крапивнице. Важно отметить, что ни в одном случае при применении азоксимера бромида при этих заболеваниях не было отмечено ни общих, ни местных побочных реакций или аллергических реакций. При парентеральном применении курсом 5–7 инъекций по 0,07–0,1 мг/кг 1 раз в сутки с интервалом 2 дня на фоне общепринятой комплексной терапии при этих заболеваниях отмечено значительное улучшение клинических проявлений.
У детей 5–12 лет с обострениями атопического дерматита (в 28% случаев осложненных присоединением пиогенной инфекции) при применении азоксимера бромида островоспалительные изменения со стороны кожных покровов купировались в 2,5 раза быстрее, а процесс восстановления трофических нарушений шел в 2 раза быстрее, чем в контрольной группе. У 60% пациентов применение азоксимера бромида позволило в два раза снизить дозу глюкокортикоидов по сравнению с контрольной группой, а также сократить длительность их применения в 1,5 раза. У пациентов с атопическим дерматитом, осложненным пиогенной инфекцией, применение азоксимера бромида в 65% случаев позволило исключить антибактериальную терапию, а в 35% случаев максимально ее сократить. После купирования острых проявлений дерматита у пациентов, получавших иммуномодулятор, отмечено удлинение периода ремиссии по сравнению с контрольной группой.
При острой крапивнице у детей от 5 мес. до 5 лет, получавших азоксимера бромид, отмечался более быстрый клинический эффект по сравнению с контрольной группой: в 85% случаев проявления крапивницы со стороны кожных покровов купировались в 2 раза быстрее; в остальных 15% случаев – в 1,5 раза. Применение азоксимера бромида в 70% случаев позволило двукратно снизить дозу глюкокортикоидов по сравнению с контрольной группой, а также сократить длительность их применения в 1,7 раза. В течение трех месяцев после купирования острых проявлений при использовании азоксимера бромида рецидивов обострения не отмечалось, в то время как у пациентов, не принимавших этот иммуномодулятор, рецидивы обострений возникали в 40% случаев. У детей 5–12 лет с острой крапивницей эффект применения азоксимера бромида был еще более значимым. В 85% случаев в исследуемой группе отмечался более быстрый клинический эффект по сравнению с контрольной группой: в 2,7 раза быстрее купировались явления крапивницы со стороны кожных покровов; в оставшихся 15% случаев в исследуемой группе купирование явлений крапивницы наблюдалось в два раза быстрее по сравнению с контрольной группой. Применяемую дозу глюкокортикоидов удалось снизить у 80% пациентов, при этом удалось также сократить длительность их применения в 2 раза. После купирования острых проявлений рецидивы обострения не возникают в течение по крайней мере 3 мес. (в то же время у пациентов, не получавших азоксимера бромида, обострения возникают в 35% случаев).
Заключение.
Таким образом, иммуномодулирующая терапия позволяет существенно облегчить тяжесть течения инфекционно-воспалительных заболеваний у детей. Лечение не следствия (например, инфекционного поражения), а именно причины (иммунные нарушения) у детей, имеющих незрелую иммунную систему, проживающих в неблагоприятных экологических условиях, страдающих от иммунной недостаточности или же в предэпидемический период (сезонное применение) позволяет частично или полностью компенсировать недостаточную активность иммунной системы, т. е. помогает организму «справиться с болезнью». Это особенно важно в условиях чрезмерного и зачастую необоснованного применения антибиотических препаратов. Одним из наиболее перспективных иммуномодуляторов является азоксимера бромид, оказывающий иммуномодулирующий, антиоксидантный, антитоксический, мембранопротекторный и хелатирующий эффекты. Все это делает азоксимера бромид уникальным препаратом, который можно применять как в комплексе с основным лечением для проявления иммуномодулирующего эффекта, так и при наличии показаний в качестве монотерапии.
СПИСОК ЛИТЕРАТУРЫ
1. Брико Н.И., Покровский В.И. Глобализация и эпидемический процесс// Эпидемиология и инфекционные болезни, 2010; 4: 4-10.
2. Атауллаханов Р.И., Гинцбург А.Л. Иммунитет и инфекция: динамичное противостояние живых систем// Детские инфекции. 2005; 4(1): 11-21.
3. Beceiro A., Tomás M., Bou G. Antimicrobial Resistance and Virulence: a Successful or Deleterious Association in the Bacterial World? Clin. Microbiol. Rev. April 2013; 26(2): 185-230. doi: 10.1128/CMR.00059-12
4. Караулов А.В., Калюжин О.В. Иммунотерапия инфекционных болезней: проблемы и перспективы//Терапевтический архив 2013; 85(11): 100-108.
5. Козлов И.Г. Сигнальные рецепторы врожденного иммунитета: новая молекулярная мишень для диагностики и терапии воспалительных заболеваний// Вестник Российской академии медицинских наук 2011; 1: 42-50.
6. Пащенков М.В., Пинегин Б.В. Физиология клеток врожденной иммунной системы: дендритные клетки// Иммунология, 2006; 27(6): 368-378.
7. Алексеев Л.П., Хаитов Р.М. Регуляторная роль иммунной системы в организме// Российский физиологический журнал им. И.М. Сеченова 2010; 96(8): 787-805.
8. National Research Council. Treating Infectious Diseases in a Microbial World: Report of Two Workshops on Novel Antimicrobial Therapeutics. Washington, DC: The National Academies Press, 2006. http://www.ncbi.nlm.nih.gov/books/NBK19846/
9. Лусс Л.В., Некрасов А.В., Пучкова Н.Г. и др. Роль иммуномодулирующей терапии в общеклинической практике// Иммунология, 2000; 5: 34-38.
10. Семенов Б.Ф., Зверев В.В., Клименко С.М. Гипотеза о связи так называемых неинфекционных заболеваний с инфекционными возбудителями. Новости вакцинопрофилактики// Вакцинация, 2004; 4 (34): С. 3-4.
11. Waldmann T.A. Immunotherapy; past, present and future. Nat. Med. 2003; 9 (3): 269-277.
12. Хаитов Р.М., Пинегин Б.В. Современные иммуномодуляторы. классификация, механизм действия// Российский аллергологический журнал. 2005; 4: 30.
13. Иммунотерапия: руководство / Под редакцией Р.М. Хаитова, Р.И. Атауллаханова. – М.: ГЭОТАР-Медиа, 2011: 672 с.
14. Юшков В.В. Качественная информация рациональному использованию иммунокорректоров// Вестник Уральской медицинской академической науки, 2011; 2-2 (35): 76-77.
15. Иммуномодуляторы и вакцинация / Под редакцией М.П. Костинова, И.Л. Соловьевой. – М.: 4Мпресс, 2013: 272 с.
16. Булгакова В.А., Балаболкин И.И. Иммунофармакотерпия детей с аллергическими болезнями// Педиатрическая фармакология 2006; 3(5): 22-29.
17. Костинов М.П., Чучалин А.Г., Чебыкина А.В. Поствакцинальный иммунитет к гриппу у впервые и повторно вакцинированных больных с бронхолегочной патологией// Иммунология, 2011; 32(6): 306-310.
18. Пинегин Б.В., Некрасов А.В., Хаитов Р.М. Иммуномодулятор Полиоксидоний: механизмы действия и аспекты клинического применения// Цитокины и воспаление, 2004; 3(3): 41-47.
19. Полиоксидоний в клинической практике / Под редакцией А. В. Караулова. Сер. Актуальные вопросы медицины. – М.: ГЭОТАР-Медиа, 2008: 135 с.
20. Применение Полиоксидония и Лонгидазы в комплексной терапии больных туберкулезом органов дыхания// Consilium Medicum (Врачебный консилиум), 2009; 11(3): 21-23.
21. Латышева Т.В., Сетдикова Н.Х. Эффективность иммуномодулирующей терапии у больных ХНЗЛ// Лечащий врач 2000; 3: 19-22.
22. Шувалова Ю.В., Ахвердиева Т.Б., Герасимова Н.Г., Коваленко Е.Н., Чашина Т.Е., Зотова Л.В., Горбатов В.А. Клинико-лабораторная эффективность полиоксидония в комплексной терапии синдрома рецидивирующей бронхиальной обструкции у детей// Современные проблемы науки и образования, 2013; 2: 90.
23. Малеев В.В., Михайлова Е.В., Чудакова Т.К., Романовская А.В., Данилов А.Н., Хрипунова Г.И., Дубовицкая Н.А.Клинико-эпидемиологическая характеристика гриппа в постпандемический период// Саратовский научно-медицинский журнал, 2013; 9(2): 186-192.
24. Булгакова В.А., Балаболкин И.И., Ceнцoвa Т.Б. Респираторная вирусная инфекция у детей и подростков с аллергической патологией// Детские инфекции, 2005; 4(4): 17-24.
25. Баранов А.А., Намазова-Баранова Л.С., Ильин А.Г., Булгакова В.А., Антонова Е.В., Смирнов И.Е. Научные исследования в педиатрии: направления, достижения, перспективы// Российский педиатрический журнал, 2013; 5: 4-14.
26. Михайленко А.А., Макаренко О.С., Самошин О.А., Сизякова Р.И. Профилактика гриппа и ОРЗ с помощью сублингвального применения Полиоксидония. Иммунология 2005; 4: 214–217.
27. Скачков М.В. Безопасность и эффективность Полиоксидония для профилактики ОРЗ у длительно и часто болеющих пациентов// Медицинский вестник, 2006; 3: 13.
28. Джалилов Х.Н., Царуева Т.В., Саидов М.С., Газиев Г.М. Полиоксидоний в комплексной терапии больных пожилого и старческого возраста с хроническим бактериальным простатитом// Вестник Дагестанской государственной медицинской академии, 2012; 2: 56-60.
29. Вавилова В.П., Перевощикова Н.К., Ризо А.А., Павленко С.А., Филиппова Т.В., Милькова Т.Ю., Августан Л.А. Применение отечественного иммуномодулятора Полиоксидония в практике лечения детей с патологией лимфоглоточного кольца// Аллергология и иммунология в педиатрии, 2005; 1(4): 47–53.
30. Лопаткина В.А., Ширшев С.В., Иванова А.С. Использование Полиоксидония в комплексной терапии детей, страдающих рецидивирующим обструктивным бронхитом / В сб. Механизм действия и клиническое применение отечественного иммуномодулятора Полиоксидония (в помощь практическому врачу). – М., 2003: 53–56.
31. Караулов А.В., Самойлова Н.М., Кокушков Д.В. Исследование изменений апоптоза лимфоцитов и гранулоцитов периферической крови у пациентов с хроническим обструктивным бронхитом на фоне комплексной терапии с включением Полиоксидония// Иммунология, 2007; 2: 93–95.
32. Караулов А.В., Мавзютова Г.А., Фазлыева Р.М. и др. Клинико-иммунологические особенности внебольничной пневмонии, иммунокоррекция. – Уфа, 2010: 182 с.
33. Моисеева Е.Л., Соловьев К.И., Гришенков Г.В. Опыт клинического применения Полиоксидония в комплексной терапии заболеваний органов дыхания. – Signatura СПб: 2006; 1: 3-13.
34. Пинегин Б.В., Варфоломеева М.И. Влияние иммуномодулятора на синтез интерферона// Лечащий врач, 2010; 10: 2–5.
35. Булгакова В.А., Балаболкин И.И., Ларькова И.А., Седова М.С. Комбинированная иммунотерапия у детей с атопической бронхиальной астмой и частыми острыми респираторными инфекциями// Вопросы современной педиатрии, 2008; 7(3): 123-124.
36. Харламова Ф.С., Учайкин В.Ф., Кузьменко Л.В., Чирун Н.В., Легков Т.П., Фельдфикс Л.В. Опыт применения иммуномодулятора полиоксидоний для лечения ОРИ у детей// Эффективная фармакотерапия 2013; 13: 12-21.
37. Заплатников А.Л., Коровина Н.А. Часто болеющие дети: современное состояние проблемы// Вопросы практической педиатрии, 2008. Том 3, №5. С. 103-109.
38. Ярцев М.Н., Плахтиенко М.В. Часто болеющие дети и иммунная недостаточность// Российский аллергологический журнал, 2010. № 05. С. 58-66.
39. Зиновьева Н.В., Давыдова Н.В., Щербина А.Ю., Продеус А.П., Румянцев А.Г. Часто болеющие дети: чем они больны на самом деле? //Трудный пациент, 2007. Т. 5. № 2. С. 25-27.
40. Овсянников Д.Ю., Илларионова Т.Ю., Пушко Л.В., Кузьменко Л.Г. Часто болеющие дети: что еще кроме инфекций?// Вопросы современной педиатрии, 2013. Т. 12. № 1. С. 74-86.
41. Самсыгина Г.А. О рецидивирующей инфекции респираторного тракта и диспансерной группе часто болеющих детей// Детские инфекции. 2012. Т. 11. № 3. С. 52-53.
42. Караулов А.В. Иммуномодуляция при респираторных инфекциях: от понимания целей и механизмов действия к клинической эффективности//Детские инфекции, 2012. Т. 11. № 3. С. 62-64.
43. Боковой А.Г. Герпетические инфекции как ведущий фактор формирования вторичных иммунодефицитов в детском возрасте// Эпидемиология и инфекционные болезни, 2007. № 6. С. 34-39.
44. Замахина Е.В., Фомина В.Л., Кладова О.В. и др. Клинико-патогенетическое значение персистенции респираторных вирусов у часто болеющих ОРЗ детей// Педиатрия, 2009. Том 87, № 3. С. 42-47.






