Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ОСТЕОАРТРОЗ: ВОПРОСЫ ПАТОГЕНЕЗА, ДИАГНОСТИКИ, ЛЕЧЕБНОЙ ТАКТИКИ"
Автор: А.И. ДЯДЫК, БАГРИЙ А.Э., И.С. МАЛОВИЧКО, И.И. ЗДИХОВСКАЯ, Н.И. ШПИЛЕВАЯ
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Ревматология, Семейная медицина/Терапия
Просмотров: 2 616
Дата проведения: с 04.11.2014 по 04.11.2015
Остеоартроз (ОА) является одной из серьезных медицинских и социальных проблем, что обусловлено его широкой распространенностью, высоким риском развития ограничений функции опорно-двигательного аппарата, которые приводят к нарушению трудоспособности и снижению качества жизни пациентов. По данным различных исследований, распространенность остеоартроза колеблется от 4,2 до 22,6%. В структуре ревматических заболеваний на его долю приходится 40–50% всех больных. По прогнозам Всемирной организации здравоохранения, ОА в ближайшие 10–15 лет станет четвертой главной причиной инвалидности у женщин и восьмой – у мужчин.
Приведенное выше обусловливает актуальность обсуждения современных представлений о подходах к диагностике и лечению больных с ОА. При подготовке данного сообщения мы использовали рекомендации экспертов Европейской лиги борьбы с ревматизмом (Europeаn League against Rheumatism – EULAR) по ведению пациентов с ОА коленных суставов, тазобедренных суставов и суставов кистей, рекомендации Международной ассоциации по изучению остеоартрита (OARSI) касательно ведения пациентов с ОА коленных и тазобедренных суставов, а также результаты контролируемых рандомизированных исследований (КРИ) различных лечебных режимов при ОА и обзоры литературы, опубликованные в последние годы.
Определение, эпидемиология ОА
Существует несколько определений ОА. Отечественные специалисты рассматривают его как хроническое прогрессирующее невоспалительное заболевание суставов неизвестной этиологии, которое характеризуется дегенерацией хряща и структурными изменениями субхондральной кости, а также явным или скрытым умеренно выраженным синовитом.
По определению Американской коллегии ревматологов (АКР), ОА – заболевание, обусловленное действием биологических и механических факторов, дестабилизирующих нормальные отношения между процессами дегенерации и синтеза хондроцитов, внеклеточного матрикса (ВКМ) суставного хряща и субхондральной кости.
Экспертами EULAR ОА рассматривается как очаговое повреждение суставного хряща с гипертрофической реакцией субхондральной кости, краевым и центральным формированием новой костной ткани – остеофитов.
В различных эпидемиологических исследованиях распространенности ОА используются два вида критериев установления диагноза ОА – клинические и рентгенологические. В соответствии с клиническими критериями Американской ревматологической ассоциации (АРА) диагноз ОА устанавливается при наличии главного признака – боли в суставах в течение большинства дней предшествующего месяца (манифестный ОА). В связи с этим, вероятно, показатели распространенности манифестного ОА ниже показателей распространенности ОА, определяемого рентгенологически.
Наиболее частая локализация поражения суставов при ОА – мелкие суставы кистей, коленные, тазобедренные и, реже, другие суставы. При этом суставы поражаются как изолированно (моно-, олигоартроз), так и в различных комбинациях, что показано на рисунке 1.
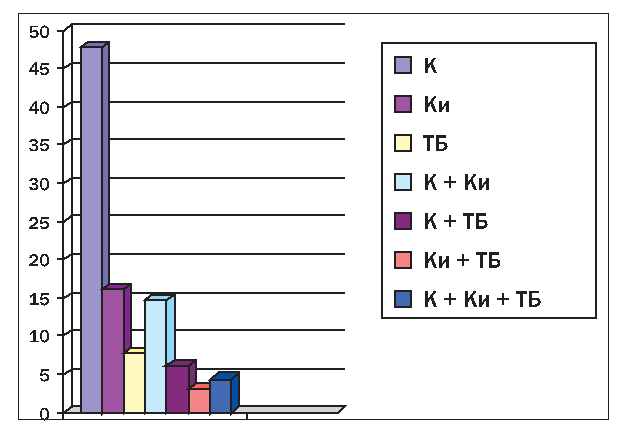
Рисунок 1. Удельный вес ОА различной локализации: К – коленного сустава; Ки – суставов кистей; ТБ – тазобедренного сустава; К Ки, К ТБ, Ки ТБ, К Ки ТБ – соответствующие сочетания
В США эпидемиология ОА изучалась в двух национальных программах (National Health Examination Survey – NHES и First National Health and Nutrition Examination Survey – NHANES-I). Диагностика ОА базировалась на рентгенологических признаках в первом исследовании и на оценке клинических и рентгенологических признаков ОА – во втором. По данным этих исследований, рентгенологические признаки ОА хотя бы одной локализации имеют около 1/3 лиц в возрасте от 25 до 74 лет. В частности, ОА суставов кистей обнаружен у 33%, стоп – у 22%, коленных суставов – у 4%. Среди лиц в возрасте от 55 до 74 лет показатели распространенности ОА были выше (ОА кисти – у 70%, стоп – у 40%, коленных суставов – у 10%, тазобедренных суставов – у 3%).
По данным Фремингемского исследования (Framinghаm Osteoarthritis Study), среди представителей европейской расы в возрасте 63–93 лет у 1/3 лиц имелись достоверные рентгенологические признаки ОА коленных суставов. В то же время манифестный ОА имел место только у 9,5 % обследованных.
По данным европейских исследований, ОА – самая распространенная форма поражения суставов. Так, рентгенологические признаки ОА коленного сустава выявляются у 30% лиц старше 50 лет, клинически ОА проявляется у 10% из них. Причем у 25% последних наблюдалось значительное нарушение функции суставов. Второй наиболее частой локализацией ОА является тазобедренный сустав. Распространенность ОА этой локализации колеблется от 3 до 11% населения западных стран в возрасте старше 35 лет.
Этиология и патогенез ОА
Этиология и патогенез ОА остаются недостаточно изученными. К факторам риска его развития относят:
— пожилой возраст;
— женский пол;
— избыточную массу тела;
— травмы суставов;
— операции на суставах;
— снижение уровня женских половых гормонов (постменопауза);
— генетическую предрасположенность;
— дисплазию сустава (для тазобедренных суставов).
Основная функциональная роль суставного хряща заключается в обеспечении физиологических условий при движении в суставе путем поглощения давления во время механической нагрузки на него за счет обратимой деформации, что осуществляется благодаря уникальному строению хрящевой ткани, являющейся разновидностью соединительной. По физико-химическим свойствам хрящевая ткань представляет собой гель, содержащий 70–80% воды, 10–15% органических веществ и 4–7% минеральных солей.
На суставных поверхностях костей, образующих суставы, располагается гиалиновый хрящ, в структуру которого входят клетки (хондроциты), погруженные в основное (межклеточное) вещество или внеклеточный матрикс. Структура и концентрация макромолекул ВКМ изменяются соответственно функциональным потребностям. В обеспечении прочности и упругости хряща важнейшее место занимают коллагеновые волокна, протеогликаны (ПГ) и неколлагеновые гликопротеины.
Коллагеновые волокна состоят из фибриллярного белка – коллагена. В зрелом суставном хряще удельный вес коллагена II типа составляет около 90%, а остальные 10% приходятся на долю так называемых минорных коллагенов (коллагены IX, XI, VI типов).
Сеть коллагеновых волокон обеспечивает поддержание формы и объема суставного хряща, сопротивление деформирующим силам. Коллагеновые волокна расположены аркадами, где более «толстые» филаменты находятся в глубоких слоях, а более «тонкие» – горизонтально в поверхностном слое. Прочность всей структуре придают поперечные и ковалентные связи между волокнами.
Другой немаловажной в функциональном отношении составляющей ВКМ суставного хряща являются протеогликаны – белки, к которым присоединена одна или несколько гликозаминогликановых цепей. Высокая гидрофильность ПГ обеспечивает хрящу достаточную эластичность. При действии на хрящ сил, направленных на сжатие, вода вытесняется из сульфатированных и карбоксильных групп ПГ, что сближает их. Отрицательные заряды этих групп ПГ препятствуют дальнейшему сжатию. При уменьшении давления на хрящ содержание воды в ПГ восстанавливается.
Основным ПГ суставного хряща является аггрекан, имеющий сложную структуру. Он состоит из стержневого белка, с которым связано множество гликозаминогликановых цепей, а также олигосахаридов и фосфатных эфиров. К гликозаминогликанам, входящим в аггрекан, относятся кератансульфат и хондроитинсульфат (хондроитин-4-сульфат и хондроитин-6- сульфат). Молекулы аггрекана синтезируются хондроцитами и секретируются в ВКМ. Здесь при помощи связующих белков из множества молекул аггрекана и нитей гиалуроновой кислоты формируются стабильные агрегаты. С одной молекулой гиалуроновой кислоты может связываться около 200 молекул аггрекана. Сформированные агрегаты сохраняют свою связь с хондроцитами путем взаимодействия с рецепторами на клеточной мембране. Кроме аггрекана в структуру суставного хряща входят и другие ПГ с меньшей молекулярной массой.
Суставной хрящ не содержит ни кровеносных, ни лимфатических сосудов, но высокая гидрофильность хрящевого матрикса позволяет обеспечивать нормальный метаболизм хондроцитов. Разная глубина залегания хрящевых клеток определяет различия в условиях питания, а следовательно, их метаболические и синтетические свойства. Взаимодействия хондроцитов и основных молекул ВКМ схематично представлены на рисунке 2.
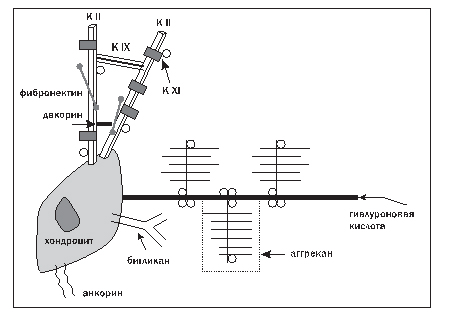
Рисунок 2. Взаимодействие хондроцитов и некоторых молекул ВКМ
Примечание: К IХ – коллаген IХ типа; К ХI – коллаген ХI типа; К II – коллаген II типа.
С патогенетической точки зрения ОА рассматривается как результат неблагоприятного действия различных факторов, нарушающих баланс между процессами деградации и синтеза ВКМ суставного хряща и субхондральной кости. В патологический процесс при ОА могут вовлекаться все ткани синовиального сустава, что ведет к изменению морфологических, биохимических свойств клеток и матрикса, результирующему в истончение, разволокнение, ульцерацию суставного хряща, остеосклероз с резким утолщением и уплотнением кортикального слоя субхондральной кости, формирование остеофитов и субхондральных кист.
Исследования последних лет продемонстрировали роль биомеханических факторов в развитии ОА. Длительная динамическая нагрузка на хрящ приводит к гипертрофии хондроцитов, их пролиферации, усилению синтеза ВКМ и изменению его качественного состава, что повышает адаптацию к большим нагрузкам. Наличие различных сочетаний других факторов риска приводит к нарушению равновесия между процессами синтеза и деградации в ткани хряща в пользу последних, что ведет к морфологическим изменениям хряща. В местах максимальной нагрузки образуются зоны его размягчения. Хрящ из прочного эластичного голубоватого становится сухим, желтоватым, тусклым с шероховатой поверхностью. В дальнейшем образуются вертикальные трещины, фрагментация, очаговые обызвествления. Эрозивные процессы в хряще приводят к отделению его фрагментов, которые в виде детрита попадают в полость сустава.
Постепенно хрящ истончается, теряет амортизационные свойства, нарушается конгруэнтность суставных поверхностей, в результате чего костные суставные поверхности испытывают большую и неравномерную механическую нагрузку, что, в свою очередь, приводит к развитию субхондрального склероза, изменению кривизны суставных поверхностей, образованию остеофитов. Эти механизмы увеличивают площадь соприкосновения суставных поверхностей и перераспределяют силы давления, но вместе с тем ограничивают объем движений в суставе.
В губчатом веществе субхондральной кости происходит неравномерное изменение диаметра костных балок, появляются микропереломы, формируются кисты, что способствует дальнейшей деструкции суставного хряща. До недавнего времени считалось, что изменения в субхондральной кости вторичны по отношению к изменениям в хряще. Однако в ряде экспериментальных исследований было показано, что изменения в субхондральной кости могут предшествовать повреждению суставного хряща.
В формировании изменений субхондральной кости и хряща при ОА немаловажная роль отводится остеобластам, которые синтезируют провоспалительные цитокины, способствующие повреждению хряща. Кроме того, пролиферация остеобластов обусловливает повышение жесткости костной ткани.
Важная роль в процессе деградации суставного хряща отводится уровням и соотношению цитокинов и других биологически активных веществ, обладающих как провоспалительными, так и противовоспалительными свойствами, а также стимулирующих деградацию хряща.
В деградации суставного хряща активно участвуют провоспалительные цитокины, под влиянием которых хрящ синтезирует протеолитические ферменты (матриксные протеиназы), разрушительно действующие на его коллаген и протеогликаны. Фактор некроза опухолей α (ФНО-α) стимулирует разрушение матрикса хряща и подавляет синтетические процессы в хондроцитах. Интерлейкин-1 (ИЛ-1) продуцируется синовиоцитами и хондроцитами при воспалительных реакциях и повреждении. Он стимулирует катаболизм матрикса, ингибирует синтез его молекул, приводит к усилению синтеза ферментов – металлопротеиназ, особенно коллагеназ, и повышает уровень оксида азота, а также тормозит синтез ингибиторов ферментов и подавляет продукцию основных компонентов матрикса – протеогликанов и коллагена. ИЛ-1 стимулирует пролиферацию фибробластов и синовиальных клеток.
Деструктивные цитокины непосредственно влияют на синтез ферментов и запускают лизосомальные механизмы клеточных повреждений. Деградация компонентов межклеточного матрикса зависит от действия нейтральных металлопротеиназ, таких как стромелизин, коллагеназа, желатиназа. Предполагается, что при ОА имеет место локальное нарушение баланса между продукцией металлопротеиназ и их тканевыми ингибиторами. Протеиназы проявляют большую разрушительную активность в присутствии активных кислородных радикалов, которые, в свою очередь, подавляют активность естественных ингибиторов протеиназ.
Доказанным подтверждением воспалительных процессов при ОА является накопление в хондроцитах циклооксигеназы-2 (ЦОГ-2) – фермента, определяющего интенсивность воспаления.
Наряду с описанными механизмами при ОА изменяется фенотип хондроцитов, в результате чего клетки синтезируют «короткий» коллаген и протеогликаны с меньшей молекулярной массой, которые не способны формировать аггреканы с гиалуроновой кислотой. Это приводит к потере биомеханических свойств матрикса хряща. Более того, предполагается, что молекулы, потерявшие свои функции, становятся чужеродными для организма. Они, а также продукты распада коллагена и хондроцитов приобретают антигенные свойства и могут индуцировать аутоиммунное воспаление, способствующее дальнейшему развитию дегенеративных изменений в суставном хряще и поддержанию синовиального воспаления.
В развитии синовита при ОА продемонстрировано участие фагоцитирующих лейкоцитов. В суставной полости некротизированные и костные фрагменты подвергаются фагоцитозу с высвобождением медиаторов воспаления, что клинически ассоциируется с синовитом. Экссудативно-пролиферативный характер воспаления обусловливает фиброзно-склеротические изменения в околосуставных тканях. Развиваются умеренная пролиферация и гиперплазия синовиальных клеток, происходит диффузное разрастание фиброзной ткани в субсиновиальном слое и капсуле сустава. С внедрением в практику артроскопии были получены доказательства неблагоприятной роли синовита в процессе прогрессирования деградации хряща при ОА. У 1/3 больных с рентгенологическими признаками ОА при артроскопии был выявлен не определяемый клинически синовит. При этом места воспаления синовиальной оболочки граничили с пораженным хрящом. Кроме того, показана экспрессия хемокинов, коллагеназ и стромелизина в участках синовита в суставах при ОА. Основные звенья патогенеза ОА приведены на рисунке 3.
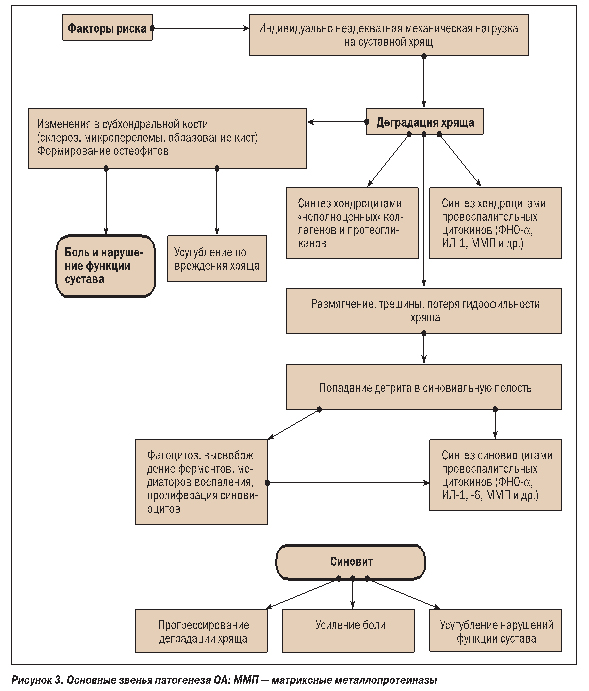
Клиническая картина и диагностика ОА
Клиническая картина ОА в большинстве случаев развивается исподволь. Чаще всего больной не может точно определить время начала и причину появившихся симптомов. В редких случаях клинические проявления ОА развиваются быстро после травмы и/или неадекватной физической нагрузки. Клиническая симптоматика ОА во многом определяется его локализацией, количеством вовлеченных в процесс суставов, индивидуальным порогом болевой чувствительности. В таблице 1 представлен ряд характерных клинических проявлений ОА.
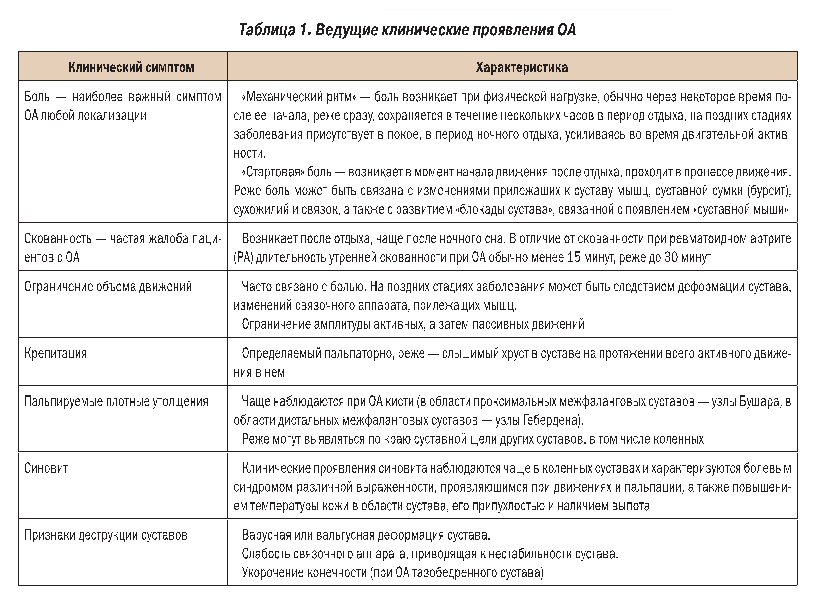
Наряду с оценкой клинических симптомов в диагностике ОА используются различные методы исследования, как инвазивные (артроскопия, биопсия синовиальной оболочки), так и неинвазивные (рентгенография, ультрасонография, термография, сцинтиграфия, компьютерная рентгеновская томография, магнитно-резонансная томография). Несмотря на появление и развитие этих современных, перспективных в плане диагностики ОА методов, рентгенологическое исследование суставов остается наиболее распространенным исследованием в широкой клинической практике. Этот метод достаточно информативен, доступен, экономичен. Рентгенография позволяет выявить следующие изменения в суставе:
— сужение суставной щели;
— субхондральный остеосклероз;
— наличие остеофитов;
— участки оссификации суставной капсулы и связок;
— околосуставные краевые дефекты костной ткани;
— субхондральные кисты.
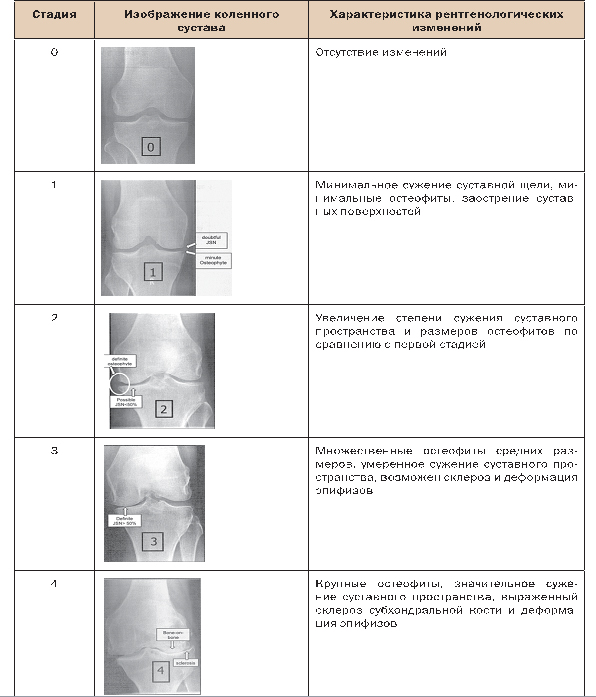
Для оценки тяжести структурных нарушений, т.е. определения рентгенологической стадии заболевания, традиционно используется классификация, предложенная J.H. Kellgren и J.S. Lawrence. По этой классификации стадии ОА определяются в основном степенью выраженности сужения суставной щели, наличием остеофитов и субхондрального склероза (табл. 2).
Таблица 2. Рентгенологические критерии ОА
Лабораторные методы исследования в диагностике ОА. Рутинные исследования крови и мочи неинформативны. При синовите возможно повышение уровней острофазовых показателей (скорость оседания эритроцитов – СОЭ, С-реактивный белок, гамма-глобулин, фибриноген и др.). В последние годы в связи с углублением представлений о патогенезе ОА ведется интенсивный поиск биологических маркеров заболевания. Сообщается о целесообразности изучения в крови, моче и синовиальной жидкости пациентов с ОА уровней таких параметров, как хрящевой олигомерный матриксный протеин, участки (эпитопы) кератансульфата, гиалуроновая кислота, N-пропептид коллагена III типа, С-пропептид коллагена II типа, уровни провоспалительных цитокинов и металлопротеиназ. Однако диагностическая значимость каждого из этих биологических маркеров остается до конца не уточненной и требует дальнейших клинических исследований.
Критерии диагностики. Классификация
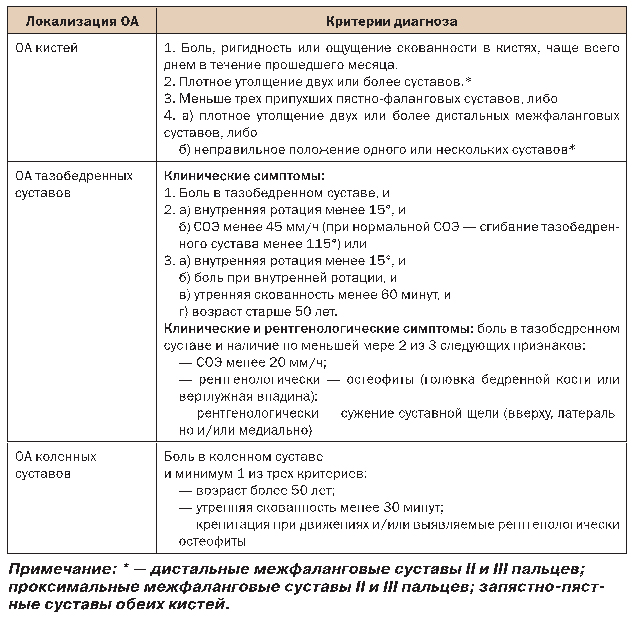
В таблице 3 представлены критерии диагностики ОА, использующиеся в широкой клинической практике.
Таблица 3. Критерии диагностики ОА кистей и тазобедренных суставов АРА и ОА коленных суставов АКР
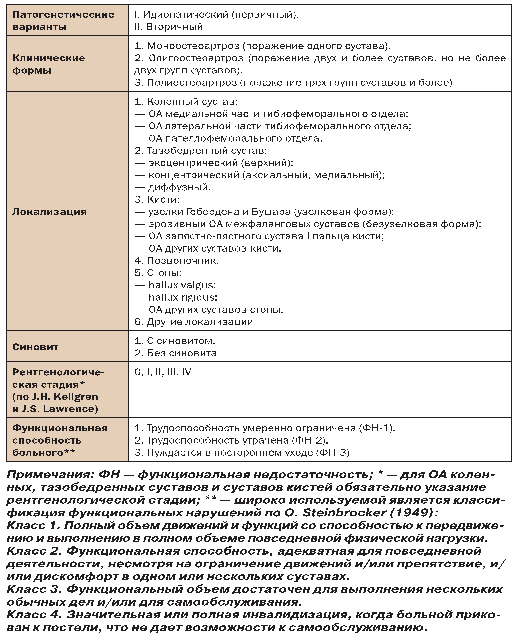
В современной клинической практике отсутствует унифицированный подход к терминологии и классификации ОА. Существует ряд классификационных подходов, каждый из которых имеет свои преимущества и недостатки. Мы сочли необходимым привести рабочую классификационную схему ОА, рекомендованную для практической работы (табл. 4).
Таблица 4. Рабочая классификация ОА
Пример формулировки диагноза
Первичный олигоостеоартроз с поражением левого тазобедренного сустава (концентрический), рентгенологическая стадия III , обоих коленных суставов (латеральных тибиофеморальных отделов), рентгенологическая стадия II . Синовит правого коленного сустава. ФН-1.
Лечебные подходы
Течение ОА длительное, хроническое, прогрессирующее, с неуклонным нарастанием симптомов, связанных с ограничением функции суставов. Часто в течении заболевания отмечаются периоды обострения (активности), сопровождающиеся усилением болевого синдрома, явлениями синовита, сменяющиеся периодами ремиссии под влиянием адекватной терапии. Прогноз при ОА оценивается как неблагоприятный, особенно при поражении коленных и тазобедренных суставов. Так, ОА коленных суставов в течение 5–15 лет приводит к тяжелым функциональным нарушениям примерно у 10% лиц старше 50 лет, 1/4 часть которых нуждается в посторонней помощи для выполнения повседневных нагрузок. Кроме того, наличие ОА существенно влияет на качество жизни больных. Так, показано, что частые обострения и высокая клиническая активность ОА, связанная как с отсутствием или прекращением лечения, так и с другими причинами, приводит к значительному снижению качества жизни пациентов. В то же время на фоне проведения адекватной терапии ОА, напротив, наблюдается отчетливое снижение показателей активности заболевания и улучшение параметров качества жизни больных.
Стратегические подходы к лечению ОА коленных и тазобедренных суставов имеют некоторые отличия и включают фармакологические, нефармакологические и хирургические методы. Лечебный эффект во многом зависит от локализации ОА, наличия факторов риска и их характера.
Литературные сведения об эффективности того или иного метода лечения ОА неоднозначны. Рекомендации по лечению этого заболевания были представлены Королевским врачебным обществом и Американской коллегией ревматологов. EULAR была сформирована комиссия по проблемам лечения ОА; ею были опубликованы рекомендации по ведению пациентов с ОА коленных, тазобедренных суставов и суставов кистей в виде 10 основных лечебных подходов.
Сегодня мы не располагаем рекомендациями по ведению пациентов с ОА других локализаций, но, по всей вероятности, эти лечебные подходы близки таковым при ОА коленных, тазобедренных суставов и суставов кистей.
В связи с тем что ограничение физических возможностей пациентов с ОА связано в первую очередь с болью и нарушениями функции суставов, что ведет к снижению качества жизни, а также повышает риск дальнейшего прогрессирования заболевания, современные кардинальные лечебные мероприятия направлены на уменьшение или ликвидацию этих симптомов и замедление их прогрессирования.
Стратегические подходы к лечению ОА:
– обучение больных (разъяснение относительно сущности заболевания и методов его лечения);
– снятие или облегчение боли;
– уменьшение степени функциональной недостаточности, снижение риска инвалидизации пациентов;
– замедление или прекращение прогрессирования заболевания.
Основные методы лечения ОА, использующиеся сегодня, включают:
1. Нефармакологические мероприятия: обучение пациентов, дозированная физическая активность, изменение стиля жизни.
2. Фармакологические подходы (системные и местные).
3. Инвазивные вмешательства: внутрисуставные инъекции, лаваж сустава, артропластика и др.
Мы сочли необходимым в полном объеме изложить опубликованные рекомендации экспертов EULAR по ведению больных с ОА коленных суставов, тазобедренных суставов и суставов кистей. В связи со схожестью большинства лечебных подходов у этих групп пациентов мы представляем рекомендации в обобщенном виде.
Рекомендации экспертов EULAR по ведению пациентов с ОА коленных суставов, тазобедренных суставов и суставов кистей:
1. Оптимальное лечение ОА требует сочетания нефармакологических и фармакологических методов лечения.
2. Выбор оптимального лечебного режима должен базироваться на оценке факторов риска (тучность, неблагоприятные механические факторы, физическая активность, возраст, сопутствующие заболевания, прием различных медикаментов, пол, наличие дисплазии – для тазобедренных суставов), характера болевого синдрома, локализации поражения, степени функциональных нарушений, наличия выпота в полости сустава.
3. Нефармакологические подходы включают в себя: обучение пациентов, снижение массы тела (в случае тучности), лечебную физкультуру, уменьшение механической нагрузки (наколенники, трости, костыли, ортопедическая обувь, шины (при ОА кистей)).
4. В качестве терапии первого шага необходимо использовать парацетамол в дозе до 4 г в сутки. Парацетамол – нестероидный противовоспалительный препарат с мощным жаропонижающим и анальгезирующим действием. Однако он обладает достаточно слабой противовоспалительной активностью. Имеются данные, что эффективность парацетамола в отношении боли при ОА сравнима с таковой ЦОГ-2-неселективных нестероидных противовоспалительных препаратов (НПВП), а его профиль безопасности лучше, чем последних. В случае благоприятного клинического эффекта парацетамол может использоваться самостоятельно.
5. Местные аппликации (например, НПВП, капсаицина) клинически эффективны (для ОА коленных суставов и суставов кистей).
6. Возможность применения НПВП (самостоятельно или в комбинации с парацетамолом) рассматривается у больных, недостаточно отвечающих на терапию парацетамолом. У пациентов с повышенным риском поражения желудочно-кишечного тракта следует использовать ЦОГ-2-неселективные НПВП в сочетании с эффективными гастропротекторами или селективные ингибиторы ЦОГ-2 – коксибы.
7. Опиоидные анальгетики – альтернатива для больных, которым НПВП, включая селективные ингибиторы ЦОГ- 2, противопоказаны, у которых они неэффективны или плохо переносятся.
8. SYSADOA (Symptomatic slow-acting drugs for osteoarthritis) – генерический термин, используемый для медленнодействующих агентов, применяемых с целью уменьшения (устранения) боли и хондропротекции (в течение последних лет эффективность хондропротекторов всех видов рассматривается как не доказанная в крупных рандомизированных исследованиях).
9. Внутрисуставное введение глюкокортикоидов (ГК) продленного действия показано при приступах выраженной боли в тазобедренном суставе, боли и/или выпоте в коленном суставе и суставах кистей. Этот метод показан при неэффективности парацетамола и/или НПВП, и/ или опиоидных анальгетиков, и/или при наличии выраженного выпота.
10. Суставсохраняющие хирургические вмешательства на тазобедренных суставах следует рассматривать у молодых пациентов, особенно при наличии дисплазии и varus- или valgus-деформаций.
11. Эндопротезирование коленного или тазобедренного суставов рассматривается при наличии выраженных рентгенологических изменений в них, в сочетании с рефрактерной болью и тяжелыми функциональными нарушениями.
Характеристика некоторых фармакологических средств и лечебных режимов, используемых при остеоартрозе
Локальная терапия ОА
Различают несколько видов локальной терапии (ЛТ): 1) аппликационная терапия; 2) применение физических факторов; 3) инъекции лекарственных препаратов.
Один из широко распространенных методов ЛТ — аппликационное применение лекарственных препаратов, что обусловлено простотой процедур. Существуют общие требования для локально назначаемых веществ. Местно применяемый препарат должен обладать достаточной эффективностью, не вызывать местных токсических и аллергических реакций, иметь хорошую проникающую способность, но при этом его концентрация в сыворотке крови не должна достигать уровней, при которых возникают системные побочные эффекты. При аппликационном использовании предполагается создание терапевтических концентраций в тканях, вовлеченных в патологический процесс, в месте нанесения. Недостатком аппликационной ЛТ является невысокая концентрация лекарственных средств, поступающих в пораженные ткани. Степень проникновения препарата зависит от его липофильности и правильного увлажнения рогового слоя эпидермиса и ограничивается барьерной функцией кожных покровов. Обоснованным представляется использование гелей, мазей и спреев, содержащих НПВП (индометацин, диклофенак и др.). Для получения клинического эффекта необходимо применять их достаточно длительно, соблюдать кратность аппликаций, наносить на кожу достаточное количество препарата. В ряде плацебо-контролируемых исследований продемонстрирована хорошая эффективность местно применяемых НПВП и достаточная их безопасность. У больных с наличием факторов риска развития НПВП-гастропатии следует использовать ингибиторы протонной помпы (ИПП).
Широко применяемые методы физиотерапевтического лечения ОА направлены на уменьшение болевого синдрома, мышечного спазма, воспаления, улучшение микроциркуляции, трофики, метаболических процессов в тканях сустава. При ОА по индивидуальным показаниям могут быть использованы ультрафиолетовое облучение, электрическое поле ультравысокой частоты, переменные магнитные поля, электро- и фонофорез анальгетиков, димексида, импульсные токи, лазерное воздействие, тепловые процедуры, ванны, массаж и др. В ряде работ продемонстрирована хорошая эффективность таких физиотерапевтических методов, как магнитотерапия, ударно-волновая терапия, гальванотерапия, грязелечение для снятия или уменьшения боли. Однако эффективность физиотерапевтического лечения ОА недостаточно изучена в КРИ.
Для уменьшения болезненного мышечного спазма, повышения тонуса ослабленных групп мышц, усиления трофики пораженных суставов, улучшения функциональной способности пациента используется лечебная физкультура, которая осуществляется по принципу «легкая динамическая нагрузка при полной статической разгрузке». На начальных стадиях заболевания больным показаны занятия плаванием, велосипедным спортом.
Локальная инъекционная терапия. Методика внутрисуставного введения глюкокортикоидов (ГК) в ряде исследований продемонстрировала их преимущество перед плацебо в отношении уменьшения боли и проявлений воспаления, однако этот эффект различен по продолжительности, составляя 1–3 недели, по данным разных авторов. Для внутрисуставного введения сегодня используются препараты ГК пролонгированного действия: триамцинолона ацетат, метилпреднизолона ацетат, комбинация бетаметазона динатрия фосфата и бетаметазона дипропионата. Необходимо отметить, что неоправданное внутрисуставное введение ГК чревато развитием ряда таких серьезных осложнений, как остеопороз и костно-хрящевая деструкция, гемартроз, инфицирование полости сустава, атрофия кожи в области сустава, околосуставные кальцификаты. В связи с этим подход к выбору внутрисуставных инъекций ГК при ОА должен быть серьезно взвешен, а кратность их не должна превышать одного введения в 3 месяца.
Системные НПВП
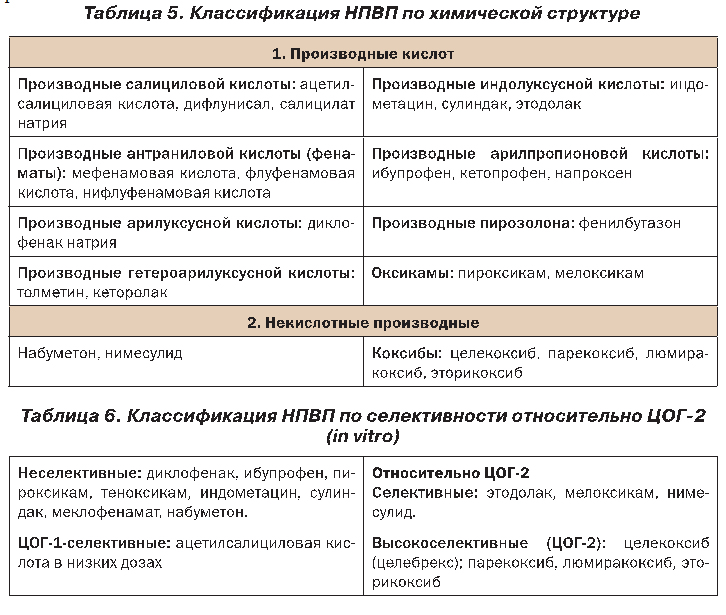
НПВП представляют большую группу лекарственных препаратов, отличающихся по химической структуре и фармакокинетическим свойствам (табл. 5, 6), но близких по механизму действия и клиническим эффектам.
Эффективность различных НПВП при ОА, ревматоидном артрите и других заболеваниях продемонстрирована во многих крупных КРИ, причем существенных отличий в эффективности в отношении боли, скованности, ограничении активности пациентов между разными представителями ЦОГ-2-селективных и ЦОГ-2-неселективных препаратов не показано.
Однако применение традиционных ЦОГ-2-неселективных НПВП у больных с ОА сопряжено с высоким риском развития побочных эффектов. Во-первых, большинство пациентов с ОА нуждаются в постоянном (возможно с интервалами) их приеме; во-вторых, среди больных с ОА высокий удельный вес составляют лица пожилого возраста, которые страдают различными сопутствующими заболеваниями, нередко обусловливающими нарушение функции жизненно важных органов и требующими применения различных классов лекарственных средств; в-третьих, людям пожилого возраста присуще возрастное снижение скорости клубочковой фильтрации и почечного кровотока, а также снижение функции гепатоцитов.
Поражение желудочно-кишечного тракта (ЖКТ) занимает ведущее место среди побочных эффектов ЦОГ-2-неселективных НПВП, причем их частота превышает таковую других классов лекарственных препаратов. Характер этих поражений варьирует от легкого до тяжелого, в том числе и жизнеопасного, что представлено в таблице 7.
Легкие поражения ЖКТ, которые включают диспепсию и гастродуоденальные эрозии, развиваются у 10–20% больных, использующих НПВП. Тяжелые поражения ЖКТ, такие как перфорации, язвы, кровотечения, развиваются на протяжении одного года применения традиционных НПВП приблизительно у 7,3 из 1000 больных с ОА.
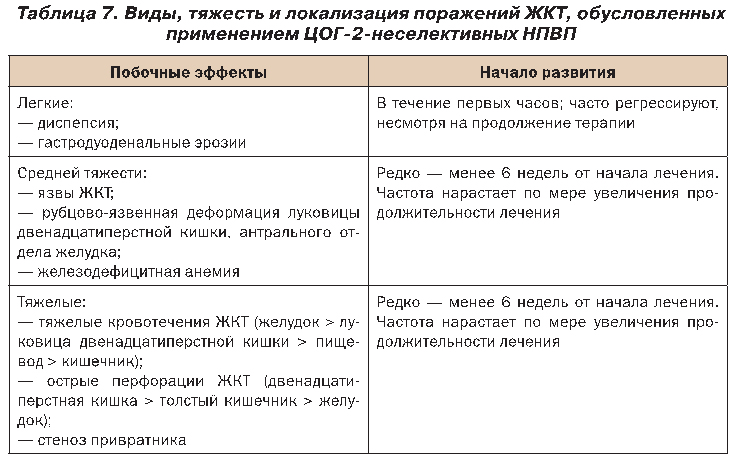
Развитию НПВП-обусловленных гастродуоденальных перфораций, язв и кровотечений способствует целый ряд факторов, которые необходимо учитывать при назначении НПВП, а также при необходимости проведения гастропротекторной терапии и выборе ее вида.
Факторы риска развития НПВП-обусловленных гастродуоденальных перфораций, язв, кровотечений:
1. Установленные:
– возраст старше 60 лет;
– тяжесть основного заболевания;
– наличие язв, перфораций, кровотечений в анамнезе;
– противоязвенная терапия в анамнезе;
– НПВП-гастропатии в анамнезе;
– высокие дозировки НПВП;
– одновременный прием: глюкокортикоидов, антикоагулянтов, двух НПВП (в том числе и ацетилсалициловой кислоты).
2. Возможные:
– наличие Helicobacter pylori (НР);
– продолжительность применения НПВП;
– женский пол;
– курение;
– злоупотребление алкоголем.
Приведенные выше данные о частоте и характере поражений ЖКТ касаются ЦОГ-2-неселективных НПВП, ингибирующих обе изоформы ЦОГ (т.е. ЦОГ-1 и ЦОГ-2). Угнетение ЦОГ-1 в слизистой ЖКТ НПВП рассматривается как ведущий механизм развития НПВП-гастропатий.
Механизмы повреждения ЖКТ, обусловленные применением ЦОГ-2- неселективных НПВП, являются сложными и многофакторными, однако ведущая роль отводится угнетению ЦОГ-1 в слизистой ЖКТ. В связи с этим был создан и получил широкое применение класс НПВП, подавляющих преимущественно ЦОГ-2 при сохранении активности ЦОГ-1 (коксибы), что уменьшает токсичное влияние на ЖКТ.
В ряде крупных КРИ продемонстрированы преимущества ЦОГ-2-селективных НПВП относительно гастроинтестинальной безопасности в сравнении с традиционными.
Для снижения частоты и тяжести НПВП-гастропатий и их устранения рекомендуются следующие подходы:
1. Установление факторов риска НПВП-гастропатий, устранение или снижение их неблагоприятного влияния.
2. При наличии 2 и более факторов риска малоприемлемо использование НПВП. При необходимости возможно применение ЦОГ-2-селективных НПВП и протекция гастродуоденальной слизистой – использование ИПП.
3. При выявлении НПВП-гастродуоденальных язв – отмена НПВП, назначение ИПП. Применение ИПП в ряде случаев нередко позволяет продолжить терапию НПВП. Предпочтение отдается ЦОГ-2-селективным НПВП.
4. Коллоидный субцитрат висмута в схемах терапии эрозивно-язвенных поражений ЖКТ:
– оказывает бактерицидное действие на НР;
– ингибирует активность пепсина, что аккумулирует эпидермальные факторы роста в области язвы;
– образует защитную пленку на поверхности язв, что способствует их рубцеванию/эпителизации;
– увеличивает синтез РgЕ2, что стимулирует образование желудочной слизи и секреции бикарбоната и защищает слизистую оболочку желудка.
Включение в схему терапии НПВП-гастропатий коллоидного субцитрата висмута способствует ускорению процессов заживления слизистой оболочки гастродуоденальной зоны.
5. При наличии множественных гастродуоденальных эрозий рекомендуется использовать синтетический аналог РgЕ1 мизопростол или ИПП.
6. Взаимоотношения между НПВП и HP, являющиеся факторами риска гастродуоденальных язв, комплексные и противоречивые. В консенсусе по лечению НР-инфекции отмечается:
– эрадикация НР показана больным, длительно принимающим НПВП, но она полностью не предотвращает образования НПВП-язв;
– перед началом длительной НПВП-терапии показано тестирование на НР, в случае положительного результата – эрадикационная терапия для предотвращения пептических язв и/или кровотечений;
– больные, длительно получающие ацетилсалициловую кислоту, при наличии кровотечений должны быть тестированы на НР и получать эрадикационную терапию при положительном результате.
В отличие от НПВП-гастропатий, НПВП-энтеропатии не были восприняты как важная клиническая проблема, хотя тонкий кишечник (ТК) более чувствителен к неблагоприятным эффектам НПВП, а частота их серьезных последствий не уступает таковым при НПВП-гастропатиях. Так, по секционным данным, неспецифические ульцерации ТК выявлялись у 8,4% больных, получавших НПВП, по сравнению с 0,6% лиц, не принимавших НПВП.
Патогенез НПВП-энтеропатий носит мультифакторный характер. Комбинация биохимических процессов (ингибиция ЦОГ-1 и ЦОГ-2) и местных эффектов приводит к нарушению клеточной интеграции слизистой ТК, что обусловливает повышение эпителиальной проницаемости и экспозиции слизистой к бактериям, продуктам их деградации, желчным кислотам и др. Развивается воспаление слизистой ТК, сопровождающееся потерями белка, формированием эрозий, язв, возникновением кровотечений с исходом в фиброз и развитием локальной обструкции. Показана зависимость частоты и тяжести поражения ТК от дозы НПВП.
Клинические проявления НПВП-энтеропатии могут быть как легкими, так и тяжелыми, нередко жизнеопасными. К легким проявлениям НПВП-энтеропатии относятся:
– хронический дефицит железа с развитием железодефицитной анемии (следствие перманентных и легких кровотечений ≈ 2–10 мл в сутки кровопотери);
– потери белка (приблизительно у 10% больных – снижение сывороточного альбумина).
К тяжелым проявлениям НПВП-энтеропатии относятся:
— кровотечения (многие из них не ассоциированы с язвами), частота которых близка к таковой из желудка и двенадцатиперстной кишки;
— перфорации;
— язвы, эрозии;
— обструкции, обусловленные фиброзом язв;
— увеличение летальности.
Влияние ЦОГ-2-неселективных и ЦОГ-2-селективных НПВП на частоту и тяжесть развития НПВП-энтеропатии требует проведения дальнейших исследований, однако, как показано в кратковременных клинических испытаниях и исследованиях на добровольцах, ЦОГ-2-селективные агенты более безопасны для ТК, чем ЦОГ-2-неселективные НПВП.
Сегодня в литературе отсутствуют основанные на данных крупных исследований рекомендации в отношении профилактики и лечения НПВП-энтеропатий. ИПП снижают частоту и уменьшают тяжесть НПВП-гастропатий, но оставляют ТК уязвимым при использовании НПВП.
Участие ЦОГ-2 в регуляции разных почечных функций в физиологических условиях стало основанием для предположения о возможности развития побочных эффектов со стороны почек при использовании НПВП. Это предположение потребовало проведения многочисленных клинических и экспериментальных исследований, результаты которых позволяют говорить о преимуществах ЦОГ-2-селективных препаратов перед неселективными относительно нефротоксичности (в том числе неблагоприятного влияния на клубочковую фильтрацию). В связи с этим при наличии факторов риска нужно отдавать предпочтение коксибам. Но, учитывая все преимущества коксибов, нельзя не согласиться с существующей сегодня точкой зрения о необходимости дальнейших исследований в этом направлении.
Влияние НПВП на сердечно-сосудистую систему изучено недостаточно. Последние годы характеризуются нарастающим интересом к повышенному риску кардиоваскулярных осложнений, включая инфаркты миокарда и инсульты, при применении НПВП. Представляют интерес данные мета-анализа, опубликованного в 2011 г. Было проанализировано 31 исследование, в которые вошли 116 429 больных, получавших различные НПВП. Авторы делают вывод, что проанализированные НПВП (напроксен, ибупрофен, диклофенак, целекоксиб, эторикоксиб, рофекоксиб, люмиракоксиб) небезопасны в отношении кардиоваскулярных осложнений и следует учитывать сердечно-сосудистый риск при назначении любого НПВП.
В заключение рассмотрения вопроса безопасности применения НПВП считаем уместным привести выдержки из заключений FDA (Food and Drug Administration USA) и EMA (European Medicines Agency), касающихся применения НПВП. FDA: кардиоваскулярный риск присущ всем НПВП (исключение – ацетилсалициловая кислота в низких дозах). ЕМА: нельзя исключить кардиоваскулярный риск для ЦОГ-2-неселективных НПВП. Оба агентства: кардиоваскулярный риск, ассоциируемый с ЦОГ-2-неселективными НПВП и коксибами, повышается с увеличением дозировок и продолжительности лечения. Следовательно, следует использовать минимальные эффективные дозы с наиболее короткими периодами экспозиции.
Парацетамол
В последние пять десятилетий парацетамол является одним из наиболее широко используемых в качестве жаропонижающего и анальгезирующего средства препаратов. Его противовоспалительная активность оценивается как слабая.
Механизм действия парацетамола остается предметом дискуссий. На протяжении длительного времени доминировала точка зрения о центральном действии препарата, а его способность ингибировать ЦОГ-1 и ЦОГ-2 в периферических тканях считалась малозначимой. В связи с этим в широкой клинической практике парацетамол рекомендовался в качестве альтернативы традиционным НПВП и коксибам. Однако в последние годы в ряде экспериментальных и клинических исследований был показан отчетливый ингибиторный эффект препарата на центральные и периферические циклооксигеназные энзимы. Результаты этих исследований свидетельствуют о преуменьшении риска развития побочных эффектов (в том числе гастроинтестинальных и кардиоваскулярных) при использовании парацетамола, особенно в высоких дозировках (более 2 г/сут) и в комбинации с НПВП. В связи с этим при лечении парацетамолом (как и в случае с НПВП) следует учитывать наличие у пациента желудочно-кишечных, кардиоваскулярных, почечных и печеночных факторов риска развития побочных эффектов, использовать минимально эффективные дозировки препарата и избегать его комбинации с НПВП.
Очевидно, в свете приведенных данных следует критически оценить рекомендации экспертов EULAR по ведению больных с ОА различной локализации (приведенные выше) относительно дозировок парацетамола до 4 г/сут и возможности его комбинации с НПВП.
Медленнодействующие симптоматические средства для лечения ОА
Термином SYSADOA обозначается группа препаратов, обладающих медленно развивающимся клиническим эффектом (уменьшение боли и воспаления, улучшение функции сустава), а также благоприятно влияющих на метаболизм суставного хряща, что было продемонстрировано в исследованиях in vitro и in vivo. К этой группе относятся глюкозамина сульфат и его производные, хондроитинсульфат, диацерин, гиалуроновая кислота, неомыляющиеся соединения авокадо и сои, экстракт имбиря и др. Отметим, что в Рекомендациях OARSI 2014 г., касающихся не-хирургического лечения ОА коленных суставов, эффективность всех этих препаратов квалифицирована как недостаточно установленная и недостаточно изученная. Констатируется высокая гетерогенность данных имеющихся исследований и нередко их недостаточно представительный характер. Тем не менее, использование SYSADOA пока признается возможным при ОА в качестве одного из вспомогательных лечебных подходов (с недоказанной эффективностью).
Глюкозамин – естественный компонент суставного хряща. При пероральном применении обладает хорошей биодоступностью и тропностью к суставному хрящу. Полагают, что фармакологические эффекты глюкозамина заключаются в стимуляции синтеза протеогликанов хондроцитами, угнетении действия катаболических ферментов, таких как стромелизин, коллагеназа, фосфолипаза А2 и аггрекиназа, угнетении образования супероксидных радикалов, угнетении синтеза оксида азота и активности лизосомальных ферментов, снижении содержания ИЛ-1β в синовиальной жидкости. Синтез простагландинов глюкозамин не угнетает. В ряде исследований продемонстрирована клиническая эффективность препарата. Побочные эффекты были преходящими, слабо выраженными и проявлялись дискомфортом или болью в области желудка, запором, диареей, метеоризмом, тошнотой. Изредка возникали явления гиперчувствительности в виде зудящей кожной сыпи, эритемы.
Хондроитин – гликозаминогликан, локализующийся во внеклеточном матриксе суставного хряща. При приеме внутрь он хорошо абсорбируется и обнаруживается в высоких концентрациях в синовиальной жидкости. В исследованиях in vitro показано, что хондроитин обладает противоспалительной активностью, стимулирует синтез гиалуроновой кислоты и протеогликанов, угнетает действие протеолитических ферментов. В ряде некрупных контролируемых исследований продемонстрирована клиническая эффективность хондроитинсульфата (улучшение подвижности сустава, уменьшение боли, снижение потребности в НПВП), превосходящая эффект плацебо. При этом побочные эффекты были сравнимы с таковыми плацебо.
Гиалуроновая кислота представляет собой природный фактор, принимающий участие в трофике суставного хряща. Она может быть использована для лечения ОА при неэффективности или непереносимости других видов лечения.
Диацереин – дериват антрахинона, способный угнетать продукцию ИЛ-1, ИЛ-6, ФНО-α и лейкемического ингибирующего фактора, уменьшать количество рецепторов активатора плазминогена на синовиоцитах и хондроцитах, что приводит к угнетению превращения плазминогена в плазмин, снижает образование оксида азота, в результате уменьшает продукцию матриксных металлопротеиназ, угнетает высвобождение лизосомальных ферментов, стимулирует синтез протеогликанов, гликозаминогликанов, гиалуроновой кислоты.
Экстракт имбиря – уменьшает образование медиаторов воспаления (простагландинов и лейкотриенов) за счет угнетения циклооксигеназы-2 и 5-липооксигеназы, что приводит к уменьшению боли и признаков воспаления. Данные лабораторных исследований продемонстрировали также способность экстракта восстанавливать нормальный метаболизм суставного хряща. В культуре хондроцитов и синовиоцитов человека компоненты препарата демонстрировали способность подавлять продукцию ИЛ-1β и ФНО-β – цитокинов, стимулирующих процессы деградации суставного хряща.
В заключение необходимо отметить, что, несмотря на успехи в области изучения патогенетических механизмов ОА, методов диагностики и лечения, остается множество вопросов, требующих проведения дополнительных исследований.







