Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ВНЕЗАПНАЯ СЕРДЕЧНАЯ СМЕРТЬ У ДЕТЕЙ: ПРИЧИНЫ И ВОЗМОЖНЫЕ ПУТИ ПРОФИЛАКТИКИ"
Автор: Пшеничная Е.В.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Кардиология, Педиатрия/Неонатология, Семейная медицина/Терапия
Просмотров: 4 816
Дата проведения: с 09.11.2014 по 09.11.2015
Рекомендован : педиатрам, семейным врачам, детским кардиологам, детским неврологам, неонатологам.
Актуальность проблемы . Внезапная смерть составляет около 5% от всех случаев смерти детей (частота от 1,5 до 8,0 на 100000 в год). По расчетам от 5000 до 7000 внешне здоровых детей в США ежегодно умирают внезапно. При этом у спортсменов внезапная сердечная смерть регистрируется у 1 из 50000-100000 чел. Среди детей, занимающихся спортом, ежегодно от внезапной сердечной смерти погибает 1 из 200 тыс. (D. Driscoll, 1985; B. Maron, 1998). По данным патологоанатомических исследований, на ВСС приходится 2,3% умерших в возрасте до 22 лет и 0,6% – в возрасте от 3 до 13 лет. У детей с сердечной патологией частота ВСС составляет от 1 до 13 на 100 тыс. чел.
Несмотря на значительные усилия, прилагаемые в мире для решения проблемы внезапной сердечной смерти на протяжении последних 30 лет, достигнуть значительных успехов в аспектах ее прогноза и профилактики до настоящего времени не удалось. Непредвиденные смертельные случаи иногда происходят при драматических обстоятельствах и часто имеют медицинские и юридические последствия. Некоторые из этих смертей непредсказуемы и не предотвратимы в настоящее время, однако во многих случаях имеются настораживающие клинические симптомы, отягощенный семейный анамнез по внезапной смерти в молодом возрасте, изменения на электрокардиограмме. Ребенок с действительно здоровым сердцем не имеет риска наступления внезапной сердечной смерти. Важной задачей является идентификация детей внешне здоровых, однако имеющих различные аномалии сердечно-сосудистой системы и риск внезапной сердечной смерти.
Общая цель: усовершенствовать знания и умения по диагностике заболеваний, сопряженных с риском внезапной сердечной смерти, оказанию неотложной помощи при клинических проявлениях внезапной сердечной смерти.
Конкретные цели: выделить основные факторы риска внезапной сердечной смерти у детей, составить план обследования больного, перенесшего клиническую смерть или угрожаемого по ее развитию, поставить наиболее вероятный клинический диагноз заболевания, имеющего риск внезапной сердечной смерти и составить план адекватных лечебно-профилактических мероприятий, знать и уметь провести сердечно-легочную реанимацию.
Содержание обучения
Теоретические вопросы
1. Определение термина «внезапная сердечная смерть».
2. Классификация и характеристика заболеваний, сопряженных с риском внезапной сердечной смерти.
3. Клинические признаки внезапной сердечной смерти.
4. Принципы сердечно-легочной реанимации у детей.
5. Методы обследования детей, перенесших внезапную сердечную смерть.
6. Меры профилактики внезапной сердечной смерти у детей.
Ориентировочная основа деятельности
Во время подготовки к занятию необходимо ознакомиться с основными теоретическими вопросами с помощью источников литературы.
ТЕРМИНОЛОГИЯ, КЛАССИФИКАЦИЯ
Термином «внезапная сердечная смерть» (ВСС) принято обозначать случай смерти лица, находившегося до этого в физиологически и психологически стабильном состоянии, наступивший в пределах 1 часа от начала острых проявлений заболевания, при отсутствии признаков, позволяющих поставить другой диагноз.
В МКБ-10 ВСС имеет следующие коды:
I 46.1 – Внезaпнaя сердечнaя смерть.
I 44 – I 45 – Внезaпнaя сердечнaя смерть при нaрушении проводимости.
I 21 – I 22 – Внезaпнaя сердечнaя смерть при инфaркте миокaрдa.
Среди лиц молодого возраста внезапная смерть наступает в 20% случаев во время занятий спортом, в 30% – во время сна, в 50% – при различных обстоятельствах в период бодрствования. Основные механизмы ВСС полностью не раскрыты, хотя некоторые этапы тонатогенеза достаточно ясны. Непосредственной причиной смерти у детей старшего возраста и у детей с органической патологией независимо от возраста в 80% случаев является фибрилляция желудочков, чаще всего спровоцированная желудочковой тахикардией, реже – брадикардией и асистолией, в младших возрастных группах в 88% первично регистрируется асистолия.
Внезапная сердечная смерть у детей представлена:
1) синдромом внезапной смерти младенцев;
2) ВСС у детей с известными сердечными заболеваниями;
3) ВСС у детей, считающихся здоровыми, когда жизнеугрожающее состояние является первым симптомом болезни.
Внезапная смерть как исход сердечно-сосудистой патологии занимает особый раздел кардиологии. Предрасполагающими факторами, способствующими появлению жизнеугрожающего состояния, могут быть:
1. Врожденная патология сердечно-сосудистой системы:
а) врожденные пороки сердца (до и после хирургической коррекции);
б) фиброэластоз эндокарда;
в) диспластические изменения мышечно-клапанных структур сердца (пролапсы клапанов, аритмогенная дисплазия правого желудочка, аневризмы сосудов).
2. Приобретенная патология сердечно-сосудистой системы:
а) миокардит;
б) приобретенный порок сердца;
в) гипертрофическая кардиомиопатия.
3. Ишемические поражения миокарда в результате:
а) аномалии коронарной артерии;
б) спазм коронарной артерии;
в) тромбоз коронарной артерии;
г) аневризмы сосудов.
4. Нарушение возбудимости и проводимости миокарда:
а) WPW-синдром с развитием жизнеугрожающих аритмий;
б) синдром укороченного интервала PQ;
в) синдром удлиненного интервала QT;
г) аритмии с наличием желудочковых экстрасистол;
д) внутрижелудочковые блокады.
ХАРАКТЕРИСТИКА ЗАБОЛЕВАНИЙ, СОПРЯЖЕННЫХ С РИСКОМ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ У ДЕТЕЙ
Внезапная сердечная смерть вследствие врожденных структурных заболеваний сердца с высокой частотой регистрируется в детской популяции и составляет около 5% от всех летальных случаев среди детей. Из пациентов с врожденными пороками сердца (ВПС) наибольшему риску подвержены те, у которых структурные аномалии сердца не могут быть полностью исправлены хирургическим путем. Резидуальные дефекты проявляются перегрузкой давлением и объемом правого и левого желудочков, при этом пораженные камеры становятся дисфункциональными и склонными к жизнеугрожающим аритмиям.
К врожденным порокам сердца, имеющим высокую степень риска развития синдрома внезапной смерти, относятся: тетрада Фалло, стеноз аорты, транспозиция крупных артерий. Кроме того, наибольшему риску подвержены пациенты с высокой легочной гипертензией (первичная легочная гипертензия или синдром Eisenmenger).
Тетрада Фалло составляет 14-15% всех врожденных пороков сердца. Для тетрады Фалло характерны: стеноз устья легочного ствола, дефект межжелудочковой перегородки, смещение аорты вправо и расположение ее устья над дефектом межжелудочковой перегородки, гипертрофия стенки правых отделов сердца. Пациенты с тетрадой Фалло, которым была сделана восстановительная операция, имеют риск внезапной смерти 6% в период от 3 месяцев до 20 лет. Внезапная смерть наступает чаще всего у пациентов с существенными резидуальными гемодинамическими нарушениями, такими как резидуальная обструкция оттока из правого желудочка с развитием правожелудочковой гипертензии, легочная недостаточность с перегрузкой объема правого желудочка, резидуальный межжелудочковый дефект или дисфункция правого или левого желудочка. ВСС при тетраде Фалло объясняют развитием желудочковой аритмии. Современные методики хирургической коррекции в более молодом возрасте могут минимизировать прогрессирование вентрикулярной гипертрофии, образование рубца, служащего будущим субстратом для желудочковой аритмии. Благодаря применению этого подхода ВСС у пациентов с тетрадой Фалло регистрируется реже.
Транспозиция крупных артерий – врожденный порок сердца, при котором аорта выходит из анатомического правого желудочка и располагается вентральнее легочного ствола, а легочный ствол – из левого желудочка. Имеется дефект межпредсердной и межжелудочковой перегородки. Поздняя внезапная смерть у 2-8% пациентов после atrial-switch операции (Mustard или Senning) обычно вызвана дисфункцией синусового узла, в некоторых случаях – желудочковой тахиаритмией. Экстенсивная резекция в области предсердной проводящей ткани приводит к развитию фиброза, являющегося субстратом предсердной тахикардии. Предполагается, что механизм ВСС состоит в предсердной тахикардии с быстрой проводимостью к желудочкам. Риск ВСС при этом увеличивается с возрастом.
Паллиативное лечение при единственном функционирующем желудочке (операция Fontan) становится все более частым и успешным. В послеоперационном периоде достаточно часто возникают дисфункция синусового узла и предсердная тахиаритмия вследствие экстенсивной атриальной резекции с сопутствующим образованием рубца и высоким системным венозным давлением. ВСС обусловлена атриальной тахикардией с быстрым проведением через атриовентрикулярный узел.
Стеноз аорты – структурная аномалия, встречающаяся у 3-10% больных с пороками сердца. При сужении аорты увеличивается нагрузка на левый желудочек сердца, который постепенно гипертрофируется, с течением времени возникает сердечная недостаточность. При стенозе аорты ВСС обычно наступает у пациентов с тяжелой обструкцией оттока из левого желудочка, развитием стеноза коронарного устья и ишемии миокарда. Снижение градиента аортального клапана существенно уменьшает риск ВСС.
Синдром Эйзенменгера характеризуется развитием необратимой легочной гипертензии вследствие сброса крови слева направо. Причины: большие дефекты межжелудочковой и межпредсердной перегородок, большой диаметр открытого аортального протока, тетрада Фалло и ряд других врожденных пороков сердца. В настоящее время синдром Эйзенменгера вследствие ранней хирургической коррекции является редким заболеванием. У пациентов с некорригированным ВПС ВСС возникает из-за значительной необратимой легочной гипертензии. Риск ВСС при синдроме Эйзенменгера довольно высок – от 15 до 20%.
Синдром гипоплазии левого желудочка – группа аномалий развития сердца, характеризующаяся недоразвитием левого желудочка, атрезией или стенозом аортального и/или митрального клапанов и гипоплазией восходящей части аорты. Пациентам с этой патологией проводится операция Фонтена. В ходе хирургической коррекции производится разделение системной и легочной венозной циркуляции. Частота ВСС во время операции Фонтена составляет 5–7%.
Эндокардиальный фиброэластоз – заболевание, встречающееся у детей младшего возраста и характеризующееся утолщением эндокарда с пролиферацией эластических тканей. У детей старшего возраста заболевание носит эндомиокардиальный характер с фиброзным перерождением как эндокарда, так и миокарда. Эндокард повреждается в области выносящего тракта правого и/или левого желудочка, часто с вовлечением предсердно-желудочковых клапанов, что приводит к появлению регургитации. Верхушка желудочков может быть облитерирована массой тромботических или фиброзных тканей. Эндокардиальный фиброз служит причиной развития сердечной недостаточности и различных видов аритмии.
Гипертрофическая кардиомиопатия (ГКМП) распространена значительно больше, чем это признавалось раньше, встречаясь у 1 из 500 в популяции США. В Украине частота выявления ГКМП в популяции составляет 0,47%, чаще диагностируется у мальчиков старше 10 лет. По данным британских ученых, более чем в 50% случаев это заболевание выявляется у других членов семьи. Ежегодно внезапная сердечная смерть констатируется у 2–4% взрослых и у 4–6% детей и подростков с ГКМП.
ГКМП – первичное заболевание миокарда неизвестной этиологии, характеризующееся асимметричной или симметричной гипертрофией миокарда левого желудочка с обязательным вовлечением в гипертрофический процесс межжелудочковой перегородки, нарушением диастолической функции левого желудочка, а также развитием при обструктивной форме заболевания градиента давления между левым желудочком и аортой. Гемодинамические нарушения при ГКМП обусловлены значительной гипертрофией межжелудочковой перегородки. Во время систолы, когда кровь проходит узкий участок между перегородкой и передней створкой митрального клапана, создается зона низкого давления (эффект Бернулли). Происходит смещение передней створки митрального клапана к перегородке и сужение выходного тракта левого желудочка.
Заболевание имеет достаточно скудную клиническую картину, ребенок может жаловаться на утомляемость и одышку при физической нагрузке, боль в области грудной клетки слева, сердцебиение. Если есть градиент оттока левого вентрикулярного тракта, то выслушивается систолический шум относительного стеноза над клапанами аорты. У половины больных ГКМП наблюдается смещение относительной сердечной тупости влево. У большинства детей имеют место различные изменения на ЭКГ (гипертрофия отделов сердца, нарушение реполяризации, удлинение интервала QT). По данным Maron B.J., если первым проявлением заболевания были сердечная недостаточность или цианоз, то летальный исход следует ожидать в течение одного года, при асимптомном течении заболевания или наличии только шума, выживаемость после первого года заболевания составляет более 50%.
Выделено три группы факторов – вероятных причин внезапной смерти при ГКМП: нарушение внутрисердечной гемодинамики, ишемические изменения в миокарде, жизнеугрожающие аритмии. Эти факторы тесно взаимосвязаны между собой. «Большими» факторами риска ВСС при ГКМП являются перенесенная остановка сердца и фибрилляция желудочков/стойкая желудочковая тахикардия. К «малым» факторам риска относят: неадекватный ответ артериального давления на нагрузку; толщина стенки ЛЖ ≥30 мм; случаи ВСС в семейном анамнезе; нестойкая желудочковая тахикардия; необъяснимое синкопе, индуцированное нагрузкой. ГКМП – наиболее частая причина необъяснимых случаев внезапной смерти у практически здоровых спортсменов, принимающих участие в соревнованиях.
Ежегодно дилатационная кардиомиопатия (ДКМП) диагностируется с частотой 7,5:100 тыс. человек, характеризуется расширением и ограничением функции левого или обоих желудочков. Этиология не установлена. Среди причин обсуждаются вирусные инфекции, иммунные нарушения. Доказано, что ДКМП может быть следствием длительной хронической тахиаритмии. В настоящее время ведутся исследования по изучению митохондриальных аномалий как одной из основных причин ДКМП. Большую роль играет семейный анамнез. Выявлено, что у детей с отягощенной наследственностью риск возникновения ДКМП в 600–700 раз выше, чем в популяции. Зарегистрированы случаи аутосомно-доминантного, аутосомно-рецессивного и сцепленного с Х-хромосомой типа наследования. В ходе длительного изучения ДКМП выявлено, что 1/3 больных умирает, причем большинство – в течение 1–2 лет после начала заболевания; у 1/3 наступает улучшение; у 1/3 – полное излечение. 5-летняя выживаемость у детей составляет 34–66%. Самым критическим периодом являются первые 6 месяцев заболевания, когда в большинстве случаев можно определить направление развития ДКМП.
У 30–50% больных ДКМП заканчивается внезапной сердечной смертью, причиной которой является выраженный фиброз субэндокардиального слоя стенки сердца, приводящий к дилатации желудочков и возникновению желудочковых тахиаритмий. У 80% пациентов с ДКМП при холтеровском мониторировании обнаруживается пароксизмальная желудочковая тахикардия. Так как причина этого заболевания точно не идентифицирована, то и этиотропного лечения нет.
Аритмогенная дисплазия правого желудочка (АДПЖ) является одной из наиболее частых причин ВСС у лиц моложе 35 лет. Ее распространенность в популяции составляет 0,01–0,1%, но выявляемость в настоящее время очень низкая. По данным Мазур Н.А., среди 60 подростков призывного возраста, у которых при суточном мониторировании ЭКГ были выявлены частая желудочковая экстрасистолия и/или короткие пароксизмы желудочковой тахикардии, почти у 10% с помощью магниторезонансной томографии была диагностирована малая форма АДПЖ. При АДПЖ стенка правого желудочка замещается соединительной и жировой тканью. В этот процесс могут вовлекаться межжелудочковая перегородка и левый желудочек. Причина данного нарушения неясна. В 30–50% случаев АДПЖ обусловлена мутациями в 1-ой и 6-ой хромосомах и наследуется по аутосомно-доминантному типу. При этом заболевании развиваются мономорфные и полиморфные желудочковые тахикардии; предсердные аритмии (у 25% пациентов), приводящие к летальному исходу. Симптомы заболевания немногочисленны. На ЭКГ может регистрироваться блокада правой ножки пучка Гиса, эпсилон-волна (рис. 1), желудочковая экстрасистолия, желудочковая тахикардия с QRS комплексом, измененным по типу блокады левой ножки пучка Гиса.
Во многих случаях специфический диагноз АДПЖ затруднен. Наиболее информативный метод обследования – МРТ сердца, на которой выявляют небольшие анатомические изменения, указывающие на затруднение оттока из правого желудочка. Эндомиокардиальная биопсия также является важным диагностическим инструментом, однако отрицательные результаты биопсии не исключают диагноз. Синкопе и ВСС у больных АДПЖ провоцируются физической нагрузкой. У многих заболевание манифестирует внезапной сердечной смертью в результате ишемии миокарда, которая развивается на фоне аномалий или органических изменений в коронарных сосудах. К наиболее частым врожденным аномалиям коронарных артерий, вызывающим синдром внезапной смерти у детей, относится эктопическое отхождение правой или левой коронарной артерии от синуса Вальсальвы. При физическом напряжении проксимальная компрессия создает обструкцию току крови в коронарных артериях, приводя к дистальной ишемии, вентрикулярной тахикардии, а, возможно, и к фибрилляции желудочков с последующей остановкой сердца. Почти у 1/3 пациентов, умирающих скоропостижно от данной аномалии, ранее отмечались синкопе или стенокардия при физическом напряжении.
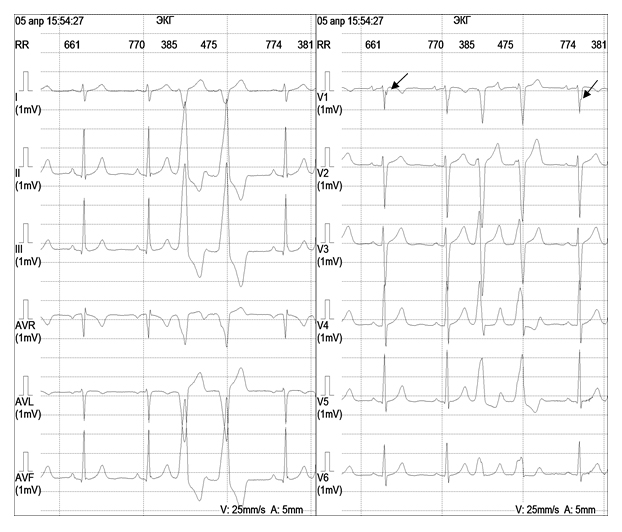
Рисунок 1. Фрагмент холтеровского мониторирования мальчика А., 13 лет, с частой правожелудочковой экстрасистолией.
Примечание: стрелками указана эпсилон-волна
Аномалия Бланда-Уайта-Гарленда – отхождение левой коронарной артерии от легочного ствола, встречается редко, и большинство пациентов с этой аномалией умирают в младенческом возрасте. Однако от 5 до 10% пациентов переносят ранний инфаркт миокарда с последующим развитием коронарных коллатеральных сосудов справа налево. В раннем возрасте эта аномалия проявляется задержкой физического развития, признаками левожелудочковой недостаточности, часто – в сочетании с митральной регургитацией, эластофиброзом эндокарда. Характерной зоной инфаркта является субэндокард левого желудочка и папиллярные мышцы митрального клапана.
Врожденные стенозы коронарных сосудов чаще локализуются в передней нисходящей ветви левой коронарной артерии, несколько реже в правой коронарной артерии и в огибающей ветви левой коронарной артерии. В состоянии покоя и при небольшой физической нагрузке состояние детей с такой патологией не нарушено, жалоб может не быть, при физикальном и инструментальном обследовании патологических изменений не обнаруживается. Однако при физической нагрузке, прежде всего чрезмерной для данного ребенка, наблюдается неадекватное кислородное обеспечение отдельных участков миокарда, электрическая нестабильность и дисфункция левого желудочка – так называемый «треугольник риска внезапной смерти».
Диспластические изменения мышечно-клапанных структур сердца включают в себя врожденные морфофункциональные нарушения соединительнотканных образований с повышением эластичности и формированием патологических синдромов.
Синдром Марфана – это наследственное заболевание соединительной ткани, наследуемое по аутосомно-доминантному типу, вследствие мутации гена 15-ой хромосомы, детерминирующего продукцию фибрина. Это приводит к нарушению синтеза коллагена и эластана. 40–60% детей с синдромом Marfan имеют кардиоваскулярные аномалии – дилатацию корня аорты, аортальную недостаточность, аневризму корня аорты, пролапс митрального клапана, недостаточность митрального клапана. При синдроме Марфана ВСС обусловлена острым расслоением аорты с ее разрывом. Данное нарушение может возникать у детей, но чаще всего регистрируется в четвертую декаду жизни. У таких детей важным является выявление кардиалгий, контроль характеристик периферического пульса (частота, ритмичность, сила пульсовой волны), регулярное (не реже 2 раз в год) проведение эхокардиографии, позволяющее выявить прогрессирующее расширение корня аорты.
Синдром Элерса-Данлоса включает группу заболеваний. В настоящее время известно 11 типов болезни, различающихся между собой по первичному дефекту гена и типу наследования, характеру и тяжести клинической симптоматики. Поражение сердечно-сосудистой системы наблюдается преимущественно при первых трех типах, которые составляют примерно 90% всех случаев. Характерно формирование аневризмы аорты.
Пролапс митрального клапана (ПМК) – систолическое провисание одной или обеих митральных створок в полость левого предсердия. Пролапс митрального клапана можно выявить в любом возрасте, включая период новорожденности, но чаще всего его констатируют у детей старше 7 лет. Актуальность проблемы ПМК обусловлена как его широкой распространенностью в популяции, так и тяжестью возможных осложнений, среди которых нарушения сердечного ритма, инфекционный эндокардит, тромбоэмболии различных сосудов, внезапная смерть. Клинико-анатомически ПМК является не болезнью, а синдромом, присущим различным нозологическим формам. Принято выделять первичный (врожденный, идиопатический) и вторичный ПМК. Первичный ПМК обусловлен дисплазией соединительной ткани, проявляющейся также другими микроаномалиями строения клапанного аппарата (изменение структуры клапана в виде миксоматозной дегенерации, неправильное прикрепление, укорочение или удлинение хорд, появление дополнительных хорд и др.). Вторичный ПМК развивается на фоне поражения сердца при органической патологии сердечно-сосудистой системы (миокардит, ревматизм), травме грудной клетки. В его основе лежат нарушение сократимости миокарда левого желудочка, дисфункция папиллярных мышц, обусловленные основным заболеванием. В выраженности клинической симптоматики ПМК несомненно принимает участие дисфункция вегетативной нервной системы. Кроме того, имеют значение нарушения обмена веществ и дефицит микроэлементов, в частности ионов магния. Одна из наиболее распространенных жалоб у детей при ПМК – боль в области сердца. Чаще детей беспокоит колющая, ноющая, давящая боль, чаще в области верхушки сердца, различной продолжительности, типична связь с психоэмоциональным напряжением или физической перегрузкой. Для больных с ПМК характерны нарушения ритма и проводимости: предсердная и желудочковая экстрасистолия, пароксизмальная наджелудочковая тахикардия, мерцательная аритмия, желудочковая тахикардия, внутрипредсердные и атриовентрикулярные блокады, синдром слабости синусового узла. Основными патогенетическими факторами нарушения сердечного ритма при ПМК считают миксоматозную дегенерацию проводящей системы сердца и створок, особенно задней, а также митральную регургитацию. В генезе наджелудочковых аритмий предполагают значение раздражения субэндокардиальных участков левого предсердия регургитирующей струей крови, приводящего к развитию очагов эктопического возбуждения. Желудочковые нарушения ритма развиваются на фоне гиперсимпатикотонии, аномальной тракции папиллярных мышц. Заслуживает внимания взаимосвязь ПМК и синдрома удлиненного интервала QТ, который известен как предиктор желудочковой тахикардии, фибрилляции желудочков и внезапной смерти на фоне электрической нестабильности миокарда. По данным Bourdarias J. (1991), риск внезапной смерти при ПМК с отсутствием митральной регургитации низкий и не превышает 2:10000 в год, в то время как при сопутствующей митральной регургитации увеличивается в 50–100 раз. В то же время риск ВСС у пациентов с ПМК в 2–3 раза выше, чем у здоровых лиц. Максимальный риск ВСС имеют пациенты со случаями внезапной смерти в семейном анамнезе, предшествующими синкопальными состояниями, отклонениями на ЭКГ в состоянии покоя, удлиненным интервалом QT, наличием комплексной вентрикулярной тахиаритмии, удлиненных и миксоматозно перерожденных створок митрального клапана.
Приобретенная патология сердечно-сосудистой системы, лежащая в основе развития синдрома внезапной смерти, включает в себя воспалительные процессы в миокарде, эндокарде с возможным формированием пороков клапанов, кардиомиопатии.
Полагают, что в 20–40% случаев причиной ВСС является миокардит. Поражение сердца при миокардите разнообразно: от проводящей системы с возникновением блокад различного уровня и степени до собственно миокарда с развитием желудочковой тахикардии. При этом клинические признаки сердечной недостаточности могут отсутствовать.
Болезнь Kawasaki – наиболее частая причина приобретенных поражений коронарных артерий у детей младшего и старшего возраста. Болезнь Кавасаки встречается во всем мире, но наиболее распространена у жителей Азии. Для заболевания характерны аневризмы коронарных артерий – обычно проксимальные, часто множественные, поражающие левую коронарную артерию. В большинстве случаев смерть наступает во время третьей или четвертой недели острого заболевания. Однако коронарные нарушения сохраняются у 23% пациентов спустя 3 месяца и у 8% – спустя 2 года. ВСС наступает у 1–2% пациентов с не леченой болезнью Kawasaki.
Первичное и вторичное нарушение ритма сердца у детей является основной причиной синдрома внезапной смерти в детском и подростковом возрасте. Распространенность тяжелых, жизнеугрожающих форм нарушений ритма у детей достигает 1:50 000. Практически любое нарушение ритма в большей или меньшей степени может быть сопряжено с риском развития жизнеугрожающих состояний вследствие развития аритмогенной кардиомиопатии, сосудистого коллапса и сердечной недостаточности. Большое значение в патофизиологии аритмий придают нарушениям нейровегетативной регуляции сердечного ритма, электролитным нарушениям. Анализ данных мониторирования ЭКГ в момент наступления внезапной остановки кровообращения показывает, что в большинстве случаев механизмом является фибрилляция желудочков, которой чаще предшествуют эпизоды пароксизмальной желудочковой тахикардии, переходящей в трепетание желудочков, а перед развитием фибрилляции желудочков регистрируются желудочковые экстрасистолы, залпы полиморфных комплексов, начинающиеся с раннего внеочередного сокращения.
Выделяют несколько синдромов, которые сопряжены с развитием жизнеугрожающих аритмий: синдром WPW; синдром удлиненного интервала QT; синдром слабости синусового узла; синдром Бругада.
Анатомическим субстратом синдрома WPW являются дополнительные предсердно-желудочковые пути проведения (пучки Кента, или так называемые «мышечные мостики»), существующие помимо специализированной области предсердно-желудочкового соединения – атрио-вентрикулярного узла. Примерно в 50% случаев при синдроме WPW возникает тахиаритмия. Частота сокращения сердца составляет при этом, как правило, 160–200 ударов в минуту. Распространенность синдрома WPW среди детей составляет около 0,1%. Он обычно не ассоциируется со структурными заболеваниями сердца, но иногда наблюдается в совокупности с врожденными пороками сердца (аномалией Эбштейна, корригированной транспозицией магистральных сосудов, другими ВПС). У пациентов с WPW-синдромом имеется риск внезапной смерти, которая может наступить в результате быстрого проведения импульса по дополнительным путям с развитием фибрилляции предсердий или желудочков. Феномен WPW диагностируют при проведении ЭКГ (интервал PQ составляет менее 0,08 с, на восходящем колене комплекса QRS визуализируется дельта-волна, свидетельствующая о наличии дополнительного функционального пути проведения – рис. 2). Наиболее целесообразным методом лечения больных с высоким риском внезапной смерти при синдроме WPW считается радиочастотная абляция дополнительного пучка.
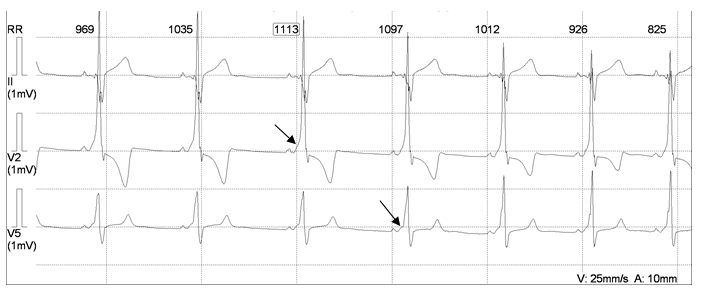
Рисунок 2. Феномен WPW
Примечание: стрелками указана дельта-волна
Синдром удлиненного интервала QT (LQT) был назван так из-за своей отличительной характеристики на ЭКГ – удлинения QT-интервала. Это семейное заболевание, при котором выявляется патология в 5 генах (4 гена, кодирующих транспорт ионов калия, и 1 ген – транспорт ионов натрия через клеточную мембрану). В классификации выделяют:
– врожденный LQT – генетические (синдромы Романо – Уорда и Джервела – Ланге – Нельсона) и спорадические формы;
– приобретенный LQT – вследствие приема лекарственных препаратов (антиаритмические средства, препараты лития, трициклические антидепрессанты), нарушения метаболизма, соблюдения низкокалорийной диеты, наличия заболеваний центральной и вегетативной нервной системы, ПМК.
Заболевание проявляется удлинением интервала QT более 440 мс (рис. 3), корригированного интервала QT более 500 мс на ЭКГ покоя и желудочковыми аритмиями, провоцируемыми стрессом. У 60% пациентов с синдром удлиненного интервала QT имеют место синкопальные состояния, судороги или сердцебиения, связанные с физической активностью или эмоциональным напряжением. Синкопальные состояния или ВСС могут возникать во время плавания (15% случаев), других неадекватных физических нагрузках, резких акустических сигналах (8%), случаях ожидания боли, эмоциональном перенапряжении. У 1/3 пациентов с синдромом удлиненного интервала QT жалобы и вышеописанные симптомы отсутствуют.
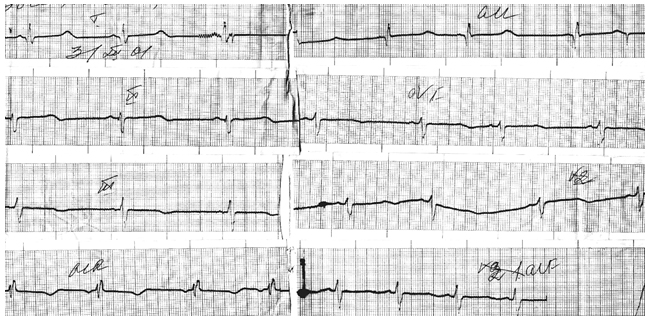
Рисунок 3. Фрагмент ЭКГ мальчика Б., 3 лет, длительность QT – 0,46 с
У детей с синдромом Романо – Уорда в отсутствие лечения риск внезапной смерти, спустя 3–5 лет после появления первых симптомов заболевания (первый приступ синкопе), достигает 32% и максимален в пубертатном возрасте. В семьях больных с этим синдромом риск внезапной смерти вполне реален даже при отсутствии клинических и ЭКГ-симптомов заболевания.
Аритмии, связанные с нарушением нормального функционирования синусового узла, являются наиболее полиморфными по ЭКГ и клиническим проявлениям и трудными в плане диагностики и лечения.
Одной из причин ВСС у детей может быть синдром слабости синусового узла (СССУ), причинами которого в детском возрасте являются:
ü изолированное повреждение синусового узла в результате хирургического лечения ВПС, а также при закрытых травмах грудной клетки (кровоизлияние, ушиб);
ü поражение миокарда предсердий с вовлечением синусового узла в результате соматических заболеваний: кардит, ревматизм, диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, системная форма ювенильного ревматоидного артрита, дерматомиозит), васкулит;
ü электролитные нарушения (гиперкальциемия, гиперкалиемия);
ü токсическое поражение при приеме антиаритмических препаратов, трициклических антидепрессантов, при отравлениях хлорофосом, ядовитыми грибами; при поствакцинальных осложнениях;
ü выраженная ваготония.
Специфических клинических проявлений СССУ нет. Наиболее часто – это вегетативная дисфункция, синкопальные состояния, брадикардия, приступы тахикардии, различные виды аритмии. Диагноз СССУ ставится по ЭКГ, основываясь на результатах суточного или долгосрочного мониторирования сердечного ритма (рис. 4), дополнительных методах обследования (неинвазивное электрофизиологическое исследование).
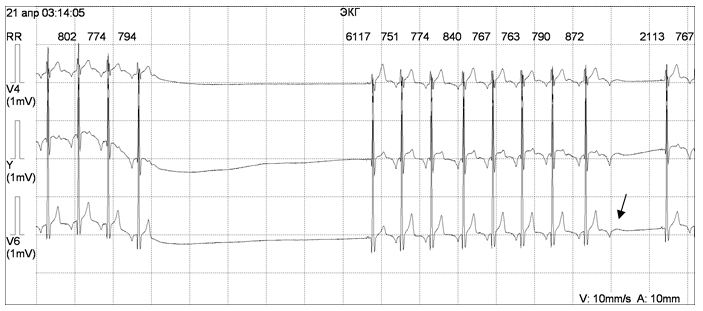
Рисунок 4. Фрагмент холтеровского мониторирования мальчика Ю., 15 лет, с синдромом слабости синусового узла. Асистолия длительностью 6117 мсек сменяется нижнепредсердным ритмом с ЧСС 69-80 уд/мин.
Примечание: стрелкой указан эпизод атриовентрикулярной блокады 2 ст.
Синдром Бругада представляет собой клинико-электрокардиографический синдром, характеризующийся синкопальными состояниями и эпизодами внезапной смерти пациентов без органических изменений в сердце, проявляющийся на ЭКГ подъемом сегмента ST в правых грудных отведениях V1-V3 (рис. 5), изменением комплекса QRS, сходным с таковым при блокаде правой ножки пучка Гиса (которые могут транзиторно исчезать) и с возникновением на этом фоне эпизодов полиморфной желудочковой тахикардии и фибрилляции желудочков, обуславливающих клиническую картину.
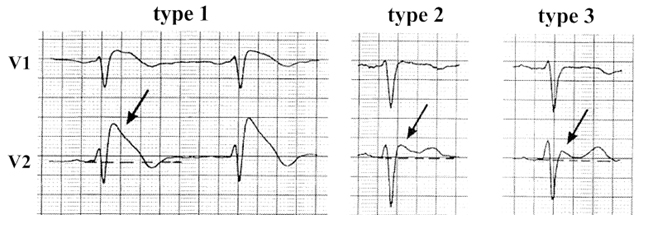
Рисунок 5. Варианты ЭКГ-фенотипа синдрома Бругада.
Изменения QRS: type 1 – «свод», type 2, 3 – «спинка седла»
Диагноз синдрома Бругада устанавливается на основании наличия в семье случаев внезапной смерти (преимущественно мужчин в возрасте от 6 месяцев до 50 лет), блокады правой ножки пучка Гиса (включая преходящую блокаду) и подъема сегмента ST в V1-V3. Генетические исследования выявили у таких больных наличие мутации гена (LQT3), регулирующего транспорт ионов натрия через клеточную мембрану (SCN5A).
Врожденная блокада сердца без ассоциированного ВПС встречается у 1 из 20 000 детей. Основным симптомом заболевания является синкопе вследствие брадикардии. Если сердце структурно не изменено, то брадикардия переносится относительно хорошо; тем не менее, при длительном последующем наблюдении у значительного процента этих пациентов отмечаются приступы Морганьи – Адамс – Стокса и ВСС, обусловленные брадикардией (рис. 6), удлинением интервала QT, развитием тахикардии типа torsades de pointes. Риск полностью устраняется при pacemaker-терапии.
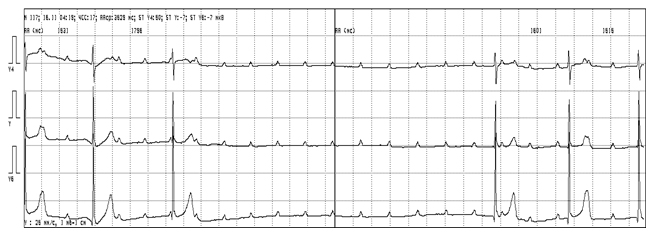
Рисунок 6 Врожденная атриовентрикулярная блокада у девочки А., 6 лет.
Асистолия желудочков длительностью 7 сек.
Возможным механизмом внезапной аритмической смерти также является внезапно возникшая асистолия желудочков – прекращение электрической и механической активности желудочков, всего сердца, в результате чего наблюдается остановка его деятельности (рис. 7). Асистолия желудочков приводит к прекращению кровообращения и клинической смерти. Причиной асистолии желудочков может быть остро возникшее (тромбоэмболия легочной артерии) или хроническое (пороки сердца, миокардиопатии) тяжелое поражение сердца, воздействие медикаментов, угнетающих миокард (противоаритмических средств, препаратов калия), чрезмерная ваготония (например, индуцированная массажем каротидного синуса), рефлекторные воздействия, поражение электрическим током, электроимпульсное лечение. Асистолия желудочков может быть следствием атриовентрикулярной блокады или слабости синусового узла. Развитию асистолии сердца может способствовать эктопическая аритмия, угнетающая функцию синусового узла или атриовентрикулярную проводимость. Так, асистолия иногда возникает после единичной экстрасистолы или группы экстрасистол, на фоне пароксизма суправентрикулярной или желудочковой тахикардии, мерцания или трепетания предсердий.
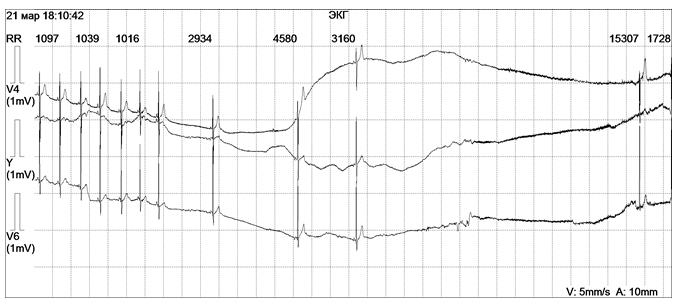
Рисунок 7. Фрагмент холтеровского мониторирования девочки В., 14 лет, во время спонтанного синкопе. На ЭКГ последовательно регистрируются: пауза ритма 2934 мсек, асистолия длительностью 4580, 3160 и 15307 мсек.
ВНЕЗАПНАЯ СЕРДЕЧНАЯ СМЕРТЬ В СПОРТЕ
От 10 до 25% случаев скоропостижной смерти среди населения регистрируются во время физического напряжения. Доказано, что значительные физические нагрузки увеличивают риск внезапной смерти в 7-10 раз. Ежегодно в Соединенных Штатах Америки констатируют от 10 до 25 смертельных случаев от сердечных причин, связанных с занятиями спортом, у 5 из 100000 молодых спортсменов при этом выявляют предрасполагающие факторы.
Определение понятия «внезапная смерть в спорте» предусматривает случаи смерти, наступившей непосредственно во время физических нагрузок, а также в течение 1 часа с момента появления первых симптомов, заставивших изменить или прекратить свою деятельность. Среди причин смерти выделяют следующие наиболее частые: 1) сердечно-сосудистые, 2) травмы, 3) фармакологические препараты (допинг).
Причины внезапной сердечной смерти в спорте в настоящее время разделяют на три категории:
– ВСС, обусловленная нераспознанным или недооцененным врачом патологическим состоянием, имевшим место до начала занятий спортом – аномалии и пороки развития сердца и сосудов, первичная кардиомиопатия, синдром удлиненного QT, АДПЖ, клапанная болезнь сердца, аортальный стеноз, синдром Марфана, аномалии коронарной артерии, миокардит, синдром Вольфа-Паркинсона-Уайта;
– острые патологические состояния, возникающие у здоровых людей под влиянием чрезмерных физических нагрузок (острая дистрофия миокарда).
В 1936 г. Ланг Г.Ф. ввел в научный оборот понятие «физиологическое сердце» и «патологическое спортивное сердце». «Спортивное сердце» формируется не менее чем за 2 года регулярных интенсивных занятий спортом (4-5 тренировок в неделю по 2 часа). Выделяют два типа реакций сердца на нагрузку: сердце стайера (дилатация полости и умеренная гипертрофия) и сердце спринтера (развитие гипертрофии). Гипертрофия миокарда у спортсменов является следствием неполноценности адаптационных механизмов к повышенным требованиям спортивной деятельности и, если не самостоятельной патологией, то, по крайней мере, условием для развития морфологических и функциональных изменений в миокарде.
– сотрясение сердца (синдром commotio cordis).
Внезапная смерть в результате относительно небольшого удара в грудную клетку (сотрясение сердца) была описана в медицинской литературе в конце 70-х годов ХХ века. С момента первого описания этого феномена, было зарегистрировано 70 подобных случаев. Эта цифра, по всей вероятности, преуменьшена, потому что многие случаи интерпретируются как смерть от несчастного случая или идиопатическая внезапная смерть. Сотрясение сердца наиболее часто происходит в таких видах спорта, как бейсбол, хоккей, борьба.
Люди, получившие сотрясение сердца, – преимущественно молодые, здоровые мужчины. У пострадавших не было в анамнезе заболеваний сердца или других хронических заболеваний. Удар приходится в область грудной клетки на уровне сердца, скорость удара – обычная для спортсменов. Как правило, возникает потеря сознания, но иногда бывают моменты ясности, во время которых пострадавший жалуется на головную боль. Наиболее часто изначально возникает фибрилляция желудочков; однако были описаны полная блокада, учащенный идиовентрикулярный ритм, выраженный вагусный ответ, электромеханическая диссоциация и асистолия. Вскрытие не выявляет аномалий сердца или грудной клетки. У этих пострадавших наиболее вероятный механизм внезапной смерти – фибрилляция желудочков в результате удара в «электрически ранимый период» сердечного цикла (рис. 8).
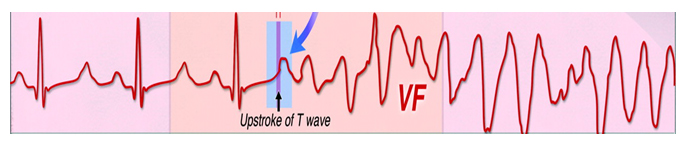
Рисунок 8. Схема развития фибрилляции желудочков при commotio cordis.
Примечание: стрелкой указан «электрически ранимый период» сердечного цикла.
КЛИНИКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ.
СЕРДЕЧНО-ЛЕГОЧНАЯ РЕАНИМАЦИЯ
Примерно в 25% случаев ВСС наступает молниеносно и без видимых предвестников. У многих больных за 1-2 недели до внезапной смерти отмечаются разнообразные продромальные симптомы, свидетельствующие об обострении заболевания: учащение болей в сердце, иногда атипичной локализации; одышка, общая слабость и значительное снижение работоспособности и переносимости физической нагрузки; сердцебиения и перебои в работе сердца. Непосредственно перед наступлением внезапной сердечной смерти примерно у половины больных отмечается болевой ангинозный приступ, нередко сопровождающийся страхом близкой смерти. Могут отмечаться и другие клинические симптомы, в зависимости от того заболевания, которое является причиной ВСС. В 90% случаев внезапная сердечная смерть происходит во внебольничных условиях.
Диагностика ВСС основывается на наличии симптомов естественной смерти, выявляемых в ходе физикального осмотра до начала проведения мероприятий по сердечно-легочной реанимации (СЛР):
– отсутствие сознания (констатируется в случае отсутствия реакции ребенка на различные раздражители);
– отсутствие дыхания или очень редкое дыхание агонального типа (когда в течение первых 10-15 сек. наблюдения не удается определить видимых и координированных дыхательных движений грудной клетки, шума выдыхаемого воздуха или его движения);
– судорожные (агональные) вдохи, не обеспечивающие эффективную вентиляцию легких. Они не могут быть расценены как самостоятельное дыхание;
– отсутствие пульса на сонных артериях (не ощущается пульсовая волна в ямке между боковой поверхностью гортани и мышечным валиком на боковой поверхности шеи);
– отсутствие тонов сердца при аускультации;
– максимальное расширение зрачков и отсутствие роговичного и зрачкового рефлексов;
– патологическая реакция зрачков на свет (расширение зрачков после кратковременного закрытия глаз ладонью);
– отсутствие АД;
– холодные кожные покровы, их бледно-серый цвет.
Подтверждением ВСС являются следующие патологические изменения на ЭКГ:
– фибрилляция желудочков – на ЭКГ частые (200-500 в мин) и нерегулярные беспорядочные волны, отличающиеся друг от друга различной формой и амплитудой. Постепенно волны фибрилляции становятся низкоамплитудными и переходят в прямую изолинию (асистолия);
– трепетание желудочков (иногда предшествует фибрилляции желудочков) – частые, относительно регулярные и почти одинаковые по форме и амплитуде волны трепетания, напоминающие синусоидальную кривую. Впоследствии амплитуда волн уменьшается, они становятся нерегулярными и разной амплитуды – трепетание переходит в фибрилляцию желудочков;
– асистолия сердца – полное отсутствие электрической активности сердца, на ЭКГ регистрируется изолиния (рис. 9);
– электромеханическая диссоциация – редкий синусовый или узловой ритм, переходящий в редкий идиовентрикулярный ритм, а затем в асистолию.
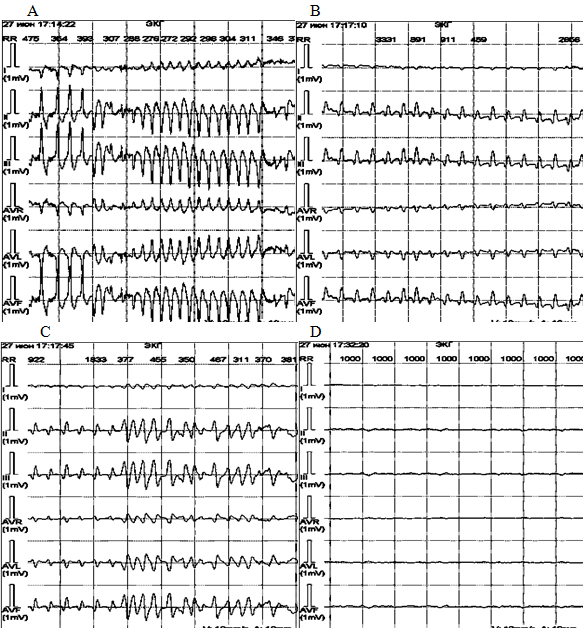
Рисунок 9. ЭКГ девочки К., 16 лет, внезапно умершей во время проведения холтеровского мониторирования: А – желудочковая тахикардия torsades de pointes, В, С – мелковолновая и крупноволновая фибрилляция желудочков, D – асистолия
Во время внезапно развившейся фибрилляции желудочков или асистолии сердца у больного появляются резкая слабость, головокружение. Спустя несколько секунд, в результате полного прекращения мозгового кровотока, больной теряет сознание, появляется тоническое сокращение скелетных мышц, шумное дыхание. При осмотре кожные покровы бледные, с сероватым оттенком, холодные на ощупь. Начинают быстро расширяться зрачки. Пульс на сонных артериях не определяется, тоны сердца не выслушиваются. Примерно через 1,5 мин зрачки максимально расширены. Отмечается отсутствие зрачковых и роговичных рефлексов. Дыхание быстро урежается, становится агональным, появляются очень редкие дыхательные движения. Через 2,5-3 мин дыхание прекращается. Примерно через 3 мин от момента наступления фибрилляции желудочков или асистолии в клетках коры головного мозга происходят необратимые изменения.
Своевременная диагностика внезапной сердечной смерти коррелирует с эффективностью мероприятий по сердечно-легочной реанимации, целью которых является восстановление жизнедеятельности организма и выведение его из пограничного с биологической смертью состояния (табл. 1).
СЛР выполняется, если ребенок находится без сознания и не дышит (или задыхается). При этом у медицинского работника есть 10 секунд на проверку пульса (на плечевой артерии у грудных детей и на сонной или бедренной артерии у более старших детей). Обнаружение пульса может представлять трудности, особенно в экстренной ситуации. Как показывают исследования, ни медицинские работники, ни непрофессиональные реаниматоры не в состоянии определить наличие или отсутствие пульса с достаточной степенью точности. Если в течение 10 секунд пульс не обнаружен или нет уверенности в его наличии, приступают к компрессионным сжатиям грудной клетки (не к искусственному дыханию)! Последовательность действий должна быть следующей – С-А-В (Circulation – кровообращение, Airway – дыхательные пути, Breathing – дыхание).
СЛР следует начинать с 30 компрессионных сжатий (если помощь оказывает один реаниматор) или 15 компрессионных сжатий (если помощь ребенку оказывают два медицинских работника) вместо 2 искусственных вдохов. Чтобы компрессионные сжатия грудной клетки были эффективными, глубина вдавливания должна составлять не менее одной трети диаметра грудной клетки. Это соответствует приблизительно 4 см для большинства грудных детей и приблизительно 5 см для большинства детей более старшего возраста. При отсутствии иных данных следует считать, что причиной быстрого циркуляторного коллапса является фибрилляция желудочков.
Вместо автоматического наружного дефибриллятора (АНД) для дефибрилляции сердца ребенку рекомендуется использовать ручной дефибриллятор. При отсутствии ручного дефибриллятора желательно использовать АНД с системой ослабления разряда. При отсутствии всех вышеперечисленных устройств можно использовать АНД без системы ослабления разряда. Первый дефибрилляционный разряд подается с энергией 2-4 Дж/кг. В случае устойчивой фибрилляции желудочков энергию можно увеличить. Последующие разряды должны подаваться с энергией 4 Дж/кг и выше, но не более 10 Дж/кг или не выше максимального значения энергии для взрослых. Если сердечная деятельность не возобновилась, в/в струйно ввести лидокаин в дозе 1-2 мг/кг или аймалин по 1 мг/кг (не более 50 мг) на изотоническом растворе натрия хлорида. Вместе с этим исключить известные факторы, которые могли привести к фибрилляции желудочков – гипоксемию, гиперкапнию, гиперкалиемию, кровотечение.
Критерии эффективности сердечно-легочной реанимации:
– восстановление проходимости дыхательных путей;
– симметричность дыхания и экскурсии грудной клетки;
– появление самостоятельных дыхательных движений;
– исчезновение бледности и уменьшение цианоза;
– повышение систолического АД до 80-90 мм рт.ст.;
– сужение ранее расширенных зрачков;
– пульсация крупных артерий (прежде всего, сонной).
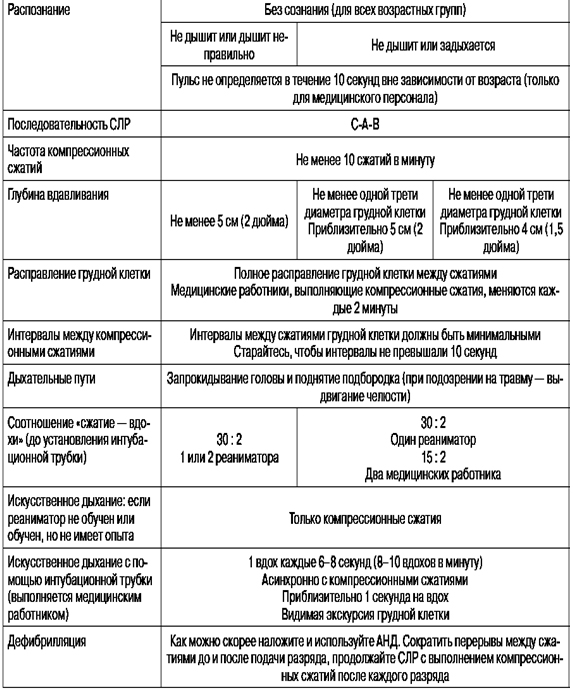
Таблица 1. Основные элементы базовой реанимации взрослых и детей согласно рекомендациям Американской ассоциации сердца (2010 г.)
ДИАГНОСТИКА ЗАБОЛЕВАНИЙ, ИМЕЮЩИХ РИСК РАЗВИТИЯ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
После успешного проведения СЛР необходима диагностика заболеваний, явившихся причиной внезапной сердечной смерти.
Выявление и динамический контроль факторов риска развития ВСС у детей – трудная клиническая задача, решение которой требует четких последовательных действий на всех этапах, начиная с анамнестических данных и заканчивая применением современных диагностических алгоритмов. Немедленное кардиологическое обследование показано детям или молодым взрослым, имеющим:
– боль в груди при физическом напряжении, на которую не влияют движение, вдох или пальпация, при отсутствии явных некардиологических причин, особенно, если у пациента имеется патология сердца с высоким риском летального исхода,
– внезапная смерть в семейном анамнезе,
– связанное с физическим напряжением неясное синкопе без продромы или с предшествующим учащением сердечного ритма.
Сбор анамнеза должен включать детальный опрос о семейных случаях внезапной или неожиданной смерти. Внезапная смерть брата или сестры первой степени родства определяет особенно высокий риск у данного пробанда. Необходимо уточнить наличие родственников с синкопальными состояниями, различными видами аритмий. Примерно 45% пациентов с внезапной сердечной смертью приходят на прием к врачу в течение 4 недель, предшествующих летальному исходу. Однако в 75% случаев их жалобы не специфические, не имеют отношения к сердечно-сосудистой системе.
Лабораторные методы диагностики должны включать общеклинические исследования, а также определение кардиоспецифических биохимических маркеров (тропонинов Т, I, MB-фракция креатинкиназы, лактатдегидрогеназы, миоглобина), оценка уровня электролитов (калия, кальция, магния), мозгового натрийуретического пептида, глюкозы крови, гликозилированного гемоглобина, гормонов щитовидной железы; показателей липидного профиля. Показано измерение содержания фибриногена в крови как ключевого фактора гемостаза. Повышение уровня фибриногена считают независимым фактором риска развития кардиоваскулярных заболеваний как у здоровых лиц, так и у пациентов с уже имеющейся сердечно-сосудистой патологией.
В ряде случаев необходимо проведение токсикологического исследования: определение содержания в крови хинидина, прокаинамида, трициклических антидепрессантов, дигоксина (возможно их проаритмогенное действие при превышении терапевтических концентраций).
Среди специальных методов исследования, позволяющих оценить риск ВСС, следует в первую очередь назвать стандартную ЭКГ, а также длительную регистрацию ЭКГ, в частности холтеровское мониторирование. Этот метод позволяет оценить вариабельность синусового ритма, дисперсию интервала QT, выявить жизнеугрожающие аритмии, эпизоды ишемии миокарда. Важными и информативными методами обследования данного контингента больных также являются длительная спорадическая запись ЭКГ и аутотрансляция ЭКГ по телефону.
В основе ЭКГ высокого разрешения – компьютерное усиление, усреднение и фильтрация различных участков электрокардиограммы с их последующей математической обработкой. Указанное позволяет выделить и анализировать низкоамплитудные сигналы, не доступные для анализа при использовании традиционных методов регистрации электрокардиограммы и представляющие диагностическую ценность. С помощью этого исследования можно регистрировать сигналы из участков ишемизированного или фиброзированного миокарда.
Факт взаимосвязи ВСС с нагрузками в настоящее время не вызывает сомнений. Для выявления ишемии миокарда, жизнеугрожающих аритмий и определения толерантности к нагрузкам используют психоэмоциональные нагрузочные тесты и нагрузочные тесты с дозированной физической нагрузкой (велоэргометрия, тредмил-тест и др.). Для этих же целей используют электростимуляцию предсердий с помощью пищеводного или эндокардиального электродов, а также следует провести подбор и оценить эффективность антиаритмической терапии.
Рентгенография грудной клетки позволяет выявить признаки гипертрофии камер сердца, легочной гипертензии.
С помощью эхокардиографии показано определение размеров полостей сердца, толщины стенок желудочков, состояния клапанного аппарата, подклапанных структур, сократимости желудочков, наличия тромбоза полостей сердца.
Чреспищеводная эхокардиография позволяет обнаружить поражение органов грудной клетки и аорты (например, расслаивающую аневризму) и оценить функцию клапанного аппарата (например, митрального), а также результаты реконструктивных операций на сердце.
Рентгеновская компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) сердца и сосудов – информативные методы визуализации сердца и крупных сосудов, которые позволяют обнаруживать морфологические изменения аорты и ее крупных ветвей, в том числе аневризму аорты, а также морфологические изменения, обусловленные инфарктом миокарда (аневризму левого желудочка, истончение стенки желудочка, образование пристеночного тромба).
С целью выявления нарушений коронарного кровообращения используют радиоизотопную сцинтиграфию миокарда и коронарную ангиографию.
Генетическое тестирование позволяет установить наследственный характер заболевания, имеет диагностическую ценность у пациентов с идиопатическим удлинением или укорочением интервала QT, гипертрофической кардиомиопатией, правожелудочковой аритмогенной дисплазией, синдромами Марфана, Элерса-Данлоса, Бругада.
ПРИНЦИПЫ ПРОФИЛАКТИКИ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Меры профилактики внезапной сердечной смерти должны быть направлены на предупреждение, своевременную диагностику и адекватную терапию заболеваний, которые могут стать причиной ее развития.
Детям рекомендуются:
1. Систематические профилактические медицинские обследования детей.
2. Уменьшение воздействия суммы стрессовых факторов на ребенка, индивидуальное определение путей и средств их уменьшения.
3. Дозированные, адаптированные, индивидуально подобранные физические нагрузки.
4. На занятиях физкультурой при появлении первых признаков возможной патологии сердца (боль в груди, повышенная усталость, головокружения и др.) немедленное прекращение физической активности и обращение за медицинской помощью. Избегать интенсивных нагрузок во время острых респираторных и инфекционных заболеваний.
5. Избегать перегревания организма (горячие ванны, душ, сауна) и физической активности при высокой температуре окружающей среды, способствующей потере жидкости и макроэлементов (натрий, калий), увеличивающей частоту сердечных сокращений, повышающей риск развития нарушений ритма сердца.
6. Формирование здорового образа жизни. Профилактика курения, повышающего риск развития болезней коронарных артерий, аритмий вследствие увеличения концентрации свободных жирных кислот в сыворотке крови и продукции катехоламинов, особенно непосредственно после тренировки; а также употребления алкоголя, оказывающего тотальное повреждающее действие на все органы и системы ребенка.
В настоящее время проблема ВСС далека от своего окончательного решения, что обусловлено целым комплексом факторов теоретического, методического и практического характера. Остаются нереализованными многочисленные призывы к стандартизации вскрытий и выполнение в полном объеме патоморфологических исследований случаев ВСС, анализа морфологического субстрата и всех возможных пусковых факторов. По мере накопления данных возникает ряд новых проблем, которые требуют решения или коррекции, казалось, уже найденных ответов. Это касается целого ряда аспектов: дальнейшей верификации структурных основ ВСС, методов ее прогнозирования и надежного выделения видоизменяющихся групп повышенного риска, проблем профилактики и лечения идиопатической фибрилляции желудочков и других злокачественных нарушений ритма, подбора адекватной антиаритмической терапии и контроля ее эффективности. Актуальность этих аспектов диктует необходимость дальнейшего поиска их корректного решения.






