Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Антибактериальная терапия риносинуситов"
Автор: И.Г. Березняков
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: ЛОР, Семейная медицина/Терапия
Просмотров: 2 104
Дата проведения:
Определение
Риносинусит – это воспаление околоносовых пазух и полости носа, сопровождающееся симптомами [1]. Предпочтительнее использовать термин риносинусит, нежели синусит, поскольку последний почти всегда сопровождается воспалением прилегающей слизистой оболочки носа [2–4]. О неосложненном риносинусите принято говорить, когда во время постановки диагноза отсутствует клинически явное распространение воспаления за пределы околоносовых пазух и полости носа (например, неврологические, офтальмологические симптомы или признаки вовлечения мягких тканей).

Различают острый и хронический риносинусит. Длительность острого риносинусита (ОРС), по мнению большинства исследователей, не превышает 4-х недель [1, 5, 6]. О хроническом риносинусите (с обострениями или без таковых) принято говорить, если продолжительность болезни превышает 12 недель. Заболевание длительностью от 4 до 12 недель иногда трактуется как подострый риносинусит. Зачастую решение о том, как обозначать подобный риносинусит в каждом конкретном случае (как острый, подострый или хронический) оставляют на усмотрение лечащего врача.
Если больной в течение года переносит 4 и более эпизодов риносинусита, а в промежутках между ними симптомы заболевания отсутствуют, используют термин рецидивирующий ОРС.
Этиология
Подавляющее большинство случаев ОРС – вирусной этиологии. Только 0,5–2,0% эпизодов вирусного ОРC осложняются присоединением бактериальной инфекции [7]. Среди бактериальных возбудителей чаще всего встречаются S. pneumoniae (20–43% случаев), H. influenzae (22–35%) и M. catarrhalis (2–10%, чаще у детей) [1, 5, 8]. Примерно у 10% пациентов удается выделить S. aureus, однако его роль в возникновении острого бактериального риносинусита убедительно не доказана. Выделение стафилококков или других бактерий при посеве мазков из полости носа или носоглотки не позволяет судить ни об этиологии ОРС, ни отличить вирусный синусит от бактериального, поскольку плохо коррелирует с результатами культурального исследования аспирата из околоносовых пазух [9]. В свою очередь, пункция верхнечелюстных (гайморовых) пазух в амбулаторной практике используется крайне редко из-за трудоемкости, болезненности для пациентов, да и отсутствия, как правило, клинической необходимости. Поэтому антибиотики – при наличии показаний – назначаются в подавляющем большинстве случаев эмпирически.
Бактериальные риносинуситы, тяжелые и нетяжелые
 Согласно рекомендациям Американской академии отоларингологии/Фонда хирургии головы и шеи (АО/ФХ), острый бактериальный риносинусит (ОБРС) следует клинически различать с вирусным ОРС. ОБРС диагностируется, когда 1) жалобы или симптомы ОРС (гнойное отделяемое из носа, сопровождающееся заложенностью носа, лицевой болью/ощущением тяжести, либо обоими признаками) не улучшаются на протяжении не менее 10 дней после появления признаков поражения верхних дыхательных путей, либо 2) жалобы и симптомы ОРС вновь ухудшаются в течение 10 дней после первоначального улучшения («вторая волна заболевания»). В отличие от прежней версии этих рекомендаций для лучшего разграничения бактериального и вирусного ОРС подчеркивается не столько «персистирование» симптомов заболевания на протяжении 10 дней, сколько «отсутствие улучшения» [1].
Согласно рекомендациям Американской академии отоларингологии/Фонда хирургии головы и шеи (АО/ФХ), острый бактериальный риносинусит (ОБРС) следует клинически различать с вирусным ОРС. ОБРС диагностируется, когда 1) жалобы или симптомы ОРС (гнойное отделяемое из носа, сопровождающееся заложенностью носа, лицевой болью/ощущением тяжести, либо обоими признаками) не улучшаются на протяжении не менее 10 дней после появления признаков поражения верхних дыхательных путей, либо 2) жалобы и симптомы ОРС вновь ухудшаются в течение 10 дней после первоначального улучшения («вторая волна заболевания»). В отличие от прежней версии этих рекомендаций для лучшего разграничения бактериального и вирусного ОРС подчеркивается не столько «персистирование» симптомов заболевания на протяжении 10 дней, сколько «отсутствие улучшения» [1].
В отличие от экспертов Американского общества инфекционистов (IDSA) и канадских специалистов, авторы АО/ФХ не уделяют особого внимания тяжести риносинусита, поскольку не считают это положение убедительно обоснованным с научной точки зрения. Следует признать, что трактовка «тяжести» риносинусита разными группами экспертов весьма различается. Так, по мнению канадских специалистов, о тяжелом риносинусите следует говорить в тех случаях, когда симптомы заболевания переносятся больным плохо и вызывают нарушение сна или ограничивают повседневную деятельность. При этом диагностика риносинусита как тяжелого не зависит от того, есть у больного лихорадка или нет [6]. Напротив, эксперты IDSA под тяжелым риносинуситом понимают начало заболевания с тяжелых симптомов или жалоб на высокую лихорадку (³ 39°С) и гнойное отделяемое из носа, либо боль в лицевой области длительностью не менее 3–4 последовательных дней от начала болезни [5].
Синуситы и антибиотики
Антибиотики – уникальный класс медикаментов. Они воздействуют не на клетки человеческого организма, а на сосуществующих или враждующих с ним бактерий. Целесообразность использования антибиотиков при тяжелых бактериальных инфекциях несомненна. С другой стороны, антибиотики не действуют на вирусы, поэтому при вирусных инфекциях – таких как простуда – они не показаны. А вот оправданность применения антибиотиков при легких бактериальных или смешанных вирусно-бактериальных  инфекциях, склонных к спонтанному разрешению, остается предметом дискуссий.
инфекциях, склонных к спонтанному разрешению, остается предметом дискуссий.
Так, по данным авторов Кокрановского сотрудничества, почти половина больных с клиническим диагнозом ОРС вне зависимости от приема антибиотиков выздоравливает через 10 дней от начала заболевания, а более 70% – через 2 недели (рис. 1) [10]. В другом Кокрановском обзоре в группе лиц, получавших плацебо, суммарная доля выздоровевших пациентов и тех, у кого наступило улучшение, на 7–15 сут. лечения оказалась равной 86% (в то время как аналогичная доля больных среди лиц, получавших антибиотики, составила 91%) [11]. Иными словами, 5 взрослых людей из 100 с клиническим диагнозом ОРС между 7 и 14-м днями от начала лечения выздоровеют быстрее, если будут получать антибиотики, а не плацебо. Однако при этом из каждых 8 больных, принимающих антибиотики, 1 пациент испытает побочные эффекты [10].
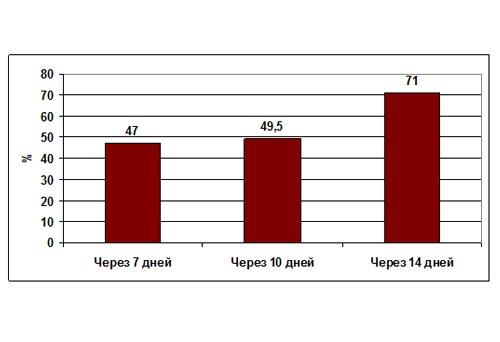
Рисунок 1. Доля излеченных пациентов с ОРС в разные отрезки времени вне зависимости от метода лечения
Когда и кому назначать антибиотики?
Принципиально можно выделить нескольких подходов к назначению антибиотиков при ОРС:
- только пациентам с предполагаемой/подтвержденной бактериальной этиологией заболевания;
- больным с тяжелым течением болезни;
- при возникновении осложнений;
- в случае неэффективности лечения без антибиотиков (любому пациенту).
Ввиду того что пункция гайморовой пазухи в амбулаторной клинической практике производится редко, а инструментальные исследования не позволяют разграничить вирусный и бактериальный риносинусит, ОБРС диагностируют на основании клинических признаков. Назначать антибиотики всем больным с клиническим диагнозом ОБРС вряд ли разумно: во-первых, сохраняется элемент диагностической неопределенности (а действительно ли заболевание имеет бактериальную этиологию?), во-вторых, подавляющее большинство пациентов выздоровеет без применения антибиотиков (можно ограничиться симптоматическими средствами – анальгетиками, местными глюкокортикоидами (интраназально), ирригациями гипертонического или изотонического раствора хлорида натрия (опять-таки интраназально), либо обойтись вовсе без них).
Доказательства обоснованности назначения антибиотиков пациентам с тяжелым течением ОРС в настоящее время отсутствуют [1]. Можно согласиться, что критерии тяжести в научной литературе описаны нечетко (включать ли в них повышение температуры тела, и если «да», то каково «пороговое» значение; какие именно симптомы ОБРС должны обязательно присутствовать у больного, а какие – факультативно, и т.д.). Однако во всех рекомендациях разных профессиональных сообществ, опубликованных в последние годы, подчеркивается важность клинического суждения врача. На него и нужно опираться в клинической практике. И если ОБРС расценивается врачом как «тяжелый» – назначать антибиотики. А в качестве критериев тяжести можно использовать предложения либо канадских специалистов, либо экспертов IDSA, изложенные выше.
При возникновении (инфекционных) осложнений ОБРС антибиотики, безусловно, назначаются, однако использовать данный критерий нелогично: во-первых, возникают вопросы к квалификации врача (а почему он ничего не сделал раньше и допустил развитие осложнений?), во-вторых, появление осложнений требует от врача общей практики/терапевта немедленной передачи пациента специалисту (как правило, оториноларингологу, очень редко – хирургу или инфекционисту).
Наконец, возможно ли воздержаться от назначения антибиотиков больному ОБРС и ограничиться активным наблюдением (с использованием симптоматических средств или без них) – хотя бы на непродолжительное время? Действительно, у пациентов с нетяжелыми и склонными к спонтанному разрешению инфекциями альтернативами срочной антибактериальной терапии (т.е. назначенной сразу после постановки диагноза) могут быть отсроченное (отложенное) использование антибиотиков, либо лечение без антибиотиков.
В общем виде технология отсроченного (отложенного) применения антибиотиков заключается в выписке рецепта на соответствующий препарат во время осмотра пациента с предложением не начинать его прием (т.е. получать назначенное лечение, но без антибиотиков) в течение определенного промежутка времени (при ОБРС он составляет 1 нед. и более).
При отсроченном использовании антибиотиков рецепт на их приобретение выдается больному одновременно с предложением «отоварить» его в аптеке только в случае ухудшения, либо же рецепт на антибиотик будет доступен для пациента в приемном покое медицинского учреждения (или у лечащего врача), но только в случае повторного обращения в связи с ухудшением или отсутствием улучшения.
Применение данной технологии обычно ограничивают группами больных с низким риском развития осложнений. Аргументы «за» и «против» отсроченного назначения антибиотиков или лечения с использованием исключительно неантибактериальных средств представлены в таблице 1 [12].
Таблица 1. Достоинства и недостатки отсроченного назначения антибиотиков/лечения без антибактериальных препаратов у больных с нетяжелыми инфекциями верхних дыхательных путей
|
Достоинства |
Недостатки |
|
Снижение стоимости лечения |
Решение о неназначении/отложенном назначении антибиотиков может не соответствовать ожиданиям больного, его родственников или опекунов |
|
Снижение риска нежелательных лекарственных явлений |
Риск усугубления клинической симптоматики, а также развития инфекционных и/или постинфекционных осложнений |
|
Снижение риска возникновения и распространения резистентности к антибиотикам |
В случаях усугубления клинической симптоматики или развития осложнений возрастает риск разного рода личностного, материального, административного, юридического, карьерного ущерба для врача |
|
Допустимость и безопасность технологий подтверждена в клинических исследованиях |
|
В Кокрановском обзоре проанализированы 10 рандомизированных клинических исследования при острых инфекциях дыхательных путей, в которых тестировались отложенное применение и лечение без антибиотиков [13]. Целями исследования были:
- сравнение клинических исходов, включая длительность и тяжесть болей, недомогания, лихорадки, кашля, насморка при фарингите, остром среднем отите, остром бронхите (кашель) и простуде;
- оценка использования антибиотиков, удовлетворенности пациентов лечением, резистентности к антибиотикам, частоты повторных консультаций при использовании альтернативных стратегий терапии.
Хотя среди изученных нозологических единиц не было ОБРС, выводы авторов имеют непосредственное отношение к обсуждаемой теме. По их заключению, эффективность и безопасность отложенного назначения антибиотиков или лечения без антибиотиков у больных с нетяжелыми инфекциями дыхательных путей подтверждены в ходе клинических исследований. Кроме того, удовлетворенность больных лечением (или их родственников/опекунов) при использовании обеих технологий была высокой, хотя в реальной клинической практике может оказаться ниже.
Авторы подчеркнули, что решение о назначении или «неназначении» антибиотиков остается на усмотрение лечащего врача. Например, исходное тяжелое состояние пациента служит достаточным основанием для назначения антибиотиков во время его первого обращения за медицинской помощью. Если же врач ощущает, что больного можно безопасно лечить без антибиотиков – так и следует поступить. Когда процесс выздоровления затягивается, возникает «вторая волна» заболевания, либо присоединяются осложнения, – также назначают антибиотики [13].
Учитывая высокую частоту спонтанного выздоровления и улучшения у больных ОБРС [10, 11], в публикациях последних лет широко рекомендуется активное наблюдение без применения антибиотиков [1, 5, 6]. Однако продолжительность периода времени «активного наблюдения» в них широко варьирует. Канадские специалисты резервируют антибиотики для больных с нетяжелым ОБРС, у которых отсутствует позитивная динамика спустя 72 ч лечения интраназальными глюкокортикоидами и у кого длительность симптомов превышает 7 сут. [6]. Эксперты IDSA рекомендуют назначать антибиотики сразу же после постановки диагноза ОБРС. Однако критериями этого диагноза, наряду с исходно тяжелым течением на протяжении 3–4-х дней и «второй волной» заболевания, является «начало заболевания с персистирующих жалоб или симптомов, совместимых с диагнозом острого риносинусита, длительностью ³ 10 дней, в отсутствие доказательств клинического улучшения» [5]. Наконец, эксперты АО/ФХ рассматривают активное наблюдение как альтернативу назначению антибиотиков сразу после постановки диагноза ОБРС – вне зависимости от исходной тяжести заболевания. Отсутствие улучшения в течение 7 дней активного наблюдения является основанием для назначения антибиотиков [1].
Подведем итоги. Несмотря на определенные разногласия в оценках специалистов, антибиотики назначают больным с клиническим диагнозом неосложненного ОБРС при:
- исходно тяжелом течении заболевания (клиническое суждение лечащего врача);
- «второй волне» болезни (ухудшении состояния после первоначального улучшения);
- отсутствии улучшения спустя 7 сут. симптоматического лечения без антибиотиков.
Какие антибиотики назначать и как долго?
Препаратом выбора является амоксициллин – с клавулановой кислотой или без нее [1]. Продолжительность антибактериальной терапии у взрослых составляет 5–7–10 сут., у детей – 10–14 дней [1, 5].
Почему амоксициллин? Прежде всего потому, что он:
- активен в отношении ключевых возбудителей ОБРС;
- эффективен при лечении данного заболевания (доказано многочисленными рандомизированными клиническими исследованиями в разных странах мира);
- безопасен;
- недорогой;
- обладает сравнительно узким спектром микробиологической активности [11, 14–16].
Эксперты IDSA высказались за то, чтобы лечение ОБРС у детей и взрослых начинать сразу с амоксициллина/клавуланата [5]. Основные аргументы в пользу такой рекомендации были следующие:
- в США доля influenzae в этиологии риносинуситов существенно возросла со времени внедрения в клиническую практику конъюгированных противопневмококковых вакцин [17];
- резистентность influenzae к ампициллину вследствие выработки b-лактамаз в 2005–2007 гг. составляла 27–43% [18].
Однако в Украине и в Казахстане 7- и 13-валентые конъюгированные противопневмококковые вакцины не используются (по крайней мере, широко). Поэтому можно полагать – хотя бы до тех пор, пока не будет доказано обратное – что этиологическая значимость пневмококков в наших странах остается высокой, а гемофильных палочек – существенно ниже. Распространенность же штаммов H. influenzae, продуцирующих b-лактамазы, в Украине и Казахстане еще предстоит изучить. Данные, полученные российскими исследователями, также выглядят вполне оптимистично. Поэтому в настоящее время нет оснований отказываться от приоритетного выбора амоксициллина. В его поддержку высказались и американские эксперты из АО/ФХ в последних по времени публикации рекомендациях (2015) [1]. Они же охарактеризовали и факторы, в каких случаях предпочтение все-таки отдается амоксициллину в комбинации с клавулановой кислотой (табл. 2).
Таблица 2. Факторы, побуждающие клиницистов предпочесть амоксициллин/клавуланат чистому амоксициллину при лечении больных с ОБРС
|
Фактор |
Комментарий |
|
Ситуации, в которых вероятна антибиотикорезистентность |
Лечение антибиотиками в предшествующий месяц |
|
Тесный контакт с получающими лечение пациентами, медработники, медицинские учреждения |
|
|
Неэффективность предшествующей антибактериальной терапии |
|
|
Возникновение инфекции, несмотря на (антибиотико)профилактику |
|
|
Тесный контакт с детьми в дошкольных учреждениях |
|
|
Курение или наличие курильщика в семье |
|
|
Высокая распространенность резистентных бактерий в окружающей среде |
|
|
Среднетяжелая и тяжелая инфекция |
Среднетяжелые и тяжелые симптомы ОБРС |
|
Затяжные симптомы ОБРС |
|
|
Синусит лобных или клиновидных пазух |
|
|
Рецидивирующие ОБРС в анамнезе |
|
|
Сопутствующие заболевания или старческий возраст |
Сопутствующие заболевания, включая сахарный диабет, хронические заболевания сердца, печени, почек |
|
Иммунодефицитное состояние |
|
|
Возраст старше 65 лет |
Амоксициллин с клавуланатом и без него выпускается в разных лекарственных формах для приема внутрь. Оптимальными для использования являются диспергируемые таблетки амоксициллина. В них амоксициллин (с клавулановой кислотой или без нее) заключен в кислотоустойчивые гранулы, из которых, собственно, и формируется таблетка. Поэтому антибиотик не подвергается частичному разрушению под воздействием желудочного сока, как происходит при приеме обычных таблеток, а почти полностью всасывается в тонком кишечнике. Биодоступность амоксициллина (± клавуланат) при приеме диспергируемых таблеток составляет 93%, в то время как при приеме обычных таблеток или капсул – не более 70–80%. В результате почти все действующее вещество достигает системного кровотока и «работает» в очаге воспаления. Недостатками обычных пероральных лекарственных форм амоксициллина (± клавуланат) являются отрицательное воздействие невсосавшейся части дозы на слизистую кишечника и нарушение в нем микроэкологии (угнетается деятельность компонентов нормальной микрофлоры). При использовании диспергируемых таблеток эти недостатки сводятся к минимуму или вовсе отсутствуют.
Еще одно важное достоинство диспергируемых таблеток амоксициллина и амоксииллина/клавуланата – удобство приема. Например, можно выпускать обычные таблетки, содержащие 1 г или даже 2 г амоксициллина, но сделать их небольшими по объему чисто технологически невозможно. Они будут просто «застревать» в горле при проглатывании! Поэтому их пришлось бы делить на части, запивать большим количеством жидкости, а это не только неудобно, но иногда и нежелательно. Диспергируемые таблетки можно как проглатывать целиком, так и растворять в небольшом количестве воды (не менее 30 мл) и принимать необходимую разовую дозу одномоментно без каких-либо затруднений. Приятные органолептические свойства диспергируемых таблеток (легкий фруктовый привкус) служат дополнительным аргументом в их пользу (горький вкус обычных таблеток может отрицательно влиять на соблюдение врачебных рекомендаций детьми и взрослыми).
Для характеристики соблюдения больным рекомендаций врача специалисты Международного общества по фармакоэкономике и изучению исходов (ISPOR) используют 2 понятия: приверженность к лечению (синоним – комплаентность) и постоянство. Первый относится к следованию рекомендациям медработника в отношении времени приема, дозы и частоты приема медикаментов, т.е. характеризует «степень, с которой пациент поступает в соответствии с предписанными интервалом и дозой режима дозирования». Постоянство относится к следованию рекомендациям по продолжению лечения на протяжении предписанного промежутка времени и характеризует «продолжительность времени от начала до прекращения лечения» [19]. Есть все основания полагать, что назначение антибиотиков в виде диспергируемых таблеток будет способствовать улучшению обоих показателей соблюдения пациентами врачебных рекомендаций.
Проблема «постоянства», т.е. приема антибиотиков на протяжении всего предписанного курса лечения, на самом деле далеко не праздная. Досрочное прекращение лечения (потому что больной ощущает себя выздоровевшим, возникли побочные эффекты или по любой другой причине) сопряжено с риском рецидивов, возникновения осложнений, повторного инфицирования и т.д. В этой связи обнадеживают недавние данные о сопоставимой эффективности менее продолжительных (5–7 дней) и традиционных (10–14 дней) курсов антибактериальной терапии риносинуситов [20]. Поэтому рекомендуемая длительность курса лечения взрослых больных составляет 5–7 (до 10 дней) [1, 5]. В то же время, доступные данные не позволяют обосновать эффективность и безопасность менее продолжительных курсов антибактериальной терапии риносинуситов у детей. Поэтому она пока остается неизменной: 10–14 дней [5].
Детям амоксициллин назначается внутрь по 40 мг/кг/сут. в 3 приема или по 45 мг/кг/сут. в 2 приема; доза амоксициллина/клавуланата при приеме внутрь – 45 мг/кг/сут. (по амоксициллину) в 2 приема. Если ребенок получал антибиотики по любому поводу в предшествующие 6 нед. или же стартовая терапия препаратом выбора (амоксициллином) оказалась неэффективной, то ему назначают амоксициллин/клавуланат внутрь в дозе 90 мг/кг/сут. (по амоксициллину) в 2 приема.
У взрослых разовая доза амоксициллина при приеме внутрь составляет 0,5–1,0 г; антибиотик принимают 3 раза в сутки; амоксициллин/клавуланат применяют внутрь по 0,625 г 3 раза в сутки или по 1,0 г 2 раза в сутки. Если пациент получал антибиотики по любому поводу в предшествующие 6 нед. или же стартовая терапия амоксициллином не оказала эффекта, назначают амоксициллин/клавуланат внутрь по 2,125 г 2 раза в сутки. Высокие дозы амоксициллина/клавуланата рекомендуются также пациентам группы высокого риска инфицирования пенициллино-резистентными пневмококками. К ним относятся больные, проживающие в регионах с высоким эндемичным распространением инвазивных пенициллино-резистентных S. pneumoniae (>10%), лица с тяжелыми риносинуситами (например, с признаками системной токсичности, повышением температуры тела ≥ 39º С и при наличии угрозы гнойных осложнений), в возрасте > 65 лет, находившиеся в недавнем прошлом в стационаре, а также пациенты с иммунодефицитом [1, 20].
У взрослых с анамнестическими указаниями на аллергические реакции на антибиотики группы пенициллинов применяют доксициклин внутрь по 0,1 г 2 раза в сут. (тоже выпускается в лекарственной форме в виде диспергируемых таблеток) или респираторные фторхинолоны (левофлоксацин внутрь по 0,5–0,75 г 1 раз в сутки (при использовании в дозе 0,75 г курс лечения составляет 5 дней) или моксифлоксацин внутрь по 0,4 г 1 раз в сутки) [12]. Предпочтение обычно отдается доксициклину [1].
Поскольку доксициклин применяется в педиатрической практике только у детей старше 8 лет, а фторхинолоны не используются вовсе, при наличии анамнестических указаний на аллергию на пенициллины детям назначают макролиды (азитромицин внутрь по 10 мг/кг/сут. в 1 прием сроком на 3 дня, кларитромицин внутрь по 15 мг/кг/сут. в 2 приема). Американские эксперты возражают против использования макролидов у больных риносинуситами из-за высокого распространения устойчивости пневмококков к этому классу антибиотиков в США [21]. Однако в более благополучных в этом отношении странах (к которым, надо полагать, относятся и Украина, и Казахстан) нет оснований отказываться от макролидов. Тем более что авторы Кокрановского сотрудничества подтвердили сопоставимую эффективность макролидов и амоксициллина/клавуланата у больных с ОРС, причем макролиды переносились лучше [11]. Другими альтернативами у детей с аллергией на пенициллины могут быть левофлоксацин внутрь по 10–20 мг/кг/сут. в 1–2 приема (только при гиперчувствительности немедленного типа, рекомендация экспертов IDSA [5]) или клиндамицин внутрь по 30–40 мг/кг/сут. в 3 приема в комбинации с пероральным цефалоспорином III поколения (цефиксим по 8 мг/кг/сут. в 1–2 приема или цефподоксима проксетил по 10 мг/кг/сут. в 2 приема; комбинированная терапия используется при гиперчувствительности любого типа, кроме немедленного).
Эффективность антибактериальной терапии принято оценивать спустя 48–72 ч после начала лечения. Эксперты АО/ФХ предлагают «расширить» сроки оценки клинической неудачи у больных ОБРС до 7 сут. [1]. Саму клиническую неудачу они определяют как ухудшение или отсутствие улучшения в указанный временной промежуток. Ухудшение трактуется ими как прогрессирование имеющихся или появление новых жалоб и симптомов ОБРС. Отсутствие улучшения они понимают буквально и не распространяют этот термин на больных с персистирующими, но постепенно улучшающимися симптомами.
Свое предложение использовать 7-дневный срок для оценки эффективности терапии эксперты АО/ФХ обосновывают так. Согласно данным рандомизированных контролируемых исследований, частота улучшения в группе пациентов, принимавших плацебо, на 3–5-й дни от начала вмешательства составляет 30% и статистически незначимо возрастает до 41% в группе лиц, получавших антибиотики [22]. Следовательно, оценка эффективности антибактериальной терапии на 5-й, а тем более на 3-й дни лечения приведет к завышению числа пациентов, «не ответивших» на лечение. Эксперты обращают внимание на то, что и врачи, и больные должны понимать, что промежуток времени до наступления улучшения при ОБРС может быть значительным, до 7 дней, а сохранение симптомов или даже незначительное ухудшение в сроки до 7 дней вовсе не обязательно означают клиническую неудачу. При этом для полного выздоровления (отсутствия всех жалоб и симптомов) может понадобиться 14 дней, а то и больше [1].
В то же время, эксперты АО/ФХ специально оговаривают, что срок 7 дней для оценки успеха или неуспеха терапии не распространяется на больных с тяжелым или осложненным ОБРС, лиц с иммунодефицитами, пациентов, перенесших ранее хирургические вмешательства на околоносовых пазухах, либо с сопутствующими бактериальными инфекциями. В таких случаях врачам предлагается судить о сроках наступления клинической неудачи индивидуально. Для верной оценки таких сроков клиницистам следует обращать внимание также на возраст больного, общее состояние его здоровья, состояние сердечно-сосудистой и дыхательной систем, наличие сопутствующих заболеваний [1].
При подтверждении клинической неудачи при ОБРС (после исключения альтернативных диагнозов и/или осложнений) стартовую антибактериальную терапию изменяют. Если больной начинал лечение с амоксициллина, можно использовать высокие дозы амоксициллина/клавуланата (вплоть до 4,0 г/сут. по амоксициллину). Другими альтернативами могут быть респираторные фторхинолоны (особенно при подозрении на инфицирование пенициллино-резистентными возбудителями), доксициклин или комбинация клиндамицина с пероральным цефалоспорином III поколения (цефиксимом или цефподоксима проксетилом). Длительность терапии в подобных случаях определяется индивидуально.
Заключение
Препаратами выбора для лечения ОБРС являются амоксициллин или амоксициллин/клавуланат. Продолжительность антибактериальной терапии у взрослых составляет 5–7 (до 10) дней, у детей – 10–14 дней. Оптимальной лекарственной формой для приема внутрь амоксициллина (с клавулановой кислотой или без нее) являются диспергируемые таблетки.
Литература
- Rosenfeld R.M., Piccirillo J.F., Chandrasekhar S.S., et al. Clinical practice guideline (update): adult sinusitis. Head Neck Surg. 2015; 152 (2S): S1–S39.
- Snow V., Mottur-Pilson C., Hickner J.M., et al. Principles of appropriate antibiotic use for acute sinusitis in adults. Intern. Med. 2001; 134: 495-497.
- Bhattacharyya N. Chronic rhinosinusitis: is the nose really involved? J. Rhinol. 2001; 15: 169-173.
- Meltzer E.O., Hamilos D.L., Hadley J.A., et al. Rhinosinusitis: establishing definitions for clinical research and patient care. Head Neck Surg. 2004; 131 (6) (suppl): S1-S62.
- Chow A.W., Benninger M.S., Brook I., et al. IDSA clinical practice guideline for acute bacterial rhinosinusitis in children and adults. Infect. Dis. 2012; 54: e72-e112.
- Desrosiers M., Evans G.A., Keith P.K., et al. Canadian clinical practice guidelines for acute and chronic rhinosinusitis. Allergy Asthma Clin. Immunol. 2011; 7: 2.
- Gwaltney M.J. Acute community acquired sinusitis. Clin. Infect. Dis. 1996; 23: 1209-1223.
- Slavin R.G. Sinusitis: viral, bacterial, or fungal and what is the role of Staph? Allergy Asthma. Proc. 2006; 27: 447-450.
- Benninger M.S., Appelbaum P.C., Denneny J.C., et al. Maxillary sinus puncture and culture in the diagnosis of acute rhinosinusitis: the case for pursuing alternative culture methods. Head Neck Surg. 2002; 127: 7-12.
- Lemiengre M.B., van Driel M.L., Merenstein D., et al. Antibiotics for clinically diagnosed acute rhinosinusitis in adults. Cochrane Database Syst. Rev. 2012, Issue 10. Art. No.: CD006089.
- Ahovuo-Saoranta A., Rautakorpi U.M., Borisenko O.V., et al. Antibiotics for acute maxillary sinusitis in adults. Cochrane Database Syst. Rev. 2014; 11; CD000243.
- Березняков И.Г. Краткий справочник по эмпирическому использованию антибиотиков с лечебной и профилактической целью. Киев: Корпорация Артериум, 2014. – 200 с.
- Spurling G.K.P., DelMar C.B., Dooley L., Foxlee R., Farley R. Delayed antibiotics for respiratory infections. Cochrane Database of Systematic Reviews 2013, Issue 4. Art. No.: CD004417.
- de Bock G.H., Dekker F.W., Stolk J., et al. Antimicrobial treatment in acute maxillary sinusitis: a meta-analysis. Clin. Epidemiol. 1997; 50: 881-890.
- Lau J., Zucker D., Engels E.A., et al. Diagnosis and treatment of acute bacterial rhinosinusitis. Evidence Report/Technology Assessment No. 9 (Prepared by Tufts-New England Medical Center Evidence-based Practice Center under Contract No. 290-08-0019). Rockville, MD: Agency for Healthcare Research and Quality; 1999.
- Snow V., Mottur-Pilson C., Hickner J.M., et al. Principles of appropriate antibiotic use for acute sinusitis in adults. Ann. Intern. Med. 2001;134:495-497.
- Brook I., Foote P.A., Hausfeld J.N. Frequency of recovery of pathogens causing acute maxillary sinusitis in adults before and after introduction of vaccination of children with the 7-valent pneumococcal vaccine. Med. Microbiol. 2006; 55: 943-946.
- Sahm D.F., Brown N.P., Draghi D.C., et al. Tracking resistance among bacterial respiratory tract pathogens: summary of findings of the TRUST Surveillance Initiative, 2001-2005. Postgrad. Med. 2008; 120 (3) (suppl 1): 8-15.
- Cramer J.A., Roy A., Burrell A., et al. Medication compliance and persistence: terminology and definitions. Value Health. 2008; 11 (1): 44–47.
- Brook I., Gober AE. Resistance to antimicrobials used for therapy of otitis media and sinusitis: effect of previous antimicrobial therapy and smoking. Ann. Otol. Rhinol. Laryngol. 1999; 108: 645-647.
- Harrison C.J., Woods C., Stout G., et al. Susceptibilities of Haemophilus influenzae, Streptococcus pneumoniae, including serotype 19A, and Moraxella catarrhalis paediatric isolates from 2005 to 2007 to commonly used antibiotics. J. Antimicrob. Chemother. 2009; 63: 511-519.
- Rosenfeld R.M., Andes D., Bhattacharyya N., et al. Clinical practice guideline: adult sinusitis. Head Neck Surg. 2007; 137 (3) (suppl): S1-S31.







