Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "БОЛЕЗНЬ ДЕПОНИРОВАНИЯ КРИСТАЛЛОВ ПИРОФОСФАТА КАЛЬЦИЯ"
Автор: В.В. Цуркo, С.М. Носков, С.Д. Дыбин
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Травматология и ортопедия
Просмотров: 2 306
Дата проведения: с 01.06.2015 по 01.06.2016
 В последнее время пристально изучается роль кристаллов пирофосфата кальция (ПФК) дигидрата в развитии патологии опорно-двигательного аппарата. Болезни, связанные с отложением кристаллов кальция, нарастают с возрастом, составляя 10-15% в 65-75 лет, и достигают 40% у лиц старше 80 лет.
В последнее время пристально изучается роль кристаллов пирофосфата кальция (ПФК) дигидрата в развитии патологии опорно-двигательного аппарата. Болезни, связанные с отложением кристаллов кальция, нарастают с возрастом, составляя 10-15% в 65-75 лет, и достигают 40% у лиц старше 80 лет.
При подозрении на отложение кристаллов ПФК следует анализировать у пациента факторы риска и сопутствующие болезни, включая остеоартроз, частую микротравматизацию суставов, лучевую нагрузку, нормофосфатемическую гиперфосфатурию и др. Подтверждают депозицию ПФК поляризационной световой микроскопией в виде характерных кристаллов (параллелепипедной формы, преимущественно внутриклеточных, со слабым светоотражением или его отсутствием) в синовиальной жидкости (рис. 1). В последнее время для визуализации кристаллов ПФК предлагается использовать люминесцентную микроскопию с применением кальций-чувствительного флуоресцентного зонда Fluo-4. Данный метод позволяет проводить и проточную цитометрию для быстрого полуколичественного анализа кристаллов.

Рисунок 1. В синовиальной жидкости кристаллы параллелепипедной формы, располагаются преимущественно внутриклеточно, со слабым светоотражением или его отсутствием
Рентгенологически выявляемый хондрокальциноз (ХК) подтверждает наличие депозитов ПФК, но его отсутствие не исключает этих депозитов. Рентгенограммы соответствующего качества являются легким и надежным методом возможного обнаружения депозитов ПФК как в суставных, так и в периартикулярных тканях. Рентгенологическая картина ХК напоминает деформирующий остеоартроз, но локализация изменений отличается от него. Отличительный признак ХК – обызвествление хряща как крупных опорных, так и мелких суставов, а также суставной капсулы и мягких тканей. Как правило, в начале болезни наблюдается поражение одного или обоих (медиального и латерального) бедренно-большеберцовых сочленений и тяжелое поражение бедренно-надколенникового сочленения (иногда бывает изолированным). Заподозрить ХК позволяет слабо выраженное обызвествление суставов запястья и суставного диска лучезапястного сустава. Ультразвуковое исследование на приборе высокого разрешения может визуализировать депозиты кристаллов ПФК обычно в виде гиперэхогенных включений внутри гиалинового и/или фиброзного хряща в 68,7% случаев при ХК.
Сцинтиграфия и МРТ в диагностике ХК больше не применяются, поскольку обызвествление дисков и связок лучше визуализируется на КТ. Предварительный диагноз, как правило, ставят по данным рентгенологического исследования и подтверждают наличием кристаллов в синовиальной жидкости.
Клинические формы болезни депонирования ПФК
Отложение кристаллов ПФК характеризуется большим спектром клинических фенотипов – от бессимптомной формы до острой (псевдоподагра) и хронической (остеоартроз с депозицией кристаллов ПФК, хронический артрит с кристаллами ПФК, хондрокальциноз).
Острый артрит, или псевдоподагра, составляет 25% случаев болезни депонирования ПФК. Распространенность среди взрослых 40–79 лет составляет 2,4–4,5%. Острый артрит – результат образования и депонирования кристаллов ПФК в суставах с развивающимся в этой связи воспалением иммунного характера. Псевдоподагра характеризуется болью, гиперемией и отеком сустава, достигающих пика за 12–36 ч. Встречается с равной частотой у мужчин и женщин. Приступ псевдоподагры характеризуется менее выраженным болевым синдромом и медленнее достигает пика клинических проявлений по сравнению с подагрой. Как правило, поражается один сустав (в 50% случаев коленный), хотя описаны случаи олиго- и полиартритических атак псевдоподагры. Острая атака псевдоподагры с поражением лучезапястного сустава может привести к развитию запястного туннельного синдрома. Приступ псевдоподагры проходит самостоятельно (без лечения) в течение месяца. В период между атаками клинически не проявляется.
Пациенты с идиопатической псевдоподагрой, как правило, старше 55-60 лет. Важную роль в возникновении острой атаки играют изменения электролитного баланса с колебаниями концентрации кальция в сыворотке крови. Как и при истинной подагре провоцирующими факторами могут быть травма, хирургическое вмешательство, нарушение мозгового кровообращения и инфаркт миокарда. Отмечена сезонность – приступы достоверно чаще возникают весной.
Хронический артрит с кристаллами ПФК составляет 5% болезней депонирования ПФК. Он предполагает наличие суставного синдрома с системным воспалением (подъем уровня СРБ и СОЭ), утренней скованностью, семейным артрологическим анамнезом. Суставной синдром проявляется симметричным поражением пястно-фаланговых (обычно II–III пальцев), коленных, лучезапястных и локтевых суставов. Воспалительный процесс вялотекущий, может длиться недели и месяцы. При осмотре обнаруживают ограничение подвижности сустава и сгибательную контрактуру (псевдоревматоидная форма). У 10% больных, как и у здоровых пожилых людей, определяется ревматоидный фактор в низком титре.
Остеоартроз с депозитами ПФК возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, рентгенологически обычно обнаруживают хондрокальциноз. При этом, в отличие от ОА без кристаллов ПФК, наблюдается больше воспалительных признаков и атипичное поражение (лучезапястный или среднезапястный, плечевой, суставы средней части стопы), менее выраженный остеофитоз и кистовидная перестройка.
Излюбленная локализация депозитов кристаллов ПФК – мениски коленных суставов область треугольного хряща лучезапястных суставов (рис. 2 и 3). Последние играют жизненно важную роль в передаче нагрузки, амортизации и стабильности сустава. Дегенерация и кальцификация менисков – ключевые особенности ОА коленных суставов. Появляется все больше данных, что мениски коленных суставов не остаются пассивными в процессе развития ОА. Дегенерация менисков способствует сужению межсуставной щели. Кальцификация менисков нарастает с возрастом и коррелирует с поражением хряща у лиц без симптомов артрита в анамнезе.
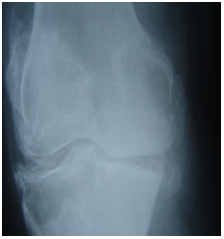
Рисунок 2. Пирофосфатная артропатия (отложение кристаллов пирофосфата кальция в область мениска коленного сустава)
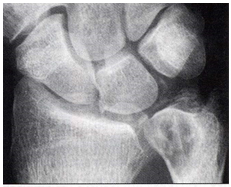
Рисунок 3. Кальцификация треугольного хряща лучезапястного сустава
Лечение.
В рекомендациях EULAR сформулированы ключевые пункты для лечения и профилактики болезни депонирования, кристаллов ПФК, включающие немедикаментозное и медикаментозное лечение. Так, в случае острого артрита с кристаллами ПФК оптимальное лечение включает холодовые аппликации, покой, аспирацию синовиальной жидкости и внутрисуставное введение длительно действующих глюкокортикоидов. Эффективны НПВП (перорально) и низкие дозы колхицина (0,5 мг 3-4 раза в день с начальной дозы в 2 мг или без нее), но применение последних лимитируется коморбидностью пациентов и их токсичностью.
ОА с пирофосфатной кальцификацией протекает с упорным болевым и воспалительным синдромом, что является показанием для постоянной потребности в НПВП. При обсуждении вопроса о выборе НПВП у этих пациентов следует учитывать следующие положения: при пероральном приеме, учитывая наличие «микрокристаллических атак», должна достаточно быстро создаваться терапевтическая концентрация НПВП в крови и синовиальной жидкости, т. е. он должен хорошо проникать через синовиальную мембрану. НПВП должен обладать достаточно выраженными противовоспалительными свойствами, подавляя не только синтез провоспалительных цитокинов (IL-1b, IL-6, TNF-α, PGЕ2 в синовии, но и ингибируя фагоцитарную и хемотаксическую активность моноцитарных макрофагов, а также не оказывать негативного воздействия на метаболизм хондроцитов). Учитывая преимущественно пожилой возраст данной группы больных, НПВП должен характеризоваться высоким профилем безопасности, т. е., как минимум обладать ЦОГ-2-селективностью и не увеличивать риск сердечно-сосудистых осложнений. По рекомендации ВОЗ, основу быстродействующей лекарственной терапии ОА составляют нестероидные противовоспалительные препараты (НПВП). Среди широкого спектра препаратов для купирования болевого синдрома, хорошо зарекомендовавших себя в клинической практике, является нимесулид. В отличие от большинства НПВП, нимесулид селективно ингибирует «провоспалительную» изоформу циклооксигеназы 2 (ЦОГ-2) и не влияет на «физиологическую» ЦОГ-1, он является первым из синтезированных селективных ингибиторов ЦОГ-2.
Известно, что неселективные ингибиторы ЦОГ, т.е. все классические НПВП, способны повышать артериальное давление (АД). Нимесулид, как показано во многих исследованиях, не влияет на АД и не снижает эффективность гипотензивных препаратов. Одновременное ингибирование ЦОГ-1 и ЦОГ-2, свойственное другим НПВП, значительно суживает спектр их применения из-за возможных побочных действий со стороны желудочно-кишечного тракта (ЖКТ). У нимесулида отсутствует негативное влияния на синтез основных компонентов матрикса суставного хряща (хондропротективное действие) в отличие от неселективных НПВП. Еще одним преимуществом при назначении этого препарата является его некислотное происхождение (в молекуле нимесулида карбоксильная группа заменена сульфонанилидом), что обеспечивает дополнительное защитное действие на слизистую оболочку ЖКТ. Основным преимуществом перорального приема нимесулида является его лучшая, по сравнению с другими НПВП, переносимость. В частности, при применении нимесулида намного реже развивались желудочно-кишечные побочные эффекты, что, вероятнее всего, обусловлено его селективностью к ЦОГ-2. Нимесулид оказывает противовоспалительное, анальгезирующее, жаропонижающее действие. Существенным фактором безопасности Найза является наличие антибрадикининового и антигистаминного действия, что не менее важно, чем противовоспалительное действие.
Особого внимания заслуживает последовательное применение кеторолака и нимесулида . Схема ступенчатой терапии острой неспецифической боли в пояснично-крестцовом отделе позвоночника: кеторолак инъекции (1-2 сут.), кеторолак табл. (3-5 сут.), далее нимесулид табл. 100 мг 2 р/д (6-16 сут.). Предложенная схема купирования болевого синдрома позволяет при необходимости продлить терапию препаратом нимесулид 200 мг/сут до 7-10 дней. В ревматологической практике допустимо назначать нимесулид до 200 мг/сут длительностью до 12 месяцев.
Для того чтобы избежать негативное воздействие НПВП на гастродуоденальную слизистую оболочку, используют протективные свойства молекул действующих веществ, содержащих NO-группу (CINOD). Использование протективных свойств NO для повышения безопасности НПВП послужило основанием для создания на основе неселективного НПВП толметина препарата амтолметин гуацил (АМГ), обладающего гастропротективными свойствами. В клинических исследованиях продемонстрирован противовоспалительный, обезболивающий и жаропонижающий эффекты амтолметина гуацил сравнимы с таковыми у неселективных НПВП. В ряде рандомизированных доклинических исследований на экспериментальных моделях (крысы, мыши) была оценена эффективность АМГ и его метаболитов, изучены механизмы влияния на слизистую оболочку желудка и 12-перстной кишки, показаны гастропротекторные эффекты.
При анализе в контролируемых, рандомизированных клинических исследованиях показано, что противовоспалительное и обезболивающее действие АМГ эквивалентно другим НПВС, таким как диклофенак, напроксен, пироксикам, толметин и др. при лечении ОА, в том числе коксартроза и ревматоидного артрита. В одном из исследований дана оценка эффективности применения АМГ в сравнении с диклофенаком у женщин пожилого возраста с разной патологией костно-суставной системы (коксартроз, гонартроз, ревматоидный артрит и др.). В исследование вошли 50 пациенток, 25 из которых получали АМГ и 25 – диклофенак. Курс лечения составил 30 дней. Режим дозирования: АМГ– в первые 3 дня по 1 табл. (600 мг) через каждые 12 ч натощак, в остальные 27 дней – 1 табл. натощак; диклофенак – 3 табл. (50 мг) после приема пищи. Анализ данных подтвердил незначительное улучшение со стороны слизистой оболочки на 30 день исследования в группе больных, принимавших АМГ. Тогда как в группе, принимавшей диклофенак, отмечено увеличение индекса Грэхема (оценка негативного влияния на слизистую желудка). В ходе исследования выявлено, что в целом при приеме АМГ наблюдалось более значимое улучшение состояния (в процентном выражении) в сравнении с диклофенаком: 79% и 54,2%, соответственно.
В другом исследовании проведено сравнительное сопоставление по оценке эффективности и безопасности АМГ и целекоксиба у больных РА. В исследование вошли 235 больных РА (180 из них закончили исследование): основная группа (n=85) получали АМГ в дозировке 600 мг 2 р/с, группа сравнения (n=95) – целекоксиб 200 мг/с в течение 24 недель. Эффективность терапии РА оценивалась по индексу Американской коллегии ревматологов. Согласно результатам исследования, лекарственные препараты имеют сопоставимую эффективность и безопасность при оценке динамики показателей на 4-й, 12-й и 24-й неделе лечения. Показано, что амтолметин гуацил хорошо переносится пациентами при длительном применении (в течение 6 мес.).
При недостаточной эффективности терапии острого и/или обострении хронического артрита с кристаллами ПФК может быть использован также короткий курс глюкокортикоидов внутрь, а также пероральное или парентеральное применение адренокортикотропного гормона (по 40-80 ЕД внутримышечно через 12 ч по необходимости, обычно 1-3 инъекции).
При хроническом воспалительном артрите – НПВП (при необходимости гастропротекторная терапия), колхицин (0,5-1 мг в день), низкие дозы глюкокортикоидов, метотрексат и гидроксихлорохин. Предполагается, что метотрексат, как противовоспалительный препарат, может быть эффективен в дозе 10–20 мг/нед. при отсутствии результатов других методов лечения.
Проведенное сравнительное исследование по оценке локальной терапии (1-4-кратное внутрисуставное введение глюкокортикоидов или метотрексата) у пациентов с хроническим резистентным синовитом у больных I группы с остеоартрозом и II группы с остеоартрозом в сочетании с депозицией кристаллов ПФК показало, что у пациентов II группы в отличие от пациентов I группы, отмечался низкий клинический ответ на локальную перфузионную терапию и внутрисуставное введение кортикостероидов. Во II группе средством выбора может быть локальная терапия метотрексатом [13].
Профилактику частых атак артрита с кристаллами ПФК можно проводить низкими дозами колхицина (0,5–1 мг ежедневно) или низкими дозами НПВП (с гастропротекцией при необходимости).
В отличие от подагры, в настоящее время не созданы препараты, модифицирующие формирование кристаллов ПФК или позволяющие их растворять. Бессимптомные депозиты ПФК – не показание для терапии. Теоретически ингибировать кальцификацию можно воздействием либо на отложение кальция (физическая цель), или на клетки (биологическая мишень). Ориентация терапии на клеточный, генетический или эпигенетический уровень будет не только препятствовать образованию и росту отложений кальция, но и конвертировать измененные при ОА клетки хряща и мениска в более физиологически функционирующее состояние.
В заключение о некоторых новых аспектах лекарственной терапии, имеющих отношение к болезни депонирования кристаллов ПФК. В работе M. Fahey и соавт. исследовалось действие дексаметазона на формирование кристаллов ПФК in vitro в культуре свиных хондроцитов при инкубации с АТФ. Оказалось, что дексаметазон дозозависимо увеличивают АТФ-обусловленную минерализацию и активность только трансглутаминазы, а активность щелочной фосфатазы и пирофосфат-фосфогидролазы не изменялась. Логично, что ингибиторы трансглутаминазы подавляли формирование кристаллов ПФК. Эти данные позволяют по-новому взглянуть на важную роль трансглутаминазы и акцентируют внимание на возможной инициирующей роли локальной глюкокортикоидной терапии в отложении кристаллов ПФК.
Колхицин подавляет вызываемое кристаллами ПФК воспаление, а также ингибирует эластазу и матричную металлопротеиназу. Эти два фермента играют важную патогенетическую роль в первичном ОА. Возможно, колхицин может, подавляя их активность, оказывать хондропротекторное действие.
Учитывая патогенез болезни депонирования кристаллов ПФК, представляется перспективным исследование широкого спектра локальной антифлогистической терапии, начиная с таких известных средств, как препараты гиалуроновой кислоты и метотрексата.
Таким образом, болезнь депонирования кристаллов пирофосфата кальция занимает лидирующее положение среди болезней суставов. В основе его лежат активные процессы как дегенеративно-деструктивные, так и репаративные. Они развиваются в ответ на различные повреждения и осуществляются с помощью саморегулирующейся системы со стереотипной динамикой, принципиально не зависящей от типа повреждения. В разные фазы болезни меняются типы клеточного взаимодействия, переходя от одних популяций клеток к другим через межклеточное взаимодействие путем синтеза различных медиаторов, в том числе цитокинов, факторов роста и экспрессии их рецепторов.
Достаточно высокая эффективность ацеклофенака связана с его уникальной в известной мере способностью многокомпонентно подавлять воспаление, воздействуя в том числе, и на цитокиновую активность, а не только на ЦОГ-2 ПГ Е2. К особенностям действия этого препарата относится и способность его главного метаболита (4-гидроксиацеклофенака) подавлять воспалительную активность хондроцитов при ОА и стимулировать продукцию глюкозоаминокгликанов, позволяющую обсуждать его уникальность как препарата, обладающего хондропротективными свойствами.
Результаты полученных российских и европейских крупномасштабных исследований позволяют говорить о бесспорных преимуществах терапии ацеклофенаком воспалительных и дегенеративно-дистрофических заболеваний, сопровождающихся суставным синдромом в повседневной клинической практике.







