Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Фибрилляция предсердий – состояние проблемы"
Автор: Дядык А.И., Багрий А.Э.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Кардиология, Семейная медицина/Терапия
Просмотров: 1 937
Дата проведения: с 18.08.2014 по 18.08.2015
Определение. Общие вопросы. Актуальность
Фибрилляция предсердий (ФП) характеризуется наличием нерегулярной некоординированной электрической активности миокарда предсердий с полным или почти полным отсутствием их сократительной функции.
На ЭКГ зубцы Р отсутствуют, вместо них имеются частые нерегулярные осцилляции (волны f фибрилляции), ритм желудочков нерегулярный, обычно частый (при отсутствии лечения и нарушений проводимости).
У пожилых ФП нередко сочетается с нарушениями проводимости, она может быть компонентом (и / или первым проявлением) синдрома слабости синусового узла; у таких больных могут иметь место соответствующие клинические проявления (пресинкопы / синкопы и др).
Вопросы диагностики и выбора адекватных лечебных подходов при ФП неизменно остаются в центре внимания клиницистов всего мира, организаторов здравоохранения и общества в целом. Представления о лечебно-диагностической тактике при ФП постоянно обновляются и дополняются: публикуются результаты новых крупных рандомизированных исследований и мета-анализов; экспертами авторитетных кардиологических ассоциаций совершенствуются соответствующие Рекомендации, например: (1) Рекомендации по лечению ФП Европейского общества кардиологов (European Society of Cardiology – ESC), 2012; (2) Рекомендации по лечению больных с ФП (American Heart Association, American College of Cardiology, Heart Rhythm Society – AHA/ACC/HRS), 2014. Все это диктует необходимость своевременного критического анализа новой информации и ее представления в доступной форме практикующим врачам.
В настоящим семинаре мы кратко представим современные взгляды на вопросы эпидемиологии, этиологии, патогенеза и клинической картины ФП, уделим особое внимание рассмотрению различных аспектов лечебной тактики, включая профилактику ТЭО, контроль частоты желудочковых сокращений и контроль ритма (с восстановлением синусового ритма), рассмотрим вопросы электрической и фармакологической кардиоверсии, представим характеристику противоаритмических препаратов (ПАП), которые находят применение в лечении больных с ФП, кратко остановимся на вопросах брадикардии при ФП, а также выполнения абляции и хирургического лечения ФП.
Эпидемиология ФП.
ФП — самое частое среди требующих лечения нарушений ритма сердца. Ее распространенность составляет около 1 % в общей популяции и увеличивается с возрастом, составляя примерно 6 % у 60–80-летних и достигая 10 % у лиц старше 80 лет.
Развитие ФП приводит к ряду неблагоприятных гемодинамических изменений, включая устранение предсердного вклада в наполнение желудочков, нерегулярность их наполнения, нередко — высокую частоту желудочкового ритма. Следствием этих изменений является снижение эффективности наполнения желудочков и изгнания крови из них. Вследствие того, что предсердия при ФП не сокращаются, уменьшается сердечный выброс, что может способствовать развитию сердечной недостаточности или усиливать ее проявления. ФП хуже переносится пожилыми в сравнении с лицами среднего возраста, т.к. утрата систолы предсердий при ФП приводит к более выраженному снижению сердечного выброса в условиях нарушенного диастолического наполнения ЛЖ (из-за фиброза и повышения жесткости миокарда, что присуще пожилым лицам даже без сопутствующих состояний; еще более выражены эти явления при наличии сопутствующих АГ, гипертрофии ЛЖ, митрального стеноза).
ФП сопровождается отчетливым увеличением риска формирования внутрипредсердных тромбов и, как следствие, существенным возрастанием риска развития ишемических инсультов (примерно в 5 раз в сравнении с лицами, имеющими синусовый ритм – СР) и системных тромбоэмболий. Среди пожилых риск ТЭО (в т.ч. ишемических инсультов) увеличен при ФП не-ревматической природы примерно в 7 раз, а при ФП у лиц с ревматическими пороками – еще более значительно (в 17 раз !). Риск развития ишемического инсульта в течение 1 года среди больных ФП в возрастной категории 50-59 лет составляет около 1,5%, повышаясь у лиц в возрасте 80-90 лет до 23,5%. Течение и прогноз инсульта у больных с ФП хуже, чем у пациентов с СР.
ФП является независимым фактором риска летальных исходов у больных с артериальной гипертензией, сахарным диабетом, ишемической болезнью сердца, хронической сердечной недостаточностью (ХСН), атеросклеротическими цереброваскулярными поражениями (увеличение риска в 1,7–2,6 раза и более). ФП ассоциирована с отчетливым увеличением риска развития ХСН (примерно в 3 раза) и деменции (примерно в 2 раза).
Классификация ФП:
- Впервые выявленная: первый эпизод ФП. Может: (1) быть бессимптомной или иметь клинические проявления; (2) быть единственным эпизодом или рецидивировать; (3) устраниться самостоятельно или при применении лечебных подходов; (4) быть пароксизмальной или персистирующей.
- Пароксизмальная: характеризуется тем, что ее эпизоды устраняются самостоятельно и длятся обычно не более 48 часов. Хотя пароксизмы ФП могут длиться до 7 суток, период до 48 часов является клинически значимым, поскольку по окончании этого периода частота самостоятельного восстановления ритма значительно меньше. Может переходить в персистирующую, длительно персистирующую или перманентную.
- Персистирующая: такая форма ФП, которая продолжается более 7 дней и не прекращается самостоятельно (для восстановления СР требуется электрическая или медикаментозная кардиоверсия).
- Длительно персистирующая: такая ФП, которая продолжается ≥1 года, но восстановление и удержание СР еще возможно.
- Постоянная (перманентная): устойчивая форма ФП (попытки ее устранения неэффективны; восстановление СР не является целью лечения).
Этиология и патогенез
ФП может развиваться при целом ряде патологических состояний (табл.1); в некоторых случаях развитие ФП возможно и без каких-либо выявляемых заболеваний / патологических состояний и провоцирующих факторов (идиопатическая или «lone» ФП).
Таблица 1. Причины развития ФП.
|
Кардиальные |
Не-кардиальные |
|
|
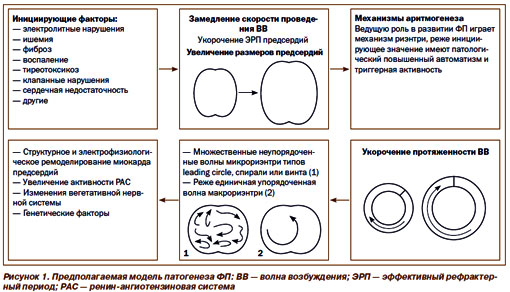
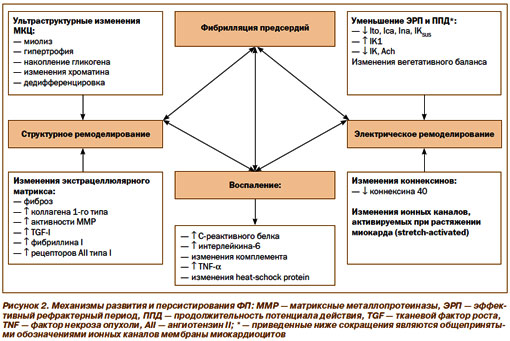
Перечисленные в таблице 1 состояния могут приводить к формированию в миокарде предсердий электрофизиологических условий для начала и поддержания ФП (рис.1 и 2).
Начало эпизода ФП обычно связывают с эктопическим фокусом повышенного автоматизма, который может располагаться в различных отделах предсердий (более часто – в области устьев легочных вен). Поддерживается ФП несколькими (обычно не менее 3) круговыми волнами микро-риэнтри, хаотично дрейфующими по миокарду предсердий.
У больных с дилатацией левого предсердия вероятность развития эпизода ФП / его рецидива увеличена; чем более значительна дилатация предсердия, тем такая вероятность выше.
Перспектива спонтанного восстановления (и удержания) СР снижается с увеличением времени от начала эпизода ФП вследствие процесса электрического ремоделирования миокарда предсердий. Вследствие структурного и электрического ремоделирования предсердий ФП «поддерживает сама себя».
Не обсуждая вопросы патогенеза ФП детально (что, естественно, невозможно в рамках подобного семинара), считаем необходимым указать лишь на некоторые ключевые моменты. Приведенные на рис. 1 инициирующие факторы способствуют формированию условий, предрасполагающих к развитию ФП (в первую очередь структурного и электрического ремоделирования миокарда предсердий с развитием негомогенности процессов деполяризации и проведения в предсердиях). Важная роль в патофизиологии ФП отводится активации нейрогуморальных систем, систем цитокинов, матриксных металлопротеиназ. Определенное место также занимают генетические факторы.
Клиническая картина. Диагностика.
Некоторые больные могут не иметь клинических проявлений.
Частые симптомы: ощущение сердцебиений, одышка, слабость. Более редко могут иметь место: боли в грудной клетке, головокружения, синкопы, гипотензия. Синкопы могут быть связаны как с тахи-, так и с брадисистолией желудочков.
Развитие эпизодов ФП может ухудшать клинические проявления сердечной недостаточности, ИБС, легочных эмболий.
Диагностика:
- Пальпация пульса. Измерение АД, аускультация сердца.
- Оценка клинических проявлений сердечной недостаточности.
- Поиск и коррекция возможных причин / провоцирующих факторов (ишемия (острый коронарный синдром), клапанные поражения, тиреотоксикоз, заболевания легких, инфекции) – таблица 2. ФП может устраняться при коррекции этих факторов.
Таблица 2. Стандартные обследования у больного с ФП.
|
Общие вопросы лечения
Ведущие лечебные подходы при ФП включают:
- профилактику ТЭО;
- контроль частоты желудочковых сокращений (в ходе ФП, без восстановления СР);
- контроль ритма (восстановление СР).
Важное значение для выбора тактики имеют следующие факторы:
- форма ФП (пароксизмальная, персистирующая, перманентная);
- наличие и степень выраженности клинических проявлений;
- особенности предрасполагающих сердечно-сосудистых и не-сердечно-сосудистых заболеваний / состояний (ИБС, включая острый коронарный синдром; ХСН; сепсис; тиреотоксикоз и др) и их прогноз;
- оценка риска ТЭО и риска кровоточивости.
1. Профилактика ТЭО
Является ключевым элементом лечебной тактики у всех больных с ФП. Риск ТЭО у пациентов с ФП значительно повышен в сравнении с лицами, имеющими СР (в группах, сравнимых по возрасту и особенностям основного сердечно-сосудистого заболевания); степень повышения эмболического риска приблизительно одинакова при различных формах ФП – пароксизмальной, персистирующей, постоянной (перманентной).
Вопрос о выборе лечебного подхода к профилактике ТЭО у лиц с ФП решается индивидуально, при этом рекомендуют использовать:
шкалу CHA2DS2VASc – для оценки риска ТЭО (таблица 3);
шкалу HAS-BLED – для оценки риска кровоточивости (табл. 4).
Сложным моментом выбора лечебной тактики является то, что ряд факторов, определяющих высокий риск ТЭО, также характеризует и высокий риск кровоточивости (к таким факторам относятся АГ, инсульт в анамнезе и возраст). Таким образом, пожилые больные, которые могут получить наибольшую пользу от антикоагулянтной терапии (т.е. лица с наиболее высоким тромбоэмболическим риском), имеют и наиболее высокий риск кровоточивости.
Наиболее часто для профилактики ТЭО при ФП используются пероральные антикоагулянты (ПОАК). Среди них достаточно большое распространение во всем мире получили антагонисты витамина К1 (АВК), а в этой группе наиболее изученным признается варфарин. Использование варфарина в сравнении с отсутствием антитромботической профилактики приводит к уменьшению риска ТЭО (в т.ч. ишемических инсультов) примерно на 60%; он также существенно эффективнее в снижении риска ишемических инсультов при ФП в сравнении с ацетилсалициловой кислотой (АСК) (у лиц среднего возраста – примерно на 30%, а у пожилых – даже до 65%).
Применение АВК (варфарина) возможно только при регулярном контроле показателя, обозначаемого как международное нормализующее отношение (МНО). Обычно в качестве целевого уровня МНО рекомендуют его значения от 2,0 до 3,0 (при этом уже отчетливо снижается риск ТЭО и еще не нарастает риск геморрагических осложнений). Не у всех больных можно достичь устойчивого удержания показателей МНО в указанных пределах (желательно сохранять их в границах 2,0-3,0 не менее 60% времени). В таблице 5 приведены некоторые особенности применения варфарина при ФП.
Таблица 3. Шкала CHA2DS2VASc для оценки риска ТЭО у больных с ФП.
|
Факторы риска |
Баллы |
Лечебная тактика |
|
ХСН / систолическая дисфункция ЛЖ |
1 |
Важно! Чем больше баллов по этой шкале – тем выше риск ТЭО (например, 1 б -1,3% за 1 год; 3 б-3,2%; 6 б – 9,8%; 9 б – 15,2%) |
|
АГ |
1 |
|
|
Возраст ≥ 75 лет |
2 |
|
|
Сахарный диабет |
1 |
|
|
Инсульт/ТИА/ТЭ в анамнезе |
2 |
|
|
Заболевания сосудов * |
1 |
|
|
Возраст 65-74 лет |
1 |
|
|
Женский пол |
1 |
|
|
Максимальное значение |
9 |
Примечания: ХСН – хроническая сердечная недостаточность; МНО – международное нормализующее отношение; ТИА – транзиторная ишемическая атака; ТЭ –тромбоэмболии; * – инфаркт миокарда в анамнезе, поражения периферических и других артерий
Таблица 4. Шкала HAS-BLED для оценки риска кровоточивости при ФП.
|
Клинические характеристики |
Баллы |
Лечебная тактика |
|
АГ |
1 |
≥3 баллов –высокий риск геморрагических осложнений –показано более тщательное наблюдение, независимо от того принимают они АСК, варфарин или новые ПОАК ≥3 баллов – ниже доза новых ПОАК (Табл.6) |
|
Нарушение функции печени и/или почек |
1 / 2 |
|
|
Инсульт / ТИА в анамнезе |
1 |
|
|
Кровотечения |
1 |
|
|
Лабильный показатель МНО |
1 |
|
|
Возраст |
1 |
|
|
Прием антитромбоцитарных препаратов, пероральных антикоагулянтов, гепаринов, нестероидных противовоспалительных препаратов и / или злоупотребление алкоголем |
1 или2 |
|
|
Максимальное значение |
9 |
Примечания: АГ – систолическое АД >160 мм рт. ст.; нарушение функции почек – диализ, трансплантация почки или сывороточный креатинин ≥200 мкмоль/л;нарушение функции печени – уровень билирубина в ≥2 раза выше верхней границы нормы в сочетании с повышением активности АСТ/АЛТ/щелочной фосфатазы в≥3 раза по сравнению с верхней границей нормы; кровотечение – кровотечение в анамнезе и/или предрасположенность к кровотечению, например, геморрагический диатез, сюда также относят анемию с уровнем гемоглобина 100 г/л и менее; лабильный показатель МНО – нестабильное/высокое МНО или недостаточный срок сохранения МНО в целевом диапазоне (например, <60% времени).
Таблица 5. Некоторые особенности применения варфарина при ФП.
|
Противопоказания к применению варфарина:
|
|
Необходима осторожность при назначении варфарина лицам, имеющим:
|
|
Дозы:
|
|
Применение у пожилых:
|
|
Антикоагуляционный эффект варфарина усиливается при:
|
Альтернативы варфарину при ФП (новые ПОАК)
и перспективы антитромботической терапии
В рандомизированных контролируемых исследованиях (РКИ) представлены доказательства того, что применение для профилактики ТЭО при ФП таких лечебных подходов, как комбинация АСК с варфарином, клопидогрель (как изолированно, так и в сочетании с АСК), дипиридамол менее эффективны, чем варфарин; кроме того, их применение ассоциировано с таким же по выраженности (или даже более высоким) риском кровоточивости.
С учетом присущих АВК (варфарину) недостатков, а именно: (1) необходимости постоянного лабораторного контроля МНО; (2) наличия многочисленных взаимодействий с лекарственными препаратами и пищевыми продуктами – см. табл.5; (3) вариабельности ответа на варфарин, в силу чего в группе так называемых «не-ответчиков» не удается удерживать устойчивый контроль МНО в целевых пределах – были разработаны новые ПОАК для профилактики ТЭО при ФП.
С этими препаратами (ингибиторами Ха-фактора коагуляции ривароксабаном и апиксабаном, а текже прямым ингибитором тромбина дабигатраном) уже завершены крупные РКИ; эти препараты рекомендованы для использования в качестве альтернативы варфарину с целью профилактики ишемических инсультов и других ТЭО у больных с неклапанной ФП.
В таблицах 6 и 7 представлены позиции экспертов Европы (2012г.) и США (2014г.) по вопросам применения ПОАК у лиц с ФП; в таблицах 8 и 9 приведены некоторые дополнительные данные по использованию двух новых ПОАК ривароксабана и дабигатрана (которые уже достаточно широко представлены в клинической практике).
В дополнение к материалу таблиц 6,7-некоторые общие положения:
- Если больной длительно принимает и успешно переносит варфарин, и при этом МНО значительную часть времени удерживается на целевых значениях, то в смене варфарина на новые ПОАК обычно нет необходимости.
- Все три новых ПОАК имеют важные преимущества в сравнении с варфарином: (1) более предсказуемый терапевтический профиль; (2) значительно меньшее количество лекарственных взаимодействий; (3) отсутствие взаимодействий с пищевыми продуктами; (4) более низкий риск интракраниальных кровотечений.
- Все три новых ПОАК показаны лицам с разными формами ФП (пароксизмальная, персистирующая, перманентная), а также больным с трепетанием предсердий
- Для новых ПОАК характерны быстрое начало и прекращение антикоагулянтного эффекта. Поэтому не требуется «мостик» из парентеральных антикоагулянтов в начале лечения этими ПОАК. Может также не требоваться «мостик» у больных, уже получающих новые ПОАК, если нужно их прервать на короткое время для проведения инвазивных вмешательств.
- Однако, с учетом быстрого начала и быстрого прекращения действия, при использовании новых ПОАК критически важной является высокая приверженность больного к лечению. Пропуск даже одной дозы может обусловить появление периода, когда протекция в отношении ТЭО сильно ослабевает, что может увеличить риск развития ишемического инсульта. Следует объяснить больному, что: (1) необходимо иметь запас препарата; (2) нужно всячески избегать пропусков его приема; (3) при случайном пропуске – принять препарат столь быстро, сколь возможно; (4) не следует принимать удвоенную дозу препарата при случайном пропуске предыдущего его приема.
- Применение новых ПОАК не требует контроля МНО или иных параметров гипокоагуляции.
- Использование новых ПОАК изучено, главным образом, у лиц с ФП без значимых клапанных пороков. Лица с механическими протезами клапанов, а также с гемодинамически значимым митральным стенозом не включались в основные РКИ с новыми ПОАК (RE-LY, ROCKET AF, ARISTOTLE), вследствие чего эти больные в качестве ПОАК должны получать только АВК (обычно варфарин). Лица с аортальным стенозом или с аортальной или митральной недостаточностью, которые не требовали хирургического вмешательства, могли включаться в эти РКИ (например, в ROCKET AF вошли 1992 таких больных; результат – в «группе ривароксабана» протекция в отношении ТЭО была такой же, как и среди лиц без клапанных поражений, но несколько выше был риск кровоточивости).
- Пациенты с биопротезами клапанов также не включались в эти крупнейшие РКИ, из-за чего говорить о возможности применения новых ПОАК у них также преждевременно.
- Относительно антикоагуляции у лиц с протезами клапанов (Рекомендации по клапанным поражениям, США, 2014):
- АВК (обычно варфарин) с целевым МНО ≈ 2,5 (2,0-3,0) – для лиц с механическим протезом аортального клапана (двустворчатым или современным однодисковым) при отсутствии дополнительных факторов риска ТЭО (ФП, ТЭО ранее, систолическая дисфункция левого желудочка, состояния с гиперкоагуляцией) – I/B
- АВК с целевым МНО ≈ 3,0 (2,5-3,5) – для лиц с механическим протезом аортального клапана старых моделей (например, шаровым), а также у лиц с протезом новой модели при наличии указанных выше дополнительных факторов риска ТЭО – I/B
- АВК с целевым МНО ≈ 3,0 (2,5-3,5) – для лиц с механическим протезом митрального клапана – I/B
- Ацетилсалициловая кислота (АСК) 75-100 мг/сут – в дополнение к АВК – у всех больных с механическими протезами – I/А
- АСК 75-100 мг/сут – у всех больных с биопротезами митрального или аортального клапанов – I/B
- АВК с целевым МНО ≈ 2,5 (2,0-3,0) – в течение первых 3 месяцев после установления биопротеза митрального (IIa/C) и аортального (IIb/B) клапана; при наличии дополнительных факторов риска ТЭО (ФП, ТЭО ранее, систолическая дисфункция левого желудочка, состояния с гиперкоагуляцией) – пожизненно
- В РКИ с новыми ПОАК также не входили следующие категории пациентов: недавно перенесшие (в сроки до 7-14 дней) ишемические инсульты, со значимыми поражениями печени, беременные и кормящие, со множественными сопутствующими заболеваниями.
- В случае развития кровоточивости на новых ПОАК или при их передозировке: (1) прекратить прием препарата; (2) антидоты пока не разработаны; (3) для уменьшения абсорбции может быть применен активированный уголь; (4) гемодиализ может быть эффективен при приеме дабигатрана, но не ривароксабана или апиксабана; (5) при жизне-угрожающем кровотечении – концентрат протромбинового комплекса или концентрат активированного протромбинового комплекса и рекомбинантный активированный фактор VII.
- Лекарственные взаимодействия: (1) все новые ПОАК не следует сочетать с рифампицином; (2) концентрации всех новых ПОАК могут увеличиваться при сочетанном применении с кетоконазолом, верапамилом, амиодароном, хинидином, кларитромицином; (3) ингибиторы протонной помпы могут снижать всасывание дабигатрана; (4) не следует сочетать ривароксабан и апиксабан с противогрибковыми азолами (орнидазол), с ритонавиром и кларитромицином.
В перспективе ожидается появление все более новых ПОАК для профилактики ТЭО при ФП (ингибитора Ха-факторов коагуляции эдоксабана; прямого ингибитора тромбина ксимелагатрана и др).
Возможной альтернативой постоянному приему антикоагулянтов для профилактики ТЭО при ФП в будущем может стать чрескожная катетерная окклюзия ушка левого предсердия (где наиболее часто формируются тромбы при ФП) специально разработанными для этого окклюдерами. В нескольких небольших РКИ этот метод демонстрировал многообещающие результаты, но требуется его дальнейшее изучение.
Таблица 6. Новые ПОАК при неклапанной ФП, Европа (ESC, 2012).
|
|
Подсчет СКФ:
вручную, однако доступна онлайн: (http://www.kidney.org/professionals/kdoqi/gfr_calculator.cfm); ее возможно перенести в электронные устройства индивидуального пользования (например, в мобильный телефон врача), что делает ее удобной для подсчета СКФ |
Примечания: ПОАК – пероральные антикоагулянты; АВК – антагонисты витамина К (обычно варфарин); МНО – международное нормализующее отношение; СКФ– скорость клубочковой фильтрации
Таблица 7. Профилактика ТЭО при ФП, США (ACC/AHA/HRS, 2014).
|
|
Дозы ПОАК в зависимости от СКФ (США, 2014):
|
Примечания: ИИ – ишемический инсульт; ТИА – транзиторная ишемическая атака; НМГ – низкомолекулярный гепарин; НФГ – нефракционированный гепарин; АСК – ацетилсалициловая кислота; * 75 мг – доза есть в США
Таблица 8. Некоторые аспекты применения ривароксабана.
|
|
При необходимости – порядок смены препаратов:
|
|
Иные области применения:
|
Таблица 9. Некоторые аспекты применения дабигатрана.
|
|
При необходимости – порядок смены препаратов:
|
|
Иные области применения:
|
Дискуссия «Что лучше: контроль ритма
или контроль частоты?» и выбор лечебной тактики
В течение длительного времени считалось очевидным, что восстановление и поддержание СР является наиболее рациональным подходом при ФП. Сравнению эффективности и безопасности подходов с «контролем ритма» и «контролем частоты» были посвящены 5 серьезных РКИ (наиболее крупное из них – AFFIRM). Большинство вошедших в эти РКИ больных были лицами пожилого возраста. Ни в одном из исследований не было показано, что какой-либо из этих двух подходов обладает явными преимуществами в сравнении с другим.
Не вдаваясь в детальное обсуждение причин такого результата, отметим, что для большинства пожилых больных с ФП лечебной стратегией выбора является контроль частоты желудочковых сокращений (табл. 10)
Стратегия контроля ритма (т.е. восстановления СР) может быть избрана у больных, которые плохо переносят ФП, если шансы на восстановление и удержание СР достаточно высоки (а именно, если длительность эпизода ФП относительно невелика, нет выраженных структурных изменений сердца), а также у лиц, имеющих впервые возникшую ФП. Более часто стратегию контроля ритма избирают у лиц с ФП молодого и среднего возраста.
Таблица 10. Факторы, обосновывающие преимущественный выбор подхода с контролем частоты желудочковых сокращений у пожилых лиц.
|
2. Контроль частоты желудочковых сокращений
Контроль ЧСС занимает важное место в ведении больных с постоянной, персистирующей или пароксизмальной формой ФП. Выбор лекарственных препаратов, подбор дозировок, возможность и необходимость их комбинированного применения для адекватного контроля ЧСС представляют достаточно сложную проблему. Для хронического контроля ЧСС наиболее часто используют β-адреноблокаторы (β-АБ), возможно также применение недигидропиридиновых блокаторов кальциевых каналов (верапамила, дилтиазема), сердечных гликозидов (дигоксина) и амиодарона как самостоятельно, так и в комбинациях (Табл.11, 12 и 14, Рис. 2).
Таблица 11. Препараты, используемые для контроля ЧСС при ФП
|
Препарат |
Внутривенное введение |
Обычно используемая поддерживающая доза для перорального приема |
|
β-адреноблокаторы |
||
|
Метопролола тартрат |
2,5-5,0 мг в/в болюс в течение 2 минут; максимально до 3-х доз |
25-100 мг 2 раза в сутки |
|
Метопролола сукцинат |
Не используется |
50-400 мг 1 раз в сутки |
|
Атенолол |
Не используется |
25-100 мг 1 раз в сутки |
|
Эсмолол |
500 мг/кг в/в болюс в течение 1 мин, затем 50-300 мкг/кг/мин в/в |
Не используется |
|
Пропранолол |
1 мг в/в болюс в течение 1 мин, до 3-х доз с интервалом в 2 мин |
10-40 мг 2-3 раза в сутки |
|
Надолол |
Не используется |
10-240 мг 1 раз в сутки |
|
Карведилол |
Не используется |
3,125-25 мг 1 раз в сутки |
|
Бисопролол |
Не используется |
2,5-10 мг 1 раз в сутки |
|
Недигидропиридиновые блокаторы кальциевых каналов |
||
|
Верапамил |
(0,075-0,15 мг/кг) в/в болюс в течение 2 мин, можно еще 10 мг через 30 мин, если нет эффекта, затем 0,005 мг/кг/мин в виде инфузии |
180-480 мг 1 раз в сутки |
|
Дилтиазем |
0,25 мг/кг в/в болюс в течение 2 мин, затем 5-15 мг/час |
120-360 мг 1 раз в сутки |
|
Сердечные гликозиды |
||
|
Дигоксин |
0,25 мг в/в с возможным повторным введением до максимальной дозы 1,5 мг в течение 24 ч |
0,125-0,25 мг 1 раз в сутки |
|
Другие |
||
|
Амиодарон |
300 мг в/в в течение 1 часа, затем 10-50 мг/сут в течение 24 часов |
100-200 мг 1 раз в сутки |
Примечание: Не рекомендуется использование комбинации β-АБ с верапамилом или с дилтиаземом. Для достижения контроля ЧСС при ФП могут применяться комбинации β-АБ с дигоксином или с амиодароном. Комбинацию сразу трех ЧСС-снижающих препаратов (β-АБ дигоксин амиодарон) рекомендуют не использовать (либо же – применять с очень высокой осторожностью, при регулярном контроле ЭКГ !) ввиду высокого риска развития выраженной брадикардии и нарушений проводимости.
Таблица 12. Возможности применения при ФП β-АБ, блокаторов кальциевых каналов и дигоксина.
|
β-адреноблокаторы:
|
|
ЧСС-снижающие блокаторы кальциевых каналов (верапамил, дилтиазем):
|
|
Дигоксин:
|
В начале лечения рекомендуется руководствоваться протоколом мягкого контроля ЧСС, направленного на обеспечение поддержания значений этого показателя на уровне < 110 уд/мин в состоянии покоя. Протокол жесткого контроля ЧСС, предусматривающий поддержание ЧСС на уровне < 80 уд/мин в покое и < 110 уд/мин при умеренной физической нагрузке, следует использовать при персистировании симптомов или развитии тахиаритмической дилатационной кардиомиопатии, несмотря на использование протокола с мягким контролем ЧСС. После достижения целевого уровня ЧСС путем жесткого контроля рекомендовано проведение 24-часового холтеровского мониторинга ЭКГ для оценки безопасности лечения.
При невозможности адекватного контроля ЧСС с помощью медикаментов показана абляция AV-узла с последующей имплантацией искусственного водителя ритма или радиочастотная модификация AV-узла (см.ниже).
3. Стратегия контроля ритма (восстановление СР)
Кардиоверсия (восстановление СР) может быть выполнена с помощью различных лекарственных препаратов (фармакологическая кардиоверсия) или электрического разряда (электрическая кардиоверсия).
Профилактика ТЭО при восстановлении СР
Риск развития ТЭО (в т.ч. ишемических инсультов) сравним при фармакологической и электрической кардиоверсии; рекомендации по профилактике этих осложнений идентичны.
Оценка длительности эпизода ФП имеет стратегическое значение для ведения пациента. При длительности эпизода менее 48 часов для профилактики ТЭО возможно использование нефракционированного гепарина (внутривенное капельное введение в дозе, обеспечивающей увеличение активированного частичного тромбопластинового времени (АЧТВ) в 2,5 раза) или низкомолекулярного гепарина (НМГ) (1 мг на 1 кг массы тела подкожно 2 раза в день) перед восстановлением ритма путем медикаментозной или электрической кардиоверсии. При длительности эпизода более 48 часов и стабильной гемодинамике в случае выявления тромбов в левом предсердии при трансэзофагеальном эхокардиографическом исследовании необходимо в течение 3–4 недель до медикаментозной или электрической кардиоверсии применять варфарин в дозе, которая поддерживает МНО в пределах от 2,0 до 3,0. При разрешении тромба показано проведение кардиоверсии. При персистенции тромба антикоагулянтная терапия продолжается с последующим трансэзофагеальным эхокардиографическим контролем. После успешно проведенной кардиоверсии необходимо применение варфарина в течение еще как минимум 4 недель или более в зависимости от степени риска развития ТЭО.
При нестабильности гемодинамических параметров (стенокардия, инфаркт миокарда, неконтролируемая гипотензия или отек легких), независимо от длительности пароксизма ФП, следует неотложно провести электрическую кардиоверсию с предварительным введением нефракционированного или низкомолекулярного гепарина. После кардиоверсии необходимо применение варфарина в течение 4 недель или более. НМГ отменяется по достижении МНО под влиянием варфарина от 2,0 до 3,0.
Контроль ЧСС при восстановлении СР
Высокая частота желудочкового ритма и его нерегулярность могут вызывать тяжелые гемодинамические нарушения у пациентов с ФП. Пациенты с большой частотой желудочкового ответа требуют неотложного контроля (урежения) частоты желудочкового ритма. Целевой частотой желудочковых сокращений при пароксизмальной форме ФП является 80–100 в мин в покое. У гемодинамически стабильных пациентов этот контроль может быть достигнут пероральнымприемом β-АБ или недигидропиридиновых блокаторов кальциевых каналов (верапамил, дилтиазем). В неотложных ситуациях у пациентов с гемодинамическими нарушениями возможно использование для этих целей в/в метопролола или в/в верапамила. В случаях с тяжелым нарушением систолической функции левого желудочка возможно использование в/в капельного (или струйного) введения амиодарона в дозе 150–300 мг. Применение β-АБ, верапамила и дилтиазема противопоказано у лиц с наличием дополнительных путей проведения между предсердиями и желудочками (например, при синдромах предвозбуждения – WPW и др.)
При наличии ФП с частотой сердечных сокращений менее 50 в 1 мин может требоваться в/в введение 0,5–2 мг атропина, а при развитии таких клинических проявлений, как гипотензия, ангинальные боли, пресинкопальные и синкопальные состояния, рекомендуется проведение неотложной электрической кардиоверсии или имплантации временного водителя ритма с эндокардиальной стимуляцией правого желудочка.
Выбор фармакологической
или электрической кардиоверсии
Электрическая кардиоверсия обеспечивает более высокую частоту восстановления СР, но требует проведения наркоза.
Наиболее эффективным из лекарственных препаратов для фармакологической кардиоверсии ФП является амиодарон. При его применении возможно развитие разнообразных побочных эффектов (см Табл.14).
Другие фармакологические препараты для кардиоверсии, такие как новокаинамид или пропафенон, противопоказаны у больных, имеющих структурные поражения сердца.
В ряде исследований показано, что применение ингибиторов АПФ / сартанов, статинов (возможно также – и препаратов ω3-полиненасыщенных жирных кислот) может снизить риск развития ФП и уменьшить риск ее рецидивов. Вместе с тем, имеющиеся сейчас данные не позволяют рассматривать эти группы препаратов в качестве самостоятельного подхода, изолированно пригодного для сохранения СР.
Электрическая кардиоверсия
Этим термином обозначают нанесение электрического разряда для восстановления СР. Разряд при электрической кардиоверсии обычно синхронизируют с электрической активностью сердца с тем, чтобы момент его нанесения не совпал с так называемым «уязвимым периодом» сердечного цикла (сегмент ST и зубец Т).
Электрическая кардиоверсия может выполняться как экстренное вмешательство, если эпизод ФП приводит к развитию гемодинамических нарушений. Более часто проводится плановая электрическая кардиоверсия (обычно – с использованием непродолжительного общего наркоза) у лиц с ФП, имеющих для этого показания.
Для уменьшения степени повреждения миокарда в ходе процедуры, а также для уменьшения количества наносимых разрядов рекомендуется использованиедвухфазных разрядов, начиная со 100 J (максимально до 200 J).
Обычно кардиоверсия выполняется с использованием внешних электродов, накладываемых на поверхность грудной клетки. В некоторых случаях (особенно у лиц с ожирением и с хроническим обструктивным заболеванием легких) более высокий эффект достигается при кардиоверсии с применением интракардиальных электродов.
Для увеличения вероятности восстановления СР (особенно если ранее кардиоверсия оказывалась безуспешной) перед процедурой выполняетсявнутривенная инфузия амиодарона.
После успешного восстановления СР лечение амиодароном внутрь продолжают не менее 3-6 месяцев, а при высоком риске рецидивов (например, у лиц с рецидивами ранее, длительностью ФП >12 месяцев, размером левого предсердия >5 см, поражением митрального клапана, наличием иных структурных поражений сердца) – более длительно. У каждого больного, длительно получающего лечение амиодароном, необходимо соотносить степень его благоприятного действия по поддержанию СР с потенциальным риском развития побочных эффектов.
Основной побочный эффект электрической кардиоверсии – ТЭО. Обычно всем больным требуется проведение профилактики ТЭО варфарином с поддержанием уровня МНО в пределах 2,0-3,0 в течение 4 недель до кардиоверсии. В острой ситуации рекомендуется антикоагулянтная терапия гепарином (или низкомолекулярным гепарином, например эноксапарином). Антикоагулянтная терапия (обычно варфарином) должна также продолжаться не менее 4 недель после процедуры кардиоверсии. Если больной имеет ≥2 баллов по шкале CHA2DS2VASc (табл. 3), то профилактика ТЭО антикоагулянтами (варфарин, новые ПОАК) проводится на постоянной основе.
Фармакологическая кардиоверсия
Значительное количество эпизодов ФП завершаются спонтанно в первые часы после начала. При наличии показаний (у пациентов, сохраняющих симптоматику несмотря на адекватный контроль ЧСС, или у пациентов, которым показана терапия с контролем ритма сердца) и стабильной гемодинамике может быть выполнена фармакологическая кардиоверсия ФП путем в/в введения противоаритмических препаратов (проводится в условиях кардиологического или терапевтического стационара, обязательно наличие возможностей оказания ургентной лечебной помощи при развитии потенциальных осложнений, включая временную кардиостимуляцию и выполнение экстренной кардиоверсии / дефибрилляции). Большинство пациентов, которым проводится кардиоверсия, нуждаются в постоянном мониторировании ЭКГ и АД при проведении в/в инфузии фармакологического препарата и на протяжении определенного периода после окончания его введения (обычно этот период равен времени полувыведения противоаритмического средства).
Для проведения фармакологической кардиоверсии возможно использование амиодарона (Табл.14) или пропафенона (Табл.17). Новокаинамид, по мнению ряда экспертов, не считается сейчас лекарственным средством, приемлемым для широкого использования при фармакологической кардиоверсии ФП (ввиду высокого риска развития осложнений).
Поддержание СР после его восстановления
Важным вариантом лечебной стратегии у больных с пароксизмальной и персистирующей формой ФП является контроль ритма (поддержание СР). Стремление к сохранению СР после успешной кардиоверсии или самостоятельной нормализации ритма у больных с ФП мотивируется целым рядом факторов:
- после восстановления СР наблюдается отчетливое улучшение гемодинамики в покое и при физических нагрузках, а также увеличение толерантности к физической нагрузке;
- при сохранении СР нет необходимости в проведении повторных кардиоверсий и, следовательно, исключается возможность осложнений этих процедур;
- рецидивы ФП ведут к дилатации камер сердца или к ее прогрессированию, способствуют развитию или усугублению ХСН;
- пароксизмы ФП существенно ухудшают качество жизни пациентов.
Проблема сохранения СР после его восстановления является достаточно сложной. Если выявлены провоцирующие факторы, то они должны быть по возможности устранены. При редких (1–2 эпизода в несколько лет), хорошо переносимых пациентом пароксизмах ФП, заканчивающихся самостоятельно или устраняющихся путем кардиоверсии, обычно отсутствует необходимость в проведении противоаритмической терапии. Если пароксизмы развиваютсячаще, имеют значимую клиническую симптоматику и устраняются только посредством кардиоверсии, то для их предупреждения показано применение противоаритмических препаратов (ПАП). При персистирующей ФП обычно показано проведение профилактической терапии ПАП.
Для профилактики рецидивов ФП после восстановления синусового ритма могут использоваться различные группы ПАП.
Противоаритмические препараты,
применяемые при ФП
Для практических врачей в рамках настоящего семинара мы сочли полезным представить классификацию ПАП (Табл.13), а также краткую характеристику и побочные эффекты (ПЭ) некоторых ПАП, применяемых в лечении ФП (Табл. 14 – 19, при их подготовке авторы базировались на материале недавних крупных международных руководств). Для получения более детальной информации по каждому из них читателю необходимо обратиться к соответствующим официальным инструкциям.
Таблица 13. Классификация ПАП (Vaughan Williams)
|
Класс |
Электрофизиологические эффекты |
Влияние на реполяризацию |
Препараты |
|
Ia |
Блокирование натриевых каналов |
Пролонгирует |
Хинидин Дизопирамид Новокаинамид * |
|
Ib |
Блокирование натриевых каналов |
Укорачивает |
Лидокаин Мексилетин |
|
Ic |
Блокирование натриевых каналов |
Не изменяет |
Пропафенон * Этацизин * |
|
II |
β-АБ |
Не изменяет |
Метопролол Эсмолол |
|
III |
Блокирование калиевых каналов |
Значительно пролонгирует |
Амиодарон * Дронедарон* Соталол * |
|
IV |
Блокирование кальциевых каналов AV-узла |
Не изменяет |
Верапамил Дилтиазем |
|
IV-по-добный |
Открытие аденозин-чувстви-тельных калиевых каналов |
Не изменяет |
Аденозин-трифосфат (АТФ) |
Примечание: * – более детальная характеристика этих ПАП – Табл.14-19
Таблица 14. Возможности применения и ПЭ амиодарона (часть 1)
|
Общие вопросы:
|
|
Кардиальные ПЭ:
|
|
Пульмональные ПЭ:
|
Примечание: ТСГ – тиреоид-стимулирующий гормон
Таблица 14. Возможности применения и ПЭ амиодарона (часть 2)
|
Тиреоидные ПЭ:
|
|
Прочие не-кардиальные ПЭ:
|
|
Взаимодействия:
|
|
ПЭ после отмены; дозовая зависимость ПЭ:
|
Примечание: ТСГ – тиреоид-стимулирующий гормон
Таблица 15. Возможности применения и ПЭ соталола
|
Общие вопросы:
|
|
Подбор дозы соталола (всегда желательна наименьшая!):
Для удержания СР у больных с пароксизмальной /персистирующей ФП:
Для контроля жизнеугрожающих желудочковых нарушений ритма:
|
|
Безопасность:
|
Примечания: СКФ – скорость клубочковой фильтрации (по Кокрофт-Гоулт); ЖТ – желудочковая тахикардия
Таблица 16. Применение и ПЭ новокаинамида (прокаинамида)
|
Общие вопросы:
|
|
Подбор дозы новокаинамида (всегда желательна наименьшая!):
Дозы для контроля жизнеугрожающих желудочковых аритмий:
Дозы для лечения ФП и других суправентрикулярных аритмий:
Дозы следует снижать у пожилых и при сниженной функции почек |
|
Безопасность:
|
Таблица 17. Возможности применения и ПЭ пропафенона
|
Общие вопросы:
|
|
Подбор дозы пропафенона (всегда желательна наименьшая!):
|
|
Безопасность:
|
Примечание: ЖТ – желудочковая тахикардия
Таблица 18. Возможности применения и ПЭ этацизина
|
Общие вопросы:
|
|
Подбор дозы этацизина (всегда желательна наименьшая!):
Дозы следует снижать при сниженной функции почек и печени |
|
Безопасность:
|
Таблица 19. Возможности применения дронедарона
|
Радиочастотная аблация миокарда предсердий при ФП
Подразумевает под собой направленную деструкцию участка миокарда предсердий с использованием радиочастотной энергии с целью предупреждения ФП. Участок (участки) миокарда, которые будут являться целевыми, идентифицируются при инвазивном электрофизиологическом исследовании (с интракардиальным расположением электродов).
Улучшение понимания механизмов развития ФП явилось основой создания новых методов радиочастотной аблации, при которых деструкции подвергаются небольшого размера участки, где располагается как эктопический фокус, провоцирующий развитие пароксизма ФП, так и петля (петли) микро-риэнтри, его поддерживающие.
Начальные результаты являются обнадеживающими, однако пока недостаточно данных о том, насколько СР сохраняется при отдаленном наблюдении. Радиочастотная аблация миокарда предсердий не является методом выбора при ФП в целом, а резервируется преимущественно для больных с пароксизмальной (в меньшей степени – с персистирующей или постоянной) ФП при неэффективности противоаритмических препаратов или их непереносимости
Аблация АВ узла и постоянная кардиостимуляция
Крупные РКИ с использованием этого метода лечения ФП не проводились; в мета-анализе показана тенденция к уменьшению клинических проявлений, улучшению переносимости физических нагрузок, повышению систолической функции ЛЖ, уменьшению госпитализаций. В настоящее время этот метод может быть использован только у больных, имеющих резистентную к иному лечению и плохо переносимую ФП.
Хирургические вмешательства
(операция «лабиринт» – Maze)
При таком вмешательстве в определенных отделах предсердий создаются разрезы для образования барьеров проведения, препятствующих дрейфу микроволн риэнтри по миокарду и, т.о., предупреждающих развитие ФП. Сейчас альтернативой этому подходу является радиочастотная аблация.
Брадикардия и фибрилляция предсердий
Брадисистолия желудочков у больного с ФП может быть как следствием сопутствующей дисфункции синусового узла, так и результатом применения ЧСС-снижающих лекарственных препаратов.
Больные с дисфункцией синусового узла (в т.ч. с синдромом слабости синусового узла – синдромом тахи-бради) более склонны к развитию эпизодов ФП, чем лица с нормальной функцией синусового узла. Это связано с тем, что наличие синусовых пауз повышает риск возникновения предсердных экстрасистол, которые могут быть пусковым фактором в развитии эпизода ФП.
Все ЧСС-урежающие препараты, включая такие, которые применяются для поддержания СР, могут вызывать развитие брадикардии (снижая автоматизм синусового узла и / или замедляя АВ проведение и способствуя развитию АВ блокад).
При развитии брадикардии с клиническими проявлениями (пресинкопы / синкопы) и / или значимых пауз на ЭКГ, независимо от механизма их возникновения, обычно требуется имплантация постоянного кардиостимулятора.
Список литературы:
- 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines [Электронный ресурс] / P.T. O’Gara, F. G. Kushner, D.D Ascheim // Circulation.– 2013. – 89 р. – Режим доступа: http://circ.ahajournals.org/content/ 127/4/e362.full.pdf html.
- Bonow R.O., Mann D.L., Zipes D.P., Libby P./ Braunwald’s Heart Disease, 9th Ed.-Elsevier.-2012.-1961p.
- Camm AJ, Lip GY, De CR, et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: An update of the 2010 ESC Guidelines for the management of atrial fibrillation * Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J. 2012.
- Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M./William’s Textbook of Endocrinology, 12th Ed.-Elsevier.-2011.-1829p.
- Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP III, Guyton RA, O’Gara PT, Ruiz CE, Skubas NJ, Sorajja P, Sundt TM III, Thomas JD. 2014 AHA/ ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;63:e57–185
- Opie L.H. Drugs for the heart / L. Opie, B.J. Gersh. – Elsevier, 2013. – 592 p
- January C, Wann L, et al. 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. Circulation. 2014. – 129







