Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Фоновые процессы и предрак шейки и тела матки"
Автор:
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Акушерство и гинекология, Семейная медицина/Терапия
Просмотров: 16 381
Дата проведения: с 17.09.2014 по 17.09.2015
ВВЕДЕНИЕ
Среди патологических состояний женских половых органов наиболее частыми являются заболевания шейки матки. Частота фоновых и предраковых процессов шейки матки весьма высока и не имеет тенденции к снижению, заболевания затрагивают большой контингент молодых женщин и отражаются на их репродуктивном здоровье. Рак шейки матки занимает 3-е место по частоте среди злокачественных новообразований половых органов. Средний возраст больных раком шейки матки составляет 52,2 года, один пик заболеваемости приходится на 35—39 лет, а другой – на 60-64 года.
В последние годы увеличилось число женщин с этой патологией вследствие миграции, урбанизации населения, изменений полового поведения молодежи, роста проституции. На фоне общей стабилизации заболевания раком шейки матки возросла частота его у молодых женщин. Как правило, это связано с несовершенством диагностики и неадекватным лечением фоновых и предраковых процессов.
Под термином «фоновые процессы» объединяют различные по этиологии и морфологической картине заболевания, на фоне которых могут развиться предрак и рак. Для фоновых процессов шейки матки характерна гиперплазия эпителиальных клеток. Эта патология имеет склонность к затяжному течению, нередко рецидивирует и в ряде случаев ведет к возникновению рака шейки матки. Больные, имеющие данную патологию, составляют одну из основных групп диспансерного наблюдения в женской консультации.
С целью повышения эффективности лечения фоновых и предраковых заболеваний шейки матки во многих женских консультациях создают кабинеты и специализированные приемы по патологии шейки матки. Опыт показывает, что в ряде случаев участковые врачи-гинекологи, врачи специализированных приемов не всегда проводят необходимый объем обследования у больных с фоновыми и предраковыми заболеваниями шейки матки и, нередко подходят стандартно, недифферецированно к выбору метода лечения, при этом в ряде случаев не учитывается этиопатогенетическая форма патологии шейки матки и фон, на котором она возникает. Все это снижает эффективность проводимого лечения и повышает риск развития ракового процесса.
АНАТОМО-ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ШЕЙКИ МАТКИ.
Образование шейки матки происходит путем слияния мюллеровых каналов на 12-16 недели эмбриогенеза. Как, известно, в шейке матки различают влагалищную часть, выдающуюся в просвет влагалища, и надвлагалищную часть, располагающуюся выше прикрепления стенок влагалища к матке, состоящую в основном из соединительной и мышечной ткани, в которой располагаются сосуды и нервы.
Влагалищная часть шейки матки, покрыта многослойным плоским эпителием, носит название эктоцервикс. Мышечная ткань в основном содержится в верхней трети шейки матки и представлена циркулярно расположенными мышечными волокнами с прослойками эластических и коллагеновых волокон, функциональную активность которых обеспечивает двойная симпатическая и парасимпатическая иннервация. Мышечная ткань обеспечивает запирательную функцию шейки матки; в течении беременности, при родах она формирует нижний отрезок родового канала.
Канал шейки матки имеет веретенообразную форму, длина его от наружного зева до перешейка не более 4 см, ширина не более 4 мм, наружный зев круглый или в виде поперечной щели. Цервикальный канал покрыт однорядным высоким цилиндрическим эпителием и называется эндоцервикс.
Шейка матки покрыта двумя видами эпителия. Влагалищная порция шейки матки покрыта многослойным плоским, а цервикальный канал выстлан однорядным цилиндрическим эпителием. Клетки эпителия отделяет от стромы базальная мембрана, содержащая ретикулиновые, аргирофильные волокна, коллаген, нейтральные мукополисахариды. Строма представлена переплетающимися пучками эластических, коллагеновых волокон, содержит кровеносные и лимфатические сосуды.
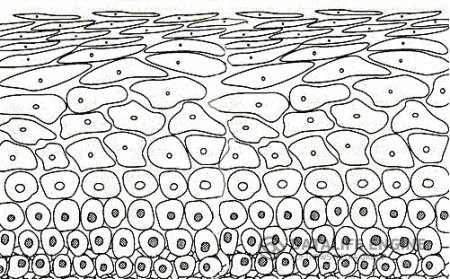
Многослойный плоский эпителий влагалищной части шейки матки представляет собой высоко дифференцированную ткань, имеющую сложное строение и определенные функциональные особенности. Эпителий, покрывающий шейку матки, состоит из 4 слоев (рис.1):
- базального, представляющего собой незрелые эпителиальные клетки, расположенные на базальной мембране в один ряд. Эти клетки имеют неровные контуры и различную величину. Базальная мембрана отделяет плоский многослойный эпителий от подлежащей соединительной ткани.
- над базальным клетками располагаются слой парабазальных клеток, расположенных несколькими рядами. Клетки базального и парабазального слоев обладают митотической активностью.
- Слой промежуточных клеток состоит из 6-7 рядов умеренно дифференцированных клеток;
- Поверхностный слой представлен 2-3 рядами клеток, которые проявляют тенденцию к ороговению и легко подвергается десквамации в зависимости от фазы менструального цикла.
![]()



Основная функция многослойного плоского эпителия – защитная.
Глыбки кератина обеспечивают прочность слизистой оболочки и тем самым создают механический барьер; иммунологический барьер создается за счет молочной кислоты, которая образуется благодаря метаболизму гликогена с участием лактобацилл.
Слизистая оболочка цервикального эпителия покрыта однорядным высоким цилиндрическим эпителием с базально расположенным ядром.
Границей двух генетически различных типов эпителия является область перехода между плоским многослойным эпителием влагалищной части и высоким цилиндрическим эпителием слизистой оболочки цервикального канала (рис.2). Цилиндрический эпителий слизистой оболочки цервикального канала вблизи перехода в многослойный плоский эпи
телий дополняется слоем резервных клеток, где они располагаются в несколько слоев и формируют в ряде случаев незрелый метапластический эпителий. У самого стыка метапластический эпителий состоит из большого числа клеток и отличается тенденцией к формированию слоев. Резервные клетки расположены под цилиндрическим эпителием на базальной мембране, а также под многоряд
ным эпителием пнреходной зоны (рис.1).
Смещение переходной зоны на эктоцервикс во внутриутробном периоде считается нормальным этапом развития шейки матки и объясняется гормональным воздействием, в частности эстрогенов, продуцируемых материнским организмом, при этом так называемые «врожденные эрозии» или эктопии, возникшие в периоде внутриутробного развития, могут сохраняться до препубертатного возраста. Максимальная частота подобных эктопий наблюдается у молодых нерожавших женщин до 25 лет.
Была изучена структура заболеваемости шейки матки у молодых нерожавших женщин до 25 лет, в том числе и подростков, и выявлено, что у 85-90% пациенток в структуре изменения эпителия шейки матки преобладают эктопии, характеризующиеся следующими особенностями: наличие четких границ, окраской ярко-красного цвета, отсутствием патологической секреции и воспалительных изменений, что позволяет оценивать как физиологическую норму (Костава М.Н., 1997).
Кольпоскопическая картина эктопии характеризуется участками ярко-красного цвета, состоящими из сосочков (рис.3). Эти участки располагаются вокруг наружного зева и имеют четкие контуры. При обработке поверхности эктопии 3% уксусной кислоты сосочки становятся более отчетливыми, рельефными, благодаря сокращению сосудов и уменьшению отека эпителия (рис.4). При проведении пробы Шиллера участки эктопии окрашиваются в светло-коричневый цвет.
При цитологическом обследовании с участка эктопии, как правило, определяются клетки цилиндрического эпителия и в небольшом количестве клетки плоского эпителия.
По мере роста и развития организма женщины происходит смещение переходной зоны в область наружного зева, и эктопия исчезает.
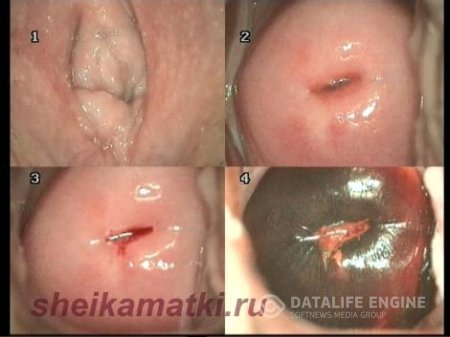
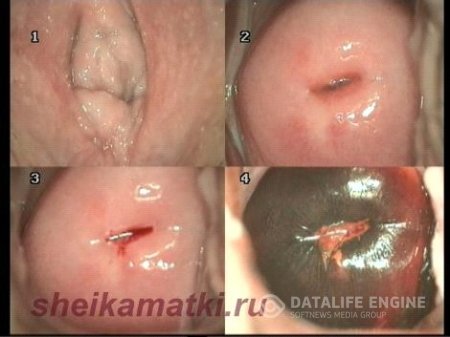
В шейке матки в течение нормального менструального цикла происходят следующие изменения. Отверстие канала шейки матки с 8-9-го дня цикла начинает расширяться и в нем появляется прозрачная стекловидная слизь. К 10-му дню цикла отверстие канала шейки матки расширяется от 0,25-0,3 см в диаметре, округляется, становится блестящим, и при освещении шейки матки в зеркалах напоминает зрачок. В последующие дни цикла количество слизи уменьшается, она исчезает, шейка становится сухой. Функциональное значение цервикальной слизи заключается в том, что она фактически является барьером между влагалищем и полостью матки, играет защитную роль в отношении проникновения бактерий в полость матки.
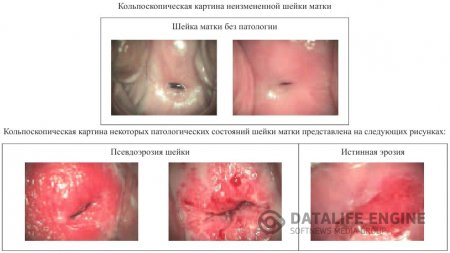
В норме при расширенной кольпоскопии выявляется неизмененная слизистая оболочка шейки матки – гладкая, блестящая, бледно-розового цвета; при обработке 3% раствором уксусной кислоты слизистая оболочка шейки матки становится несколько бледнее (рис.5 а). При нанесении раствора Люголя на поверхность влагалищной части шейки матки, она приобретает равномерное темно- коричневое окрашивание (рис.5 б).
Количество слоев промежуточных клеток и активность накопления гликогена эстрогензависимы и максимально выражены в репродуктивном возрасте, минимально — при гипоэстрогении в нейтральном периоде у девочек и в постменопаузе. В постменопаузе многослойный плоский эпителий влагалища и шейки матки в норме представлен только базальными и парабазальными клетками. Процессы слущивания наиболее интенсивны во вторую фазу менструального цикла. Многослойный плоский эпителий влагалищной порции шейки матки не ороговевает, но при пролапсе гениталий, когда слизистая оболочка подвергается высушивающему воздействию окружающей среды, поверхностные клетки могут ороговевать.
Циллиндрический эпителий цервикального канала представлен одним рядом цилиндрических, или бокаловидных, клеток с базально расположенными округлыми ядрами. Клетки цервикального канала и крипт способны вырабатывать мукополисахариды. В результате происходит формирование слизистой пробки в шеечном канале.
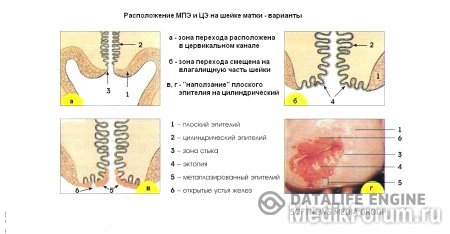
Граница эпителиев всегда привлекала внимание клиницистов, поскольку 90% патологии шейки матки возникает именно в этой зоне («зона бурь»). В различные возрастные периоды граница эпителиев может располагаться на разных частях шейки матки: у девочек и в пубертатном периоде (иногда у молодых женщин) – на влагалищной порции шейки матки вокруг наружного зева, в репродуктивном возрасте – в области наружного зева, в постменопаузе – на различном уровне в цервикальном канале. Это необходимо учитывать при обследовании пациенток.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ЗАБОЛЕВАНИЙ ВЛАГАЛИЩНОЙ ЧАСТИ ШЕЙКИ МАТКИ
Вопросы этиологии и патогенеза заболеваний влагалищной части шейки матки до настоящего времени недостаточно изучены. Однако доказано, что предрак, а в последующем и рак шейки матки формируются на фоне доброкачественных (неопухолевых) нарушений многослойного плоского эпителия.
Согласно современным представлениям, возникновению предопухолевых процессов и злокачественных опухолей способствует два условия: соприкосновение органа с внешней средой и/или наличие в органе циклических изменений. С этих позиций шейка матки вдвойне уязвима для предопухолевых процессов.
Слизистая оболочка выполняет функцию защиты организма от неблагоприятных факторов внешней среды, в то же время является гормонозависимым органом и непрерывно подвергается физиологическим изменениям.
Первым этапом патологического изменения плоского эпителия считается эктопия (фоновый процесс) – несвоеместное расположение клеток цилиндрического эпителия цервикального канала на влагалищной части шейки матки. Предполагается, что эктопия развивается двумя путями: 1) замещением дефекта (эрозии) плоского эпителия воспалительного или травматического происхождения однослойным цилиндрическим эпителием (второстепенный путь развития) и 2) превращением плоского эпителия в цилиндрический из резервных клеток (основной путь развития). Резервные клетки обладают бипотентным действием, т.е. могут способствовать формированию как многослойного плоского, так и цилиндрического эпителия. Процесс превращения резервных клеток в плоский эпителий именуется метаплазией (непрямая плоскоклеточная метаплазия). Плоскоклеточная метаплазия связана с пролиферацией резервных клеток, последняя является необходимым фактором для развития как нормального эпителия, так и злокачественной трансформации.
В процессе перекрытия цилиндрического эпителия плоским нередко нарушается дифференцировка пролиферирующих клеточных элементов, что приводит к формированию предрака (дисплазии).
Большинство исследователей считает, что наиболее важную роль в возникновении предопухолевых процессов и рака шейки матки играют экзогенные факторы (травма, воспаление, вызванное вирусной инфекцией: вирус герпеса 2 типа, вирус плоских кандилом, хламидиями, микоплазмами, а в ряде случаев химические и физические факторы, применяемые для предохранения от беременности и с лечебной целью).
К эндогенным факторам относят возрастные гормональные сдвиги, связанные с осуществлением специфических функций женского организма, заболевания желез внутренней секреции, а также иммунологические сдвиги.
Для обозначения предрака шейки матки долго использовали термин «дисплазия», предложенный J.W. Reagan в 1956 г. и утвержденный ВОЗ в 1973 г. В настоящее время общепринято обозначение CIN (Cervical Intraepithelial Neoplasia — цервикальная интраэпителиальная неоплазия). В последнее время для обозначения патологических процессов в многослойном плоском эпителии применяют термин SIL (Squamous Intraepithelial Lesion — сквамозные интраэпителиальные повреждения), который в 1988 г. предложили цитологии. Выделяют низкую и высокую степени повреждения.
Патологические состояния шейки матки представлены в Международной гистологической классификации ВОЗ (1975, 1995), Международной номенклатуре болезней (МНБ, 1992), Международной статистической классификации (МКБ, 1995), клинико-мор-фологической классификации Я. В. Бохмана (1976), классификации И.А. Яковлевой, Б.Г. Кукутэ (1977) и др.
Для клиницистов наиболее удобна следующая клинико-морфологическая классификация патологических изменений шейки матки:
• фоновые процессы (истинная эрозия, эктопия шейки матки, эктропион, врожденная эктопия, простая лейкоплакия, эритроплакия, эндометриоз, полипы шейки матки);
• предрак шейки матки (цервикальная интраэпителиальная неоплазия);
• рак (преинвазивный, микроинвазивный, инвазивный).
Фоновыми называются заболевания и изменения влагалищной части шейки матки, при которых сохраняется нормоплазия эпителия, т.е. происходит правильное митотическое деление эпителиальных клеток, их дифференцировка, созревание, эксфолиация.
Отмечается определенная этапность и стадийность патологических процессов шейки матки в развитии канцерогенеза. Выделяют фоновые и предраковые заболевания: рак in situ и инвазивный рак шейки матки.
Частота выявления фоновых заболеваний зависит от контингента обследуемых женщин, прежде всего от их возраста, имеющихся профессиональных вредностей, навыков личной и половой гигиены и многого другого. По данным Ч.Б.Викшрайтиса, при отсутствии профессиональных вредностей фоновые заболевания встречаются у 5,3% женщин, по данным О.Л.Смахтиной – у 8,4%. Однако большинство авторов приводят более высокие показатели – 38,5%. Это значит, что в течение жизни, в основном в молодом возрасте, эти заболевания наблюдаются более чем у одной трети женщин.
Наиболее частой патологией в группе дисгормональных процессов являются эндоцервикозы. По данным И.А.Яковлевой, с морфологической точки зрения они неоднотипны. Простая форма эндоцервикоза характеризуется наличием железистых структур без признаков их повышенного образования. Для пролиферирующих форм типично новообразование железистых структур, что свидетельствует о прогрессировании процесса. Для железистой псевдоэрозии характерно наличие в подлежащей строме железистых образований, вокруг которых нередко отмечается воспалительная инфильтрация. При папиллярной псевдоэрозии происходит разрастание стромы эпителия в виде сосочков, покрытых многорядным цилиндрическим эпителием. При эпидермизирующейся псевдоэрозии на фоне железистого эпителия участками встречается метапластический и многослойный плоский эпителий.
По данным А.Ф.Куперта, в 81,1% случаев эндоцервикоз был диагностирован у беременных женщин. У 55,1% из них эндоцервикоз выявлен вскоре после родов, у 10,8% – после медицинского аборта и у 2,9% – после самопроизвольного выкидыша в поздние сроки беременности. В 12,3% случаев эндоцервикоз развился во время беременности и сохранился после ее окончания.
Наличие цилиндрического эпителия за границей наружного зева на влагалищной порции шейки матки еще Н.Hinselmann предложил назвать эктопией. Частота встречаемости последней составляет 10-15% от всех заболеваний эктоцервикса у женщин в возрасте моложе 30 лет. Различают посттравматическую, врожденную и дисгормональную эктопию. Посттравматическая эктопия возникает после травмы в родах или во время аборта. При врожденной или «физиологической» эктопии у девочек, девушек и молодых женщин стык цилиндрического и многослойного плоского эпителия может располагаться снаружи от наружного зева в 6-8% случаев (В.П.Козаченко). Некоторые авторы считают подобные изменения шейки матки вариантом нормы, не требующим какого-либо специального лечения. У женщин более старшего возраста такое расположение цилиндрического эпителия является следствием гормональных расстройств. Область замещения одного эпителия другим получила название “зоны трансформации” или «зоны превращения». Чаще всего эта зона наблюдается в возрасте 28-40 лет и требует пристального внимания врача, так как именно в ней, как правило, происходит формирование будущего атипического процесса. Эпидермизация данной зоны протекает длительно и под влиянием неблагоприятных факторов может нарушаться. Цилиндрический эпителий, обладая высокой регенеративной способностью, проникает вглубь ткани шейки матки и образует ветвящиеся ходы, которые в процессе эпидермизации могут перекрываться многослойным плоским эпителием, в результате чего образуются ретенционные кисты.
К предраковым состояниям шейки матки в настоящее время относят дисплазию эпителия – патологические процессы, при которых отмечается гиперплазия, пролиферация, нарушение дифференцировки, созревания и отторжения эпителиальных клеток. Дисплазия шейки матки считается устаревшим названием цервикальной интраэпителиальной неоплазии (CIN). Различают три степени дисплазии: CIN I – слабая дисплазия; CIN II – умеренная дисплазия; CIN III – тяжелая дисплазия и преинвазивный рак – Са insitu (CIS).
В зарубежной литературе CIN объединены под названием плоскоклеточные интраэпителиальные поражения (SIL). Наименование SIL предложено Национальным институтом по изучению рака США (система Bethesda, 1988), пересмотренное в 1991 г. В настоящее время система Bethesda рекомендована ВОЗ, имеет широкое применение в мире не только цитологами, но и клиницистами.
КЛИНИКО-МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЙ ШЕЙКИ МАТКИ
I. Фоновые процессы:
А. Гиперпластические процессы, связанные с гормональными нарушениями:
1. Эктопия (син. эндоцервикоз, псевдоэрозия):
– простая
– пролифирирующая
– эпидермизирующая
2. Полип
3. Папиллома
4. Лейкоплакия (простая)
5. Эндометриоз
Б. Воспалительные процессы:
1. Истинная эрозия
2. Цервициты (острый, хронический)
В. Посттравматические процессы:
1. Разрывы
2. Эктропион
3. Рубцовые изменения
4. Шеечно-влагалищные свищи
II. Предраковые состояния:
А. Дисплазия (цервикальная интраэпителиальная неоплазия – CIN):
– лёгкой степени (CIN I)
– средней степени тяжести (CIN II)
– тяжёлая (CIN III, включая также и внутриэпителиальный рак)
Б. Лейкоплакия с атипией клеток
III. Рак шейки матки:
А. Преклинические формы
– внутриэпителиальный рак (cr.in situ, стадия 0)
– микрокарцинома (стадия Iа)
Б. Клинические формы (стадия Iб, II, III, IV)
Следует отметить, что термин «эндоцервикоз» в настоящее время укоренился, клиницисты в таких случаях ставят диагноз «псевдоэрозия» с последующей кольпоскопической расшифровкой (эктопия, законченная или незаконченная зона превращения).
ФАКТОРЫ РИСКА РАЗВИТИЯ ПАТОЛОГИИ ШЕЙКИ МАТКИ:
1. Травматическое повреждение шейки матки в родах или при аборте, что приводит к нарушению трофики и иннервации тканей;
2. Хронические воспалительные процессы, приводящие к дегенеративным изменениям в ткани;
3. Гормональные нарушения, приводящие к гиперэстрогении;
4. Раннее начало половой жизни;
5. Инфекционные заболевания гениталий, вызванные вирусом герпеса второго серотипа и вирусом папилломы человека;
6. Трихомонадная инфекция (трихомонады являются переносчиком вирусов);
7. Хламидиоз;
8. Наследственный фактор (частота развития предрака и рака в 1,6 раза выше, чем в общей популяции женщин).
КЛИНИКО-МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ФОНОВЫХ И
ПРЕДРАКОВЫХ ЗАБОЛЕВАНИЙ ШЕЙКИ МАТКИ:
- Эктопия (син. псевдоэрозия, эндоцервикоз) – участок влагалищной части шейки матки, покрытый однослойным цилиндрическим эпителием шеечного канала шейки матки.
- Псевдоэрозия встречается у 40% женщин, а в группе женщин до 20 лет – до 50%.
ЭКТОПИЯ ЯВЛЯЕТСЯ ФОНОВЫМ ПРОЦЕССОМ
Эктопия шейки матки подразумевает смещение цилиндрического эпителия на влагалищную порцию шейки матки. Для обозначения эктопии отечественные клиницисты долго использовали термин «псевдоэрозия». Выделяют приобретенную и врожденную эктопию (псевдоэрозию). Развивается двумя путями:
1. При наличии дефекта плоского эпителия (истинная эрозия) происходит его замещение однослойным цилиндрическим эпителием из цервикального канала шейки матки.
2. Эктопия может возникнуть также вследствие превращения плоского эпителия в цилиндрический из резервных клеток (основной путь развития эктопии).
- Резервные клетки обладают бипотентным действием, т.е. могут способствовать формированию как цилиндрического, так и многослойного плоского эпителия.
- Процесс превращения резервных клеток в плоский эпителий называется метаплазией.
- Плоскоклеточная метаплазия связана с пролиферацией резервных клеток, последняя является необходимым фактором для развития, как нормального эпителия, так и злокачественной трансформации.
- При пролиферации клеток нередко нарушается их дифференцировка, что приводит к формированию дисплазии – предрака.
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ ПСЕВДОЭРОЗИЙ:
I. По этиопатогенезу:
1. Врождённая (влияние высокого уровня гормонов материнского организма);
2. Приобретённая (в период пубертата отмечается быстрый рост мышечных структур шейки матки с отставанием пролиферативного процесса в многослойном плоском эпителии);
3. Рецидивирующая;
II. По клиническому течению:
1. Неосложнённая форма;
2. Осложнённая форма (сочетание с цервицитом, вагинитом);
III. По гистологическому строению:
1. Железистая (фолликулярная) – множество железистых ходов;
2. Папиллярная (сосочковая) – разрастание стромы;
3. Эпидермизирующая (заживающая) – участки цилиндрического эпителия замещаются многослойным плоским в результате метаплазии резервных клеток или «наползания» клеток плоского эпителия с периферии на зону эктопии.
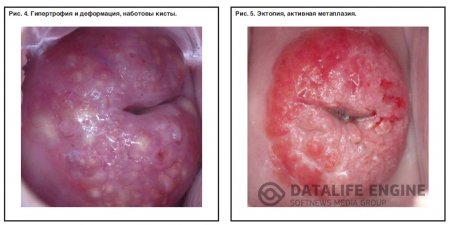
В процессе эпидермизации образуются ретенционные кисты, т.к. многослойный плоский эпителий перекрывает устья выводных протоков желез цилиндрического эпителия и в железе накапливается слизь. Размер кист может быть от 2-3 мм. до 1 см. (овуля Наботи).
Приобретенная эктопия является полиэтиологичным заболеванием, в генезе которого отводится роль воспалительному, механическому, гормональному факторам. В результате воспалительных изменений многослойный плоский эпителий с рыхло уложенными, плохо сцепленными слоями при механическом воздействии может локально повреждаться и слущиваться. В последующем из резервных клеток на дисгормональном фоне при инфекционных воздействиях может формироваться цилиндрический эпителий, замещающий многослойный плоский. У женщин с нарушением менструального цикла эктопия возникает в 5—6 раз чаще, чем в популяции.
Пациентки с эктопией, как правило, не предъявляют никаких жалоб, иногда могут беспокоить бели, контактные кровяные выделения, что обычно бывает при сопутствующем экзо- и эндоцервиците. При гинекологическом осмотре псевдоэрозия выглядит как участок неправильной формы ярко-красного цвета, часто располагающийся асимметрично на передней или задней губе шейки матки на фоне бледной слизистой эктоцервикса.
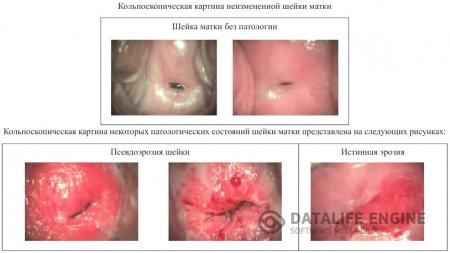
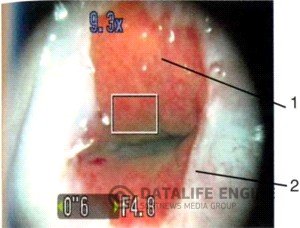
При кольпоскопии эктопия представляет собой участки, покрытые множеством округлых или продолговатых красных сосочков, что создает эффект бархатистой поверхности. Ярко-красный цвет обусловлен сосудами подлежащей стромы, просвечивающими через один ряд цилиндрических клеток (рис. 6). Иногда картину может дополнять «зона трансформации» —метаплазированный и незрелый многослойный плоский эпителий в зоне эктопии, открытые и закрытые протоки желез. «Зона трансформации» отражает процессы замещения цилиндрического эпителия эктопии многослойным плоским. Гистологически выделяют железистую, папиллярную псевдоэрозии и с плоскоклеточной метаплазией.
МАКРОСКОПИЧЕСКАЯ ХАРАКТЕРИСТИКА ПСЕВДОЭРОЗИИ:
- Расположена около наружного зева шейки матки;
- Имеет ярко-красный цвет;
- Поверхность бархатистая или зернистая;
- Форма и величина различная, что обусловлено длительностью течения и выраженностью патологического процесса.
Тактика ведения пациенток с эктопией должна быть индивидуальной, при неосложненной псевдоэрозии возможно наблюдение с регулярным кольпоскопическим и цитологическим контролем. При лечении эктопии применяют криодеструкцию, лазерокоагуляцию, радиохирургическое воздействие (сургитрон), диатермоэлектроконизацию. Ограниченно применима химическая коагуляция (солкогин).
При псевдоэрозии после биопсии – диатермокоагуляция или диатермоэксцизия шейки матки, лазертерапия. Для прижигания псевдоэрозии можно использовать влагалищный тампон, смоченный ваготилом и прикладываемый к шейке матки на 1-3 мин 2-3 раза в неделю (всего 5-10 раз); остатки препарата удаляют из влагалища сухим тампоном. Больным с выраженными анатомическими изменениями шейки матки (старые разрывы, эктропион и др.) в основном проводится хирургическое лечение (клиновидная или высокая ампутация шейки матки).
Развитие врожденной эктопии связывают с гормональными воздействиями организма матери в антенатальном периоде. У 50% новорожденных девочек имеется эктопия цилиндрического эпителия. С началом полового созревания в норме происходит миграция границы эпителиев, к его концу переходная зона располагается в области наружного зева шейки матки. При нарушении этих процессов на эктоцервиксе может оставаться цилиндрический эпителий. С точки зрения гистогенеза врожденную эктопию можно рассматривать как вариант физиологической нормы.
ИСТИННАЯ ЭРОЗИЯ
Истинная эрозия
представляет собой дефект многослойного плоского эпителия на влагалищной порции шейки матки. Считается, что истинная эрозия возникает в результате воспалительных процессов, приводящих к некробиозу многослойного плоского эпителия в кислой среде влагалища, который в результате механической травмы слущивается с подлежащей мембраны. При этом хотя бы частично сохраняется базальный слой клеток и тем самым потенция к заживлению.
Часто появляется в результате эндоцервицита¸ эндометрита. Небрежное исследование может привести к десквамации многослойного плоского эпителия и возникновению истинной эрозии шейки матки¸ течение которой относительно недлительное (до 2-3-х недель). Участок поражения может покрыться новообразованным плоским или цилиндрическим эпителием с образованием псевдоэрозий.
Эрозия, как и любой дефект шейки матки, значительно снижает ее защитные свойства, что чревато более легким проникновением в шейку матки вирусов папилломы человека, которые, с высокой степенью вероятности, вызовут серьезные изменения в эпителиальных клетках.
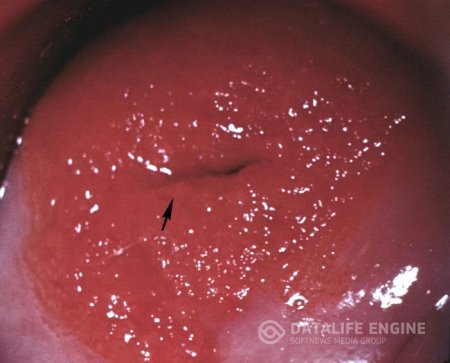
Истинная эрозия не имеет специфической клиники и очень часто пациентка не обращается к врачу. Бели или другие патологические выделения, зуд, как правило, обусловлены экзоцервицитом, кольпитом. Истинная эрозия существует от 2—3 дней до 1-2 нед и выглядит как участок эктоцервикса ярко-красного цвета, неправильной формы, не покрытый эпителием, диагностируется при кольпоскопии (рис.7). Дно ее представляет собой отекшую соединительную ткань с субэпителиальными сосудами.
Диагностика опирается на данные клинической картины, кольпоскопии, цитологического исследования. Биопсию делают редко, а если делают, то выбирают для этого наиболее измененные участки шейки матки. Дифференциальную диагностику проводят с целью отграничения истинной эрозии шейки матки от эндометриоза, туберкулеза, рака шейки матки.
Лечение должно быть направлено на устранение контаминации (антибактериальная терапия, мазевые тампоны и свечи с антибиотиками) и нормализацию микрофлоры влагалища (применение эубиотиков), стимуляцию регенерации (солкосерил, облепиховое масло). При гормональных нарушениях и отсутствии должного лечения возможна эпителизация эрозии с формированием цилиндрического эпителия (эктопия) шейки матки.
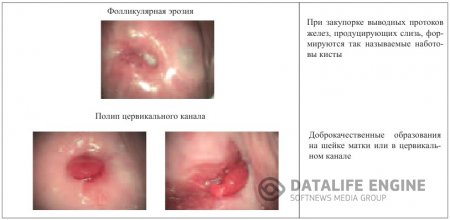
ПОЛИП ШЕЙКИ МАТКИ – это есть очаговая пролиферация соединительной ткани эндоцервикса, покрытой цилиндрическим эпителием и выступающей в просвет цервикального канала или за его пределы и представляют собой соединительнотканные выросты, покрытые эпителием. Различают железистые (покрыты однорядным цилиндрическим эпителием) и эпидермизированные (покрыты метапластическим многослойным эпителием) полипы. Полипы выглядят как ярко-розовые образования продолговатой или листовидной формы, свисающие из наружного зева шейки матки (рис. 8).
Возникновение полипов связано как с гормональными нарушениями, так и с воспалительными процессами. Полипы имеют округлую форму, реже дольчатое строение и гладкую поверхность. Цвет полипов зависит от характера покрывающего эпителия. При расположении на поверхности цилиндрического эпителия полип имеет розовый цвет вследствие просвечивания подлежащей сосудистой сети. Если полип покрыт плоским многослойным эпителием, то приобретает беловатую окраску.
Полипы возникают у 5-11% больных в возрасте, как правило, старше 40 лет. Чаще встречаются единичные, реже множественные полипы, получившие название полипоза. Их величина и форма разнообразны, поверхность гладкая, консистенция мягкая, цвет обычно темно-розовый, при нарушении кровообращения – темно-фиолетовый. Основание полипа (ножка), тонкое или широкое, располагается в средней или верхней трети цервикального канала. Полип, покрытый цилиндрическим эпителием, называется железистым, многослойным плоским эпителием – эпидермизирующимся (последний чаще подвергается малигнизации).
Необходима дифференциальная диагностика с полипами эндометрия больших размеров или с полипами, исходящими из нижней трети полости матки, поэтому полипэктомию осуществляют под контролем гистероцервикоскопии. Современная ультразвуковая аппаратура с высокой разрешающей способностью позволяет диагностировать полипы небольших размеров, не выходящие за пределы наружного зева. Они выглядят, как включения повышенной или средней эхогенности в цервикальном канале.
МАКРОСКОПИЧЕСКАЯ ХАРАКТЕРИСТИКА ПОЛИПА:
- Образование тёмно-розового или красного цвета от 2 до 40 мм;
- Форма овальная или круглая;
- Поверхность гладкая;
- Может свисать во влагалище на тонком основании (ножке).
ПО ГИСТОЛОГИЧЕСКОМУ СТРОЕНИЮ ПОЛИПЫ МОГУТ БЫТЬ:
- Железистыми;
- Фиброзными;
- Железисто-фиброзными;
- Аденоматозными (предрак).
После установления диагноза полипа слизистой оболочки цервикального канала независимо от возраста пациентки показана полипэктомия с тщательным удалением ножки полипа или ее коагуляцией под эндоскопическим контролем.
ПАПИЛЛОМА ШЕЙКИ МАТКИ
Папиллома – сравнительно редкая форма поражения шейки матки и характеризуется очаговыми разрастаниями стромы и многослойного эпителия с ороговением. В их возникновении определённую роль играют вирусные инфекции и хламидиоз.
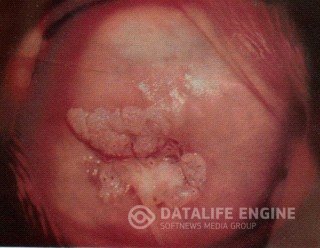
На влагалищной части ее определяются папилломатозные разрастания в виде розеток, внешне сходные с экзофитной формой рака. Папиллома имеет розовый или белый цвет, четко отграничена от окружающей ткани.
При кольпоскопическом исследовании на ее поверхности определяется большое количество древовидноветвящихся сосудов; при нанесении на поверхность папилломы раствора Люголя вокруг нее определяется йодположительная кайма.
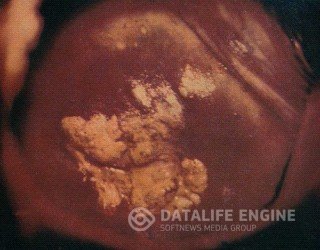
Папилломы сравнительно часто подвергаются злокачественному превращению. Морфологическое исследование позволяет установить правильный диагноз. Фоновые процессы не имеют патогномоничной цитологической картины. При истинных эрозиях в цитограммах наблюдаются элементы воспаления. При исследовании «поверхностных соскобов» или отпечатков с поверхности псевдоэрозии обнаруживаются фрагменты нормального и реактивно измененного железистого эпителия, метаплазированнные клетки многослойного плоского эпителия разной степени зрелости. У больных простой лейкоплакией (без атипии) в цитологических препаратах находят ороговевшие клетки многослойного плоского эпителия, нередко безъядерные.Макроскопически имеет вид бородавчатых разрастаний розового или белесоватого цвета.
ЛЕЙКОПЛАКИЯ
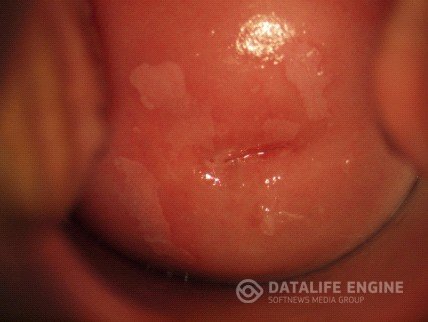
Лейкоплакия занимает особое место в структуре заболеваний шейки матки, поскольку до настоящего времени все еще остается спорным вопрос о патогенезе, доброкачественности и злокачественности ее течения.
По современным представлениям лейкоплакия шейки матки является полиэтиологичным заболеванием и в основе его лежат множество предрасполагающих факторов, таких как перенесенные инфекционные заболевания, нарушения иммунного статуса, гормонального гомеостаза, травматическое воздействие на шейку матки в результате родов, абортов, неправильное и неадекватное лечение патологии шейки матки и т.д.
В настоящее время онкологический аспект гинекологических заболеваний рассматривается в неразрывной связи с эндокринной функцией репродуктивной системы. Появились данные о роли функциональных гормональных нарушений в патогенезе заболеваний шейки матки: так работами последних лет доказано, что частота заболеваний шейки матки: больных с нарушениями менструальной функции в 5 раз выше, чем в популяции (Прилепская В.Н., Фокина Т.А., 1993).
По данным Новиковой М.Ю. (1995), частота лейкоплакии шейки матки в популяции составляет 1, 1%, а в структуре заболеваний шейки матки — 5, 2%. И хотя данная патология не является столь уж частой, злокачественная трансформация многослойного плоского эпителия, по данным некоторых исследований, наблюдается у 31, 6% больных с лейкоплакией шейки матки, в связи с чем понятно, что своевременная диагностика и лечение лейкоплакии необходимы для профилактики и снижения частоты заболеваемости раком шейки матки.
Термин «лейкоплакия» (в переводе с греческого означает «белая бляшка») был впервые предложен Швиммером в 1887 году и остается общепринятым до настоящего времени.
При изучений этиология лейкоплакии шейки матки принято выделять следующие группы факторов:
- эндогенные (нарушение гормонального гомеостаза, изменения иммунного статуса);
- экзогенные (инфекционные, химические, травматические).
В 60—70 годах нашего столетия начала развиваться теория гормонального генеза фоновых заболеваний шейки матки и лейкоплакии в частности. В результате функциональных нарушений в системе гипоталамус — гипофиз — яичники — матка нарушается процесс овуляции. Следствием ановуляции является относительная или абсолютная гиперэстрогения и дефицит прогестерона, приводящая к развитию гиперпластических процессов в органах мишенях.
Возникновению лейкоплакии шейки матки у женщин репродуктивного возраста предшествуют перенесенные воспалительные процессы матки и придатков на фоне нарушения менструальной функции у 35, 5% больных по типу олигоменореи, у 64, 5% — по типу неполноценной лютеиновой фазы цикла. По данным Новиковой М.Ю. (1996), у пациенток с лейкоплакией шейки матки нарушена функция гипофизарно-яичниковой системы. При сохраненном ритме менструаций она характеризуется повышением средних значений ФСГ, снижением отношения ЛГ/ФСГ, некоторым снижением секреции эстрадиола и прогестерона. У пациенток с олпгоменореей — повышением средних значений ЛГ, ФСГ, ПРЛ, отношения ЛГ/ФСГ, снижением уровня эстрадиола и прогестерона. Клинически нарушение секреции гормонов проявляется в развитии олигоменореи или неполноценной лютеиновой фазы цикла.
Химические и травматические воздействия имеют большое значение в возникновении лейкоплакии шейки матки. Доказано, что более 1/3 больных с лейкоплакией шейки матки ранее получали интенсивное и неадекватное медикаментозное лечение по поводу псевдоэрозии шейки матки, а 33% пациенток с клинически выраженной лейкоплакией ранее была произведена диатермокоагуляция.
В этой связи к группе риска по возникновению лейкоплакии шейки матки следует относить больных с нарушениями менструального цикла, перенесенными воспалительными заболеваниями половых органов, рецидивирующими псевдоэрозиями шейки матки в анамнезе.
КЛИНИКА И ДИАГНОСТИКА ЛЕЙКОПЛАКИИ ШЕЙКИ МАТКИ
Большое значение имеют данные клинического обследования. При анализе анамнестических данных обращают внимание на характер менструальной функции (возраст наступления менархе, длительность периода становления менструальной функции, ритм менструаций и т.д.), наличие и исход беременностей, наличие в анамнезе пссвдоэрозий шейки матки, а также характер и эффективность предшествующей терапии, длительность заболевания лейкоплакией шейки матки.
Обращает на себя внимание бессимптомность течения заболевания, а также отсутствие специфических жалоб. Лишь незначительное число женщин предъявляют жалобы на обильные бели и контактные кровянистые выделения (28, 6%), которые всегда должны настораживать клинициста в отношении малигнизации.
Комплексное обследование при лейкоплакии шейки матки включает клинические, кольпоскопические, цитологические, морфологические, а также бактериоскопические и бактериологические методы. Наиболее информативны кольпоскопические и морфологические методы.
В настоящее время одним из основных методов исследования состояния шейки матки является расширенная кольпоскопия.
Расширенная кольпоскопия позволяет уточнить размеры и характер лейкоплакии, оценить состояние покровного эпителия влагалищной части шейки матки. В зависимости от того выявляется ли лейкоплакия только при кольпоскопии или видна невооруженным глазом выделяют кольпоскопически и клинически выраженные ее формы. К кольпоскопической форме относятся «немые йоднегативные зоны», которые можно диагностировать только с помощью теста Шиллера, к клинически выраженным — «простая лейкоплакия», «основа лейкоплакии» и «поля лейкоплакии». Кольпоскопические формы лейкоплакии описаны в различных отечественных и зарубежных руководствах по кольпоскопии. Общепринятой для клиницистов являлась клинико-эндоскопически-морфологическая классификация И А. Яковлевой и Б.Г. Кукутэ (1977), в соответствии с которой простую лейкоплакию без атипии относили к фоновым процессам, а лейкоплакию с атипией — к предраковым состояниям. За рубежом простую лейкоплакию относят к гипер- и паракератозу, а лейкоплакию с клеточным атипизмом — к цервикальной внутриэпителиальной неоплазии различной степени тяжести, которая зависит от выраженности клеточного атипизма.
Простая лейкоплакия представляет собой тонкую белую пленку, которая может легко слущиваться, или плотные глыбчатые бляшки с четкими контурами. Внешние проявления простой лейкоплакии зависят от толщины кератинового слоя. После его удаления визуализируются блестящие участки розового цвета, свидетельствующие об истинных размерах поражения, проба Шиллера отрицательная, сосуды не видны, так как лейкоплакии лишены сосудов.
Основа лейкоплакии кольпоскопически выглядит как йоднегативный участок, покрытый одинаковыми по величине красными точками. Красные точки представляют собой соединительнотканные сосочки в многослойном плоском эпителии, в которых видны петли капилляров. Мозаика или поля лейкоплакии при кольпоскопии выглядят как многоугольные участки, разделенные красными нитями капилляров, что создает рисунок мозаики. При обработке уксусной кислотой картина мозаики становится более отчетливой, проба Шиллера — отрицательная.
С целью ранней диагностики рака шейки матки производят исследование мазков-отпечатков с поверхности покровного эпителия шейки матки. Материал для цитологического исследования удобно брать шпателем Эйра или специальной цервикальной щеткой. С помощью этих инструментов одновременно берутся мазки с влагалищной части шейки матки, переходной зоны и нижней трети цервикального канала. Однако из-за наличия рогового слоя на поверхности многослойного плоского эпителия в мазки не попадают клетки с дискариозом из глубоких слоев, где возможны нарушения дифференцировки, пролиферация и атипия. Дискариоз характеризуется следующими признаками – увеличением ядерно-цитоплазматического отношения, увеличением размеров и изменением формы ядер, неровностью их контуров, гиперхромазией, многоядерностью и наличием в ядрах многочисленных ядрышек.
При цитологическом методе диагностики простой лейкоплакии обращает на себя внимание наличие в мазках-отпечатках глыбок кератина, а также скоплений поверхностных клеток, лишенных ядер, цитоплазма которых окрашивается по методу Папаниколау в желтый или оранжевый цвет. В мазках встречаются также пласты полигональных ороговевающих клеток с пикнотичным ядром неправильной формы – дискератоциты.
Как известно, основным методом диагностики лейкоплакии является морфологическое исследование биоптата шейки матки. Для качественного его выполнения необходимо производить прицельную ножевую биопсию под контролем кольпоскопии из пораженных участков шейки матки.
Одновременно с биопсией производится выскабливание слизистой оболочки цервикального канала. Необходимость ревизии цервикального канала обусловлена тем, что данный процесс может развиться не только на влагалищной части шейки матки, влагалище и вульве, но и в участках плоскоклеточной метаплазии слизистой оболочки цервикального канала. Поэтому для исключения предраковых изменений и злокачественной трансформации эпителия в комплекс диагностических мероприятий необходимо включать выскабливание слизистой оболочки эндоцервикса.
Морфологическая картина лейкоплакии характеризуется следующими структурными изменениями многослойного плоского эпителия: 1) утолщение покровного эпителия в основном за счет увеличения числа клеток щиповидного слоя с сохранением их комплексности. Оно может быть обусловлено акантозом — погружением эпителиальных пластов в подэпителиальную соединительную ткань; 2) наличием рогового слоя на поверхности эпителия, который в норме отсутствует; 3) наличием зернистого слоя, который расположен под роговым и представлен 2—3 рядами клеток, цитоплазма которых заполнена умеренным количеством базофильных гранул; рассеянной или очаговой лимфоидной инфильтрацией подэпителиальной соединительной ткани.
В участках лейкоплакии гликоген всегда отсутствует. При лейкоплакии часто встречается и паракератоз — неполное ороговение многослойного плоского эпителия. В этом случае поверхностный слой многослойного плоского эпителия представлен несколькими рядами уплощенных клеток, вытянутых параллельно основанию, с мелкими пикнотическими ядрами и оксифильной цитоплазмой. Под паракератозом зернистый слой отсутствует. В участках паракератоза гликоген либо не определяется, либо видны его следы.
Для гистологической оценки лейкоплакии любой локализации очень важным является факт наличия или отсутствия клеточного атипизма в нижних слоях многослойного плоского эпителия.
Лейкоплакия без атипизма клеток является доброкачественным поражением шейки матки и относится к фоновым заболеваниям, а при наличии атипизма к предраку, и классифицируется так же как дисплазия шейки матки в зависимости от степени выраженности атипизма.
В последние годы для более детального исследования шейки матки и цервикального канала стала применяться микрокольпогистероскопия. Преимущества метода заключаются в возможности атравматичного прохождения цервикального канала под постоянным контролем зрения, без какой-либо анестезии. Микрокольпогистероскопия позволяет оценить состояние стенок цервикального канала у пациенток с лейкоплакией шейки матки, обнаружить атипичные клетки, производить прицельную биопсию.
СОВРЕМЕННЫЕ МЕТОДЫ ЛЕЧЕНИЯ ЛЕЙКОПЛАКИИ ШЕЙКИ МАТКИ
В настоящее время предложено много различных методов лечения больных лейкоплакией шейки матки. Из арсенала средств, которыми располагают практические врачи, наиболее часто применяются диатермокоагуляция, криогенное воздействие, высокоинтенсивное лазерное излучение, различные медикаментозные методы, основанные на общем или локальном воздействии лекарственных средств на патологически измененную шейку матки. До сих пор клиницисты испытывают большие трудности по ведению и лечению таких пациентов.
Следует подчеркнуть, что при сочетании лейкоплакии шейки матки с воспалительными процессами вульвы и влагалища различной этиологии сначала необходимо устранение воспалительного процесса, для чего следует назначать антибактериальные препараты различного спектра действия, противотрихомонадные, противогрибковые, противовирусные противохламидные средства по общепринятым в клинической практике схемам в соответствии с данными предварительного бактериоскопического и бактериологического исследования, а также с данными обследования на хламидии и вирусы.
Следует предостеречь врачей от применения средств, которые влияют на тканевый обмен (облепиховое масло, масло шиповника, мазь, содержащая алоэ и др.). Эти препараты могут способствовать усилению пролиферативных процессов и возникновению дисплазии шейки матки.
Химические коагулянты все еще находят применение для лечения лейкоплакии шейки матки. Из группы этих препаратов особого внимания заслуживает препарат солкогин (фирма “Солко-Базель”, Швейцария”). Солкогин является смесью органических и неорганических кислот, обладает коагулирующим действием избирательно на цилиндрический эпителий. Глубина проникновения препарата достигает 2.5 мм, что является достаточным для коагуляции патологического участка эктоцервикса. Лечение солкогином безболезненно, обеспечивает полное разрушение патологического очага за счет достаточной глубины проникновения.
М.Н. Костава (1994) использовала солкогин для лечения простой лейкоплакии шейки матки у молодых нерожавших женщин. Эффективность лечения составила 74, 3%.
В повседневной практике все еще широко применяют диатермокоагуляцию (ДК). Длительные клинические наблюдения выявили многочисленные негативные стороны этого метода. К ним относятся: имплантационный эндометриоз, кровотечение в момент отторжения струпа, обострение воспаления придатков матки, нарушение менструальной функции, болевой синдром, длительное течение репаративных процессов, частые рецидивы заболевания.
Однако при тщательном учете противопоказаний и соблюдения техники процедуры он может применяться в клинической практике.
К более эффективным методам лечения лейкоплакии шейки матки на сегодняшний день относятся криогенный метод и воздействие высокоинтенсивным лазером.
Криотерапия (КРТ) вызывает некроз патологического очага за счет влияния низкой температуры. КРТ осуществляется контактным способом, чаще всего однократно, длительность ее определяется характером и распространенностью патологического процесса и составляет от 2 до 5 минут. К достоинствам этого метода относится безболезненность процедуры, возможность применения в амбулаторных условиях. Эффективность КРТ составляет от 54 до 96% (Фокина Т.А., 1992, Рудакова Е.Б., 1996). Одним из недостатков метода является рецидивирование патологического процесса, особенно у пациенток с нарушениями менструального цикла.
Одним из наиболее современных и эффективных методов лечения лейкоплакии шейки матки является применение высокоинтенсивного лазера. Достоинством СО2-лазера является его способность бесконтактно, безболезненно, асептично, бескровно испарять, сжигать и коагулировать патологические ткани, образуя на раневой поверхности тонкую коагуляционную пленку, препятствующую проникновению инфекции в подлежащие ткани. Лазерокоагуляция, как правило, проводится амбулаторно без предварительного обезболивания в первой половине цикла (на 4—7 день). Перед лазерным воздействием шейка матки обрабатывается раствором Люголя для более точного определения зоны патологической ткани, подлежащей удалению. При обширном поражении шейки матки с распространением лейкоплакии на своды и влагалище целесообразно использовать двухэтапное лазерное излучение; 1 этап — лазерная коагуляция влагалищной части шейки матки, 2 — удаление патологического эпителия влагалища (производится в течение следующего менструального цикла). Полная эпителизация наступает на 16— 40 день, что зависит от распространенности и обширности процесса.
При сочетании лейкоплакии с резко выраженной деформацией и гипертрофией шейки матки целесообразно применение хирургических методов лечения; ножевой или лазерной конизации, клиновидной или конусовидной ампутации шейки матки, реконструктивно-пластических операций с восстановлением нормальной анатомии цервикального канала.
Таким образом, в настоящее время в арсенале врачей имеется достаточное число методов лечения лейкоплакии шейки матки, которые, безусловно, должны применяться дифференцированно. Однако ни один из этих методов не является совершенным. Следует подчеркнуть, что предпочтение следует отдавать лазерокоагуляции. Папилломы и лейкоплакия относятся к особой форме фоновых процессов – дискератозов.
ПРОФИЛАКТИКА ЛЕЙКОПЛАКИИ ШЕЙКИ МАТКИ
Принципы профилактики возникновения лейкоплакии шейки матки включают в себя рациональное лечение предшествующих фоновых процессов шейки матки, исключающие травмирующее воздействие на эктоцервикс диатермокоагуляции и химических коагулянтов, а также современное лечение воспалительных процессов половых органов и нарушений менструального цикла. Пациентки, имеющие в анамнезе воздействие на шейку матки в виде диатермокоагуляции и химических коагулянтов по поводу предшествующих патологических процессов, нуждаются в динамическом ежемесячном кольпоскопическом контроле, особенно в течение первого года после локального воздействия на шейку матки.
ЭРИТРОПЛАКИЯ ШЕЙКИ МАТКИ
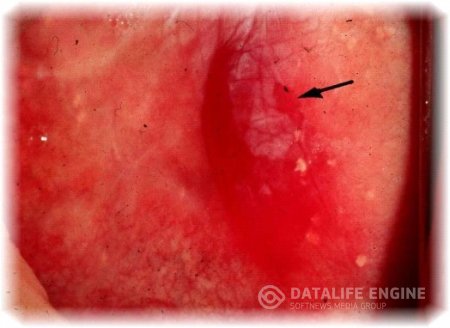
Эритроплакия (в переводе с греческого — «красное пятно») поражение слизистой оболочки влагалищной части шейки матки, характеризующееся атрофией поверхностных слоев эпителияи подразумевает процессы локальной атрофии и дискератоза многослойного плоского эпителия с резким истончением до нескольких слоев (отсутствуют промежуточные клетки) с сохранением нормального эпителиального покрова на прилежащих участках эктоцервикса. Участки эритроплакии определяются как красноватые пятна на эктоцервиксе, что обусловлено просвечиванием сосудов стромы через истонченный эпителий. До настоящего времени этиология, патогенез и прогноз этой редко встречающейся патологии четко не изучены.
Симптоматика может отсутствовать, иногда наблюдаются бели или контактные кровотечения. Эритроплакии нередко сопутствуют кольпит и цервицит. При осмотре шейки матки с помощью влагалищных зеркал эритроплакия представляет собой одиночные, реже множественные, небольшие очаги ярко-красного или бордового цвета неправильной или округлой формы, слегка выступающие над поверхностью слизистой оболочки. При кольпоскопии в области очагов эритроплакии определяется истонченный плоский эпителий, сквозь который просвечивает подлежащая ткань; очаги при обработке 3% раствором уксусной кислоты бледнеют, раствором Люголя не окрашиваются. Эритроплакию, сопровождающуюся атипической гиперплазией клеток базального слоя, относят к предопухолевым заболеваниям. Для исключения опухоли проводят цитологическое исследование мазка-отпечатка, а также гистологическое исследование биопсийного материала.
Лечение заключается в обязательном устранении воспалительного процесса. При атипической гиперплазии клеток базального слоя показаны лазерная терапия, диатермокоагуляция или диатермоэксцизия (иссечение пораженного участка с помощью электроножа). Применяют также криохирургическое лечение. Прогноз при своевременном лечении благоприятный.
ЭКТРОПИОН ШЕЙКИ МАТКИ. ДИАГНОСТИКА И ЛЕЧЕНИЕ
Достаточно частым диагнозом у женщин разных возрастов является такое заболевание шейки матки, как эктропион шейки матки. Под этим состоянием понимается аномальное выворачивание слизистой оболочки канала шейки матки. В большинстве случаев, такая патология затрагивает лишь нижний отдел шейки, однако встречаются случаи, когда выворот охватывает более обширную область. Причиной этого состояния могут выступить различные повреждения шейки матки. В числе таких факторов – травмы, полученные при патологическом течении родового процесса, чаще всего при самопроизвольных родах, что приводит к разрывам шейки матки, зачастую двусторонним. Фактором выворота могут служить также такие причины, как разгибательные предлежания плода, ригидность тканей маточной шейки, крупный плод и др. Зачастую симптомы эктропиона шейки матки возникает как осложнение после экстракции плода или наложения полостных щипцов. Таким образом, выворот слизистых оболочек шеечного канала во многих случаях является последствием родовспомогающих операций и искусственного аборта. При насильственном расширении канала шейки матки (особенно при позднем аборте на больших сроках гестации) порой возникают разрывы, которые впоследствии распознаются как эктропион шейки матки.
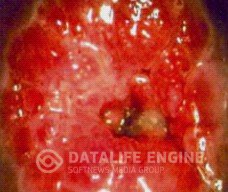
По сути представляет собой сочетание псевдоэрозии с рубцовой деформацией шейки матки.
Поскольку травматический процесс затрагивает целостность тканей матки, захватывая и циркулярные мышцы, ткани, не подвергшиеся повреждению – в частности, продольные мышцы передней и задней губ шейки – продолжают функционировать самостоятельно, не привлекая поврежденные циркулярные мышцы, обычно сокращающиеся в противодействии. При таком дефектном сокращении наружный зев раскрывается (зияние наружного зева), что приводит впоследствии к хроническому вывороту нижнего отдела шеечного канала.
Кроме того, разрывы шейки матки, ее тканей, которые не были правильно ушиты, рубцуются крайне неравномерно, образуя грубые хаотичные складки. В результате травматический процесс заканчивается самопроизвольным образованием плотной рубцовой ткани, неспособной к адекватной трофике, так как области, получившие повреждения, как правило, характеризуются несрощением нервных окончаний и сосудов. Сам рубец после ушивания разрывов шейки матки со временем приобретает плотную малоэластичную структуру, не обладающую ни достаточной степенью иннервации, ни функционально полноценным кровоснабжением. Это влечет нефизиологическую работу слизистых поверхностей цервикального канала. Нарушения трофики, кровоснабжения и иннервации тканевых структур шейки матки обязательно приводят к деформации эндоцервикса.
Анализ цервикальной слизи наглядно показывает патологическое состояние цервикальных желез. В шеечном отделе матки располагается слой цилиндрических клеток, вырабатывающих специфический секрет. Этот секрет радикальным образом отличается от секрета, вырабатываемого железами во влагалище. Норма цервикальной слизи предполагает щелочную реакцию секреции цилиндрического эпителия шеечного канала (endocervix), тогда как при эктропионе слизистая шейки матки подвергается воздействию кислой среды, характерной для слизи влагалищного отдела (exocervix). Подобное нефизиологичное состояние является серьезной помехой для нормальной репродуктивной деятельности, кроме того не препятствует восходящей инфекции органов малого таза, что также приводит к бактериальному заражению микроорганизмами, в норме присущими влагалищной среде, но недопустимыми в шеечном канале. В анализе мазка из цервикального канала обнаруживается присутствие условно патогенных микроорганизмов, характерных для вагинального содержимого, а иногда и ряда бактерий, свойственных для содержимого кишечника (кишечная палочка, энтерококки и др.). Зачастую, такой результат анализа трактуется как последствия недостаточной гигиены или неправильного подмывания, когда при движении сзади на перед во влагалище непроизвольно заносятся микроорганизмы, обнаруживающиеся на слизистой прямой кишки. Тем не менее, это не всегда верно. Снижение иммунитета может приводить к тому, что патогенные микроорганизмы, которые в норме были бы уничтожены иммунными клетками, благополучно проникают в нехарактерные для себя области и начинают развиваться. Осемененная поверхность воспаляется, при этом возникает ряд патологических состояний на слизистой оболочке шейки матки.
При осмотре макроскопически на деформированной шейке матки с зияющим или щелевидным наружным зевом видны красные участки цилиндрического эпителия с видимой ярко-розовой или красной слизистой эндоцервикса (цилиндрического эпителия цервикального канала), нередко с зоной трансформации. В зависимости от степени деформации шейки матки, гипертрофии, кист наботовых желез, а также с учетом возраста и состояния репродуктивной функции больной выбирают тот или иной метод хирургического лечения (криодеструкция, лазерокоагуляция, радиохирургическое воздействие — диатермоэлектроконизация).
Вывернутость зева снижает барьерную функциональность шейки матки, таким образом, являясь причиной воспалительных процессов в силу заселения слизистой оболочки. Сопутствующими диагнозами почти в 100% случаев являются эндоцервицит и последующий цервицит. Часто наблюдается также эндометрит. При кольпоскопии обнаруживаются выраженные утолщения слизистой, грубые складки, характерная гиперемия и отек, порой сопровождающиеся дефектами покровного эпителия. Нарушения эти настолько сильны, что в запущенных случаях наблюдаются характерные белесые отметины, характеризующие очаговую гипертрофию слизистой, в хронике приводящей к атрофии покровного эпителия.
Зачастую эктропион шейки матки сопровождается рядом других сопутствующих диагнозов. Хроническое воспаление вкупе с нарушениями нормальной трофики становятся базой для более сложных патологических состояний, таких как дисплазии, псевдоэрозия, истинная эрозия, атрофия цервикального эпителия, лейкоплакия. Гинекологи придают большое значение выявлению подобных состояний, так как эти патологии влекут за собой возникновение предраковых симптомов и непосредственно самого рака шейки матки.
ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ЭКТРОПИОНА ШЕЙКИ МАТКИ
Родовые травмы и эктропион числятся в списке наиболее частых причин возникновения опухолевого процесса шейки матки наряду с другими заболеваниями, являющимися провокаторами рака шейки матки, такими как вирус папилломы человека (ВПЧ) и генетическая предрасположенность к онкологическим заболеваниям.
Вирусное заражение выявляется при лабораторном исследовании с титрованием генома вируса. Генетическую составляющую возможно выявить при опросе пациентки на предмет наличия родственниц (живых или уже покойных), имевших в анамнезе рак шейки матки.
СИМПТОМАТИКА ЭКТРОПИОНА
Как показывает клиническая практика, эктропион шейки матки чаще всего сопровождается псевдоэрозийными процессами на поверхности вывернутой слизистой оболочки или переферийных участках. Это заболевание характеризуется длительным течением, сходным с псевдоэрозии влагалищной части шейки матки. Нозологически такое состояние определяется как эрозированный эктропион.
Таким образом, эктропион может рассматриваться как сложная клиническая форма эктопии шейки матки в сочетании с псевдоэрозией и деформирующим процессом рубцования. Несмотря на то, что это заболевание в основном имеет приобретенный характер, встречаются случаи врожденного эктропиона шейки матки. Как правило, этот диагноз выявляется у молодых нерожавших женщин, не имевших беременностей. Причиной патологии являются функциональные дисгормональные нарушения.
ДИАГНОСТИКА ЗАБОЛЕВАНИЯ
Диагностика этого заболевания несколько осложнена. Симптоматика эктропиона не характеризуется специфическими симптомами, зачастую жалобы со стороны пациентки вообще отсутствуют. Некоторые симптомы проявляются лишь при развитии патологических процессов, связанных с воспалением, дистрофией или атипическом поведении тканей. В таких случаях наблюдаются усиленные выделения из влагалища (прозрачные или молочного цвета), поясничные боли и боли внизу живота, меноррагии (нарушения менструального цикла), возможны кровянистые выделения после сексуальных контактов.
Диагностика эктропиона шейки матки производится на основе расширенной кольпоскопии шейки матки. Это позволяет распознать деформации и рубцы нижнего отдела шейки матки, выявить осложнения и исследовать характер складок на зияющих участках цервикального канала. Врожденный тип эктропиона характеризуется равномерным расположением складок, тогда как при приобретенном заболевании они хаотичны.
При врожденном эктрапионе показаны гормональные исследования. Цитологические исследования, ПЦР-диагностика, бактериоскопический и бактериологический анализ также полезен при диагностике эктропиона любого типа. Однако при обнаружении аномальных структур показана прицельная биопсия с последующим исследованием гистологического характера.
МЕТОДЫ ЛЕЧЕНИЯ ЭКТРОПИОНА ШЕЙКИ МАТКИ
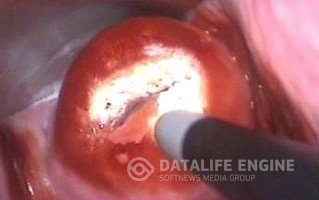
Поскольку для лечения эктропиона необходимо восстановление нормальной трофики шейки матки, основным методом ликвидации патологии является удаление деформированных тканей. Оперативное вмешательство также позволяет снизить риск возникновения предраковых состояний эндоцервикса. Применяются такие методы, как диатермокоагуляция, лазерная вапоризация, криодеструкция эктропиона, а также радиоволновая конизация шейки матки или эксцизия шейки матки. Выбор метода лечения производится с учетом индивидуальных особенностей пациентки (возраст, состояние репродуктивной системы, результаты кольпоскопии шейки матки и цитологических исследований). Криодеструкция показана при врожденном эктропионе шейки матки, конизация шейки матки или радиоэксцизия выполняются при выраженных изменениях тканей, наличии дисплазии или предраковых состояний. При этом пораженный фрагмент шейки матки и часть цервикального канала удаляются. Хирургические методы полезны при сильной деформации тканей и позволяют провести биопсию патологических структур для последующего морфологического исследования. Реабилитационный период состаялвяет4-6 недель, во время которых ограничиваются половые контакты, физические нагрузки, запрещается спринцевание, использование гигиенических тампонов, принятие ванн, посещение бани, сауны, бассейна.
Деструкция эктропиона не причиняет значительного вреда пациенткам, и после коррективной операции на шейке матки барьерная и репродуктивная функции маточного зева успешно восстанавливается. Однако необходимо помнить, что хирургические методы не избавляют больную от воспалительных процессов, поэтому необходима ликвидация инфекции и восстановление вагинальной микрофлоры путем медикаментозной терапии. Показано применение антибактериальных, противовирусных, гормональных, а также иммуномодулирующих препаратов.
ПРОГНОЗИРОВАНИЕ ЭКТРОПИОНА ШЕЙКИ МАТКИ
Прогноз эктропиона шейки матки в целом представляется благоприятным, однако следует помнить о коварности этого заболевания. Поскольку протекает оно в большинстве случаев совершенно бессимптомно, необходимо производить регулярные профилактические осмотры. Гинекологический осмотр женщин в зеркалах и кольпоскопия шейки матки позволяют распознать патологические процессы изменения тканевых структур на самом раннем этапе. Это чрезвычайно важно. Зачастую пациентки не торопятся к гинекологу, поскольку не испытывают особого дискомфорта, однако такое поведение приводит к тому, что заболевание не диагностируется вовремя и патологические процессы бесконтрольно развиваются, что приводит к весьма негативным последствиям. Как минимум – развиваются восходящие инфекции, приводящие к нарушению репродуктивных функций, а впоследствии к бесплодию. Как максимум – несвоевременная диагностика приводит к тому, что упускается драгоценное время, и патологические процессы заходят слишком далеко. Порой опухолевый процесс уже не удается остановить.
Профилактическая работа чрезвычайно важна. Своевременное обнаружение изменений в структурах тканей позволяет засечь самые ранние признаки предраковых состояний, а соответственно и вовремя принять меры, чтобы избежать более серьезного диагноза – это обеспечивают регулярные гинекологические осмотры женщин.
Кроме того, грамотное ведение родов и адекватная ликвидация травм, полученных во время родового процесса, позволяет избежать возникновения грубых рубцовых утолщений на шейке матки, являющихся основой развития эктропиона – это можно сделать и в районной поликлиннике, и в коммерческих клиниках, и платных стационарах. Современные методы контрацепции также позволяют избежать этого заболевания, так как травмы, получаемые при проведении абортов, являются провоцирующим фактором в развитии эктропиона шейки матки.
ЭНДОМЕТРИОЗ ШЕЙКИ МАТКИ.
Последнее время отмечается рост частоты эндометриоза шейки матки. Эндометриоз шейки матки может встречаться в любом возрасте, но чаще всего у молодых женщин. До сегодняшнего дня причина его возникновения точно неизвестна. Чаще всего эндометриоз шейки матки наблюдается после диатермокоагуляции (проведенной без учета менструального цикла), после пластических операций на шейке матки, после надвлагалищной ампутации матки (произведенной по поводу миомы матки без учета ее возможного сочетания с аденомиозом) и после родов.
К факторам возникновения данной патологии относятся медицинские аборты (эндометриоз шейки возникает в местах наложения пулевых щипцов), роды.
Нередко эндометриоидные очаги выглядят в виде кистозных образований синюшнего, либо багрового цвета. Иногда в предменструальный период содержимое этих кист изливается наружу в виде выделений шоколадного цвета.
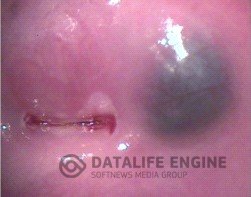
Это единственная локализация эндометриоза, которая обычно существует отдельно. Но иногда эндометриоз шейки матки может быть и в сочетании с другими вариантами эндометриоза (ретроцервикальным эндометриозом, эндометриозом брюшины малого таза, крестцово-маточных связок).
В одних случаях женщина не предъявляет никаких жалоб и диагноз эндометриоза шейки матки устанавливается лишь на осмотре у гинеколога, при кольпоскопии. В других случаях первой жалобой пациентки являются пред- и постменструальные выделения в виде «мазни». Если эндометриоз локализуется только во влагалищной части шейки матки, то болевого синдрома, как правило, не возникает. Лишь при прорастании эндометриоидных гетеротопий в цервикальный канал или при сочетании его с другими локализациями эндометриоза возникают тянущие боли внизу живота, меняющие свою интенсивность в течение цикла, боли при половой жизни. Бесплодие при эндометриозе шейки матки встречается крайне редко.
Лечение эндометриоза шейки матки только оперативное (иссечение эндометриоза, диатермокоагуляция, крио- и лазерохирургия). Удаление очага эндометриоза необходимо производить в раннюю фолликулиновую фазу менструального цикла (6—7 день), при этом предварительно произведя биопсию с обязательным гистологическим исследованием, Рецидивы заболевания после адекватного удаления эндометриоидного очага встречаются крайне редко.
Диагноз устанавливается при визуальном осмотре, кольпоскопии и гистологическом исследовании удаленного препарата. При эндометриозе шейки матки рекомендуется провести дополнительные методы исследования: УЗИ органов малого таза, гистероскопию – для исключения дополнительных очагов другой локализации.
Если очаги эндометриоза небольшие и ограничены шейкой, то зачастую никаких хирургических вмешательств не требуется. При больших кистозных образованиях рекомендуется проводить лазерную аблацию, иногда биопсию. Хирургическое лечение необходимо сочетать с медикаментозным. Таким образом, поставить диагноз и пролечить эндометриоз шейки матки достаточно просто.
Лечение эндометриоза шейки матки достаточно просто, но необходимо знать симптоматику, своевременно установить диагноз и произвести адекватное удаление эндометриоидных очагов. Применение вспомогательных технических средств (лазера, крио-, фибринового клея и т.д.) намного улучшает эффективность проведенной операции. Препарат гормональной коррекции подбирается индивидуально.
В заключение можно сказать, что эндометриоз – это сложное заболевание, течение которого у каждой больной различно. В одних случаях проведение даже одного курса комбинированного лечения достаточно для полной излечимости заболевания. В других случаях, несмотря на, казалось бы, адекватное лечение, наблюдается дальнейшее прогрессирование и/или рецидивирование заболевания. Поэтому необходима дальнейшая разработка проблемы эндометриоза, особенно гормональных, генетических и иммунных его аспектов.
ОБСЛЕДОВАНИЕ БОЛЬНЫХ С ПАТОЛОГИЕЙ ШЕЙКИ МАТКИ ДОЛЖНО БЫТЬ КОМПЛЕКСНЫМ
В клинической практике для диагностики заболеваний шейки матки применяют разные методы, но наиболее доступными для работы являются следующие:
- Клинико-визуальный метод
Клинико-визуальный метод предполагает осмотр шейки матки в зеркалах и бимануальное и/или ректовагинальное исследование. При осмотре в зеркалах оценивают размеры и форму шейки матки, состояние эпителия, характер выделений. При осмотре шейки с добавлением теста с 3% уксусной кислотой и раствором Люголя можно выявить выраженные патологические изменения. При применении данного метода возможна гипердиагностика патологии шейки матки, который является ненадежным в период менопаузы.
- Молекулярно-биологические методы (ПЦР)
Исследование методом ПЦР активно применяется для диагностики заболеваний, передающихся половым путем (ЗППП). На сегодня врачи констатируют тот факт, что эти болезни распространились слишком широко и заметно «помолодели». Инфицирование происходит чаще всего при незащищенном половом контакте, для ряда возбудителей возможны и другие пути проникновения в организм человека (вода, вещи больного и проч.). Коварство таких болезней заключается в том, что симптомы у большинства из них, особенно на ранних стадиях заболевания, «стерты». Определить наличие в организме возбудителя ЗППП с помощью традиционных анализов непросто. Да и не секрет, что заболевшие люди вовсе не обращаются к врачу, а стараются вылечиться самостоятельно. Когда же симптомы становятся явными, лечить болезнь становится достаточно сложно. Именно поэтому при первых же подозрениях наличия такой инфекции врачи рекомендуют анализ ПЦР. Метод ПЦР диагностики позволяет в минимальной пробе определить наличие возбудителя болезни и начать лечение своевременно.
- Цитологическое исследование является скрининговым методом; при профилактических осмотрах, материал берут специальным шпателем Эйра. Гистологическое исследование биоптата шейки – забор материала проводится специальными щеточками Rovers® Cervex-Brush® Combi или Rovers® Cervex-Brush® (комплект для забора материала фирмы BD TriPath™)
- Бактериоскопическое и бактериологическое исследование отделяемого из влагалища, цервикального канала, уретры;
- Простая и расширенная кольпоскопия после простой кольпоскопии проводят пробу с 3% уксусной кислотой, а затем пробу Шиллера с 2% раствором Люголя;
Кольпоскопия – осмотр поверхности влагалищной части шейки матки в условиях дополнительного освещения и оптического увеличения в 4-40 раз, который позволяет определить характер, степень выраженности, локализацию и границы патологического процесса, определить зону с наибольшими изменениями для прицельного забора биопсийного материала, оптимизировать выбор метода лечения и проследить динамику трансформации эпителия.
В настоящее время кольпоскопию необходимо проводить при каждом углубленном гинекологическом исследовании, перед бимануальным гинекологическим осмотром и другими манипуляциями на шейке, в том числе взятием мазков на онкоцитологию и проведением биопсии. Метод атравматичен, безболезнен, не имеет противопоказаний. Расширенная кольпоскопия включает проведение тестов с 3% уксусной кислотой и раствором Люголя.
- Кольпомикроскопия является прижизненным гистологическим исследованием, т.к. даёт увеличение в 400 раз;
Кольпомикроскопия – оригинальный метод прижизненного гистологического исследования слизистой оболочки шейки матки. По остроумному выражению Antoine, Grimberger (1963), предложивших в 1949 г. этот метод, «кольпомикроскопия — младший ребенок в семье методов диагностики рака шейки матки».
При однократном положении фронтальной линзы объектива на шейку матки можно рассмотреть поверхность эпителия диаметром 0,92 мм при 170-кратном увеличении. Перед исследованием шейка матки окрашивается акридиновым красителем. При кольпомикроскопии неизмененной слизистой оболочки шейки матки у женщин репродуктивного периода в зависимости от фазы менструального цикла можно видеть все слои плоского эпителия. У женщин, находящихся в постменопаузе, обычно удается рассмотреть только поверхностный и промежуточный слои. Клетки многослойного плоского эпителия выглядят как «соты», плотно прилегающие друг к другу, с центральным расположением ядер.
- Прицельная биопсия скальпелем из йод-негативных зон с последующим гистологическим исследованием и верификацией диагноза.
Биопсия – удаление небольших участков шеечной ткани для гистологического исследования. Показания для кольпоскопии и биопсии:
- женщины с положительными или ненормальными результатами скрининга;
- подозрительные поражения, выявляемые при зеркальном осмотре;
- диагностика и определение патологических участков до выполнения криотерапии или электроэксцизии.
Биопсия выполняется под контролем кольпоскопии специальными биопсийными щипцами, при этом берутся один или несколько маленьких кусочка ткани толщиной от 1 до 3 мм. Кровотечение при этом минимальное. Образцы тканей погружаются в формалин для фиксации и маркируются.
- Гистологический метод является завершающим этапом комплексного обследования шейки матки и используется на этапе окончательной постановки клинического диагноза, позволяет проследить изменения в эпителиальном пласте и вовлечении подлежащей ткани (стромы).
ПРЕДРАКОВЫЕ ЗАБОЛЕВАНИЯ И РАК ШЕЙКИ МАТКИ
Предрак и рак шейки матки имеют общие этиологию и патогенез. Считают, что канцерогены попадают на шейку матки при половых контактах. Многим традиционным канцерогенам и инфекционным агентам сейчас отводится очень скромная роль (трихомонады, хламидии, вирус герпеса, сперма, смегма и др.). Только вирус папилломы человека в настоящее время считают реальной причиной предрака и рака шейки матки. Вирус обнаруживается в 90% наблюдений умеренной, тяжелой дисплазии и рака шейки матки. Известно более 120 типов вируса папилломы человека, 20 из них могут поражать половые органы, онкогенными свойствами обладают серотипы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58. Наиболее часто встречаются серотипы 16 и 18 (более 70%), остальные серотипы выявляются менее чем в 30% наблюдений.
Папилломавирусная инфекция может быть латентной (носительство), субклинической (цитологические изменения) и клинически выраженной (эндофитные, экзофитные кондиломы). В большинстве случаев заражение вирусом папилломы человека остается незамеченным, инфекция бессимптомна и происходит элиминация вируса. У части больных, имеющих наследственную предрасположенность или отягощенность по раку шейки матки, возникает дисплазия шейки матки. Среди больных, у которых не происходит удаления вируса серотипов 16 и 18, вирус инфицирует клетку, встраивается в геном, начинается репликация, а в последующем в 80% случаев развиваются дисплазия и рак. Считается, что в возникновении дисплазии и рака шейки матки могут играть роль наследственно обусловленные дефекты механизмов защиты, восприимчивость эпителия.
Под цервикальной интраэпителиальной неоплазией (CIN) подразумевают процессы структурной и клеточной атипии (нарушение дифференцировки клеток) с нарушением слоистости эпителия без вовлечения базальной мемебраны. Согласно классификации ВОЗ (1995) выделяют легкую, умеренную и тяжелую CIN. Если нарушение структуры эпителия, полиморфизм клеток, увеличение митозов, дискариоз ядер наблюдаются в нижней трети эпителиального пласта, то говорят о CIN I, в нижней и средней третях — о CIN II, если вышеуказанные изменения захватывают весь пласт — о CIN III. Условной границей тяжелой дисплазии и преинвазивного рака является вовлечение в процесс поверхностного слоя эпителия. Все эти состояния являются последовательными этапами развития одного достаточно длительного злокачественного процесса. Переход дисплазии в рак in situ занимает в среднем 2—10 лет, для возникновения инвазивного рака также требуется в среднем 10—15 лет. Следовательно, для выявления предракового процесса и начальных стадий рака шейки матки есть достаточно времени.
Дисплазия остается бессимптомной и может возникать при визуально неизмененной шейке матки (10%) и при фоновых процессах (90%). Кольпоскопическая картина дисплазии может включать в себя патологические сосуды (расширенные, неправильно ветвящиеся) в зоне превращения, пунктации, мозаики, беловатую окраску эпителия. Дисплазия обусловливает локальное побеление эпителия при ацетоуксусном тесте и йоднегативные зоны при пробе Шиллера (рис. 12.5). Цитологическое исследование оказывается информативным в 60—90% наблюдений. Однако ни кольпоскопия, ни цитология не позволяют определить степень дисплазии и исключить преинвазивный и микроинвазивный рак. Окончательный диагноз устанавливают на основании гистологического заключения. Прицельная ножевая биопсия шейки матки с выскабливанием цервикального канала позволяет получить материал для гистологического исследования. Не рекомендуется производить биопсию конхотомом (специальные щипцы), поскольку эта методика не позволяет оценить подлежащую строму. Не приветствуется и электропетлевая биопсия, так как коагуляционные повреждения тканей затушевывают патологические изменения. Необходимо избегать неоправданной биопсии шейки матки и стремиться к полному удалению патологического очага с последующим гистологическим исследованием, поскольку при биопсии нарушается целостность базальной мембраны эпителия и рак может перейти в следующую стадию.
В настоящее время существует несколько классификаций дисплазии и цервикального рака (табл. 1).
|
Таблица 1. Современные морфологические и цитологические классификации дисплазии и РШМ |
|||
|
Морфологические классификации |
Цитологические классификации |
||
|
Морфология |
CIN system |
Папаниколау |
Bethesda (1991) |
|
Норма, изменения отсутствуют |
Норма |
Класс I |
Негатив |
|
Незначительные клеточные изменения |
Незначительные клеточные изменения |
Класс II |
Доброкачественные клеточные изменения, воспаление |
|
Плоскоклеточная |
Плоскоклеточная |
Класс II |
Атипия плоскоклеточная неопределенной значимости |
|
Папилломавирусные |
Папилломавирусные изменения (койлоцитоз) |
Класс II |
LSIL (НПИП)* |
|
Слабая дисплазия |
CIN I |
Класс III |
LSIL (НПИП) |
|
Дисплазия средней степени |
CIN II |
Класс III |
HSIL (ВПИП)** |
|
Дисплазия высокой |
CIN III |
Класс III |
HSIL (ВПИП) |
|
Carcinoma in situ (CIS) |
CIN III |
Класс IV |
HSIL (ВПИП) |
|
Инвазивный РШМ |
Инвазивный РШМ |
Класс IV |
Инвазивный РШМ |
|
* LSIL (Low-grade squamous intraepitelial lesions), или НПИП (плоскоклеточное интраэпителиальное поражение низкой степени выраженности). |
|||
КЛАССИФИКАЦИЯ КОЛЬПОСКОПИЧЕСКОЙ КАРТИНЫ
Приводим классификацию Международной федерации по кольпоскопии и цервикальной патологии (International federation for cervical pathology and colposcopy, IFCPC), которая была пересмотрена Номенклатурным комитетом IFCPC на Всемирном конгрессе в Барселоне в июне 2002 г.
I. Нормальные кольпоскопические результаты:
- оригинальный сквамозный эпителий;
- цилиндрический эпителий;
- зона трансформации.
II. Анормальные кольпоскопические результаты:
- ацетобелый эпителий;
- пунктация;
- мозаика;
- йоднегативный эпителий;
- атипические сосуды.
III. Кольпоскопические подозрения на инвазивный рак:
- неоднородная поверхность. Эрозия или язва;
- плотные ацетобелые изменения;
- широкая неоднородная пунктация или мозаика;
- атипические сосуды.
IV. Неудовлетворительная кольпоскопия:
- стык эпителиев невозможно визуализировать. Это может наблюдаться при травме, воспалительном процессе, атрофии, отсутствии ШМ.
V. Разные кольпоскопические результаты:
- кондилома;
- кератоз;
- эрозия (отсутствие покровного эпителия, т.е. истинная эрозия);
- воспаление;
- атрофия (обусловленная гипоэстрогенией);
- децидуоз (образования характерны для беременности);
- полип.
Относительно недавно была представлена новая классификация IFCPC, предложенная Номенклатурным комитетом и одобренная на Всемирном конгрессе в июле 2011 г. в Бразилии (табл. 2). Ее авторы полагают, что эта классификация является более удобной для практического врача.
|
Таблица 2. Международная классификация кольпоскопических терминов (2011) |
|||
|
Кольпоскопическая картина |
Характеристика |
||
|
Общие положения |
Адекватная/неадекватная кольпоскопическая картина |
||
|
Нормальная кольпоскопическая |
МПЭ: |
||
|
Аномальная кольпоскопическая картина |
Общие принципы |
Локализация поражения: в пределах или вне зоны трансформации; соответствие с циферблатом |
|
|
Степень I |
Тонкий ацетобелый эпителий |
Нежная мозаика |
|
|
Степень II |
Плотный ацетобелый эпителий |
Грубая мозаика |
|
|
Неспецифические |
Лейкоплакия (кератоз, гиперкератоз) |
||
|
Подозрение на инвазию |
Атипические сосуды |
||
|
Другие |
Врожденная зона трансформации |
||
При постановке кольпоскопического диагноза должна быть использована только кольпоскопическая терминология, которую морфолог обязан хорошо понимать. При этом гистологи оперируют другой терминологией. Последнюю кольпоскописту также следует знать, поскольку лишь синтез результатов его исследования и последующего заключения морфолога позволяет установить окончательный клинический диагноз и определить тактику ведения пациентки в каждом конкретном случае.
В кольпоскопический диагноз вписывается название группы терминов, а далее дается более подробная их расшифровка, например: «Кольпоскопия удовлетворительная. Аномальная кольпоскопическая картина: плотный ацетобелый эпителий, грубая пунктация».
Цитоморфологические признаки инфицированности ВПЧ и наличия CIN следующие:
- выявление койлоцитов;
- увеличение размера ядер эпителиоцитов;
- накопление хроматина;
- полиморфизм ядер многослойного плоского эпителия (МПЭ);
- повышение частоты митозов;
- появление атипичных фигур митоза;
- нарушение ядерно-цитоплазматического соотношения в клетках МПЭ;
- нарушение созревания и дифференцировки клеток МПЭ.
Основными методами диагностики папилломавирусной инфекции (ПВИ) и дисплазии ШМ являются:
- цитологическое исследование (Пап-тест);
- ВПЧ-тестирование (выявление ДНК ВПЧ);
- кольпоскопия;
- биопсия с последующим гистологическим исследованием;
- оптические методы;
- определение биомаркеров.
Каждый из вышеперечисленных методов исследования, к сожалению, не идеален и не может полностью гарантировать выявление заболевания. К примеру, информативность Пап-теста зависит от способа взятия мазка, метода окраски и опыта цитолога, а биопсии – от качества и размера образца. Частота выявления дисплазии или неинвазивного рака также зависит от количества взятых для исследования фрагментов эпителия ШМ. При неадекватном отборе биоптата из зоны умеренной дисплазии и наличии рядом неверифицированных участков преинвазивного или микроинвазивного рака больная подвергается риску деструктивного воздействия без дальнейшего гистологического контроля, что может привести к прогрессированию процесса. Поэтому желательно использовать прицельную множественную биопсию или петлевую эксцизию. Биопсию следует выполнять под кольпоскопическим контролем, отбирая образцы для гистологического исследования из участков с наиболее тяжелыми поражениями. По его результатам будет установлен диагноз, определяющий дальнейшую тактику ведения больной.
Чувствительность цитологического метода в отношении РШМ составляет 60-80%, однако он обладает высокой специфичностью.
ВПЧ-тест имеет высокую чувствительность, но более низкую специфичность. Согласно международным рекомендациям, данный метод входит в программу обследования женщин старше 30 лет вместе с Пап-тестом и может быть рекомендован для определения тактики ведения пациенток при сомнительных результатах цитологического исследования. ВПЧ-тест эффективен в плане осуществления контроля после лечения.
Кольпоскопия – малоспецифический метод, который требует проведения качественных тренингов и наличия достаточного опыта у специалиста. Основные задачи данного исследования заключаются в том, чтобы выявить очаг поражения и отдифференцировать доброкачественное изменение от злокачественного. Среди методик кольпоскопии различают:
- простую кольпоскопию – осмотр ШМ при стандартном увеличении без применения медикаментозных средств;
- расширенную кольпоскопию, которую проводят с применением медикаментов, являющихся эпителиальными и сосудистыми тестерами.
Чаще всего используют пробу с 3% раствором уксусной кислоты и 2% раствором Люголя (проба Шиллера). При этом оценивают следующие параметры: цвет слизистой оболочки; сосудистый рисунок, ход сосудов, их калибр и способность реагировать на уксус; локализацию стыка многослойного плоского и цилиндрического эпителия; присутствие желез и их форму; реакцию на раствор уксусной кислоты и раствор Люголя; границу образований.
ЛЕЧЕНИЕ ЖЕНЩИН С ПАТОЛОГИЕЙ ШЕЙКИ МАТКИ
Современная тактика ведения женщин с патологией ШМ должна быть обоснованной и базироваться на данных доказательной медицины. Применение новой номенклатуры, отражающей современные достижения, позволяет обеспечить преемственность между специалистами.
При подозрении на предрак или микроинвазивный РШМ применяют такие методы лечения, как:
- деструкция (абляция) – лазерная, радио-, электро-, криотерапия, аргоноплазменная коагуляция;
- эксцизия – радионож, электронож.
Абляция – щадящий метод, после которого при последующей беременности наблюдается меньше осложнений. Однако при этой операции невозможно произвести забор ткани для гистологического исследования. Также ее нельзя выполнять, если стык многослойного плоского и цилиндрического эпителия не виден.
В связи с этим сегодня более часто используют эксцизию, в частности петлевую электроэксцизионную процедуру. Этот метод дает возможность получить хороший гистологический образец с минимальной ожоговой поверхностью. Выделяют три типа петлевой электроэксцизионной процедуры в зависимости от типа зоны трансформации ШМ (рис.).
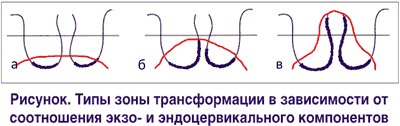
а) Зона трансформации I типа:
- полностью на экзоцервиксе;
- полностью визуализируется;
- любых размеров.
б) Зона трансформации II типа:
- не полностью на экзоцервиксе, имеется эндоцервикальный компонент;
- полностью визуализируется;
- любых размеров.
в) Зона трансформации III типа:
- не полностью на экзоцервиксе, имеет большой эндоцервикальный компонент;
- полностью не визуализируется;
- любых размеров.
Поскольку нет доказанных приоритетных консервативных методов лечения CIN, эксцизия является предпочтительной ввиду наилучшей гистологической оценки.
Еще одним перспективным методом лечения патологии ШМ является радиоволновая хирургия, которая имеет следующие преимущества:
- высокую точность, эффективность и быстрое лечение;
- быстрое заживление без тяжелых рубцовых изменений, что гарантирует сохранение репродуктивной функции даже при очень обширных хирургических вмешательствах;
- отсутствие болезненности в послеоперационном периоде;
- бактерицидный эффект от воздействия радиоволн, позволяющий использовать данный метод даже при весьма запущенных формах эндоцервицита;
- экономическая целесообразность (нет необходимости в предварительной биопсии).
Тактика ведения пациенток с СIN зависит от различных факторов: возраста, мотивации, соматического состояния женщины, возможностей врача.
При CIN I предпочтительной тактикой является тщательный цитологический контроль и последующее кольпоскопическое наблюдение. Активное ведение больных рекомендуется в таких случаях:
- неудовлетворительная кольпоскопия;
- обширные повреждения;
- длительность течения CIN I > 18 мес;
- возраст женщины > 35 лет;
- невозможность дальнейшего наблюдения.
При CIN II используют деструктивную терапию или эксцизию, а при выявлении CIN III пациентку направляют к онкологу.
Следует отметить, что существуют особые ситуации, когда кольпоскопическая картина изменена (беременность, менопауза, воспалительный процесс ШМ, прием гормональных контрацептивов, молодой возраст пациентки, ШМ после лечения). Так, при беременности происходят изменения в стромальном, сосудистом и эпителиальном компонентах ШМ. Кольпоскопически она гипертрофирована и цианотична, сосудистый рисунок более выражен, рельефен, зев может зиять, появляются децидуальные изменения. Тактика ведения беременных с патологией ШМ, включающей CIN и ПВИ, окончательно не определена, однако она должна быть индивидуальной и щадящей.
Кольпоскопическая картина в менопаузе характеризуется тонкостью и незрелостью эпителия. Наряду с очаговыми пятнистыми кровоизлияниями можно наблюдать диффузные кровотечения и мелкие эрозии. Назначение курса эстрогенотерапии позволяет более точно провести переоценку клинической ситуации. Доказано также, что применение эстрогенов в менопаузе не повышает риска развития рака ШМ, влагалища и вульвы.
При воспалении кольпоскопическая картина зависит от его стадии и этиологии.
Под влиянием гормональной контрацепции созревание и десквамация МПЭ повышаются, что вызывает кольпоскопические изменения, сходные с беременностью.
У молодых женщин при LSIL предпочтительным методом лечения является абляция. Пациенток с CIN II можно наблюдать без лечения в течение 12-18 мес, поскольку у 65% из них происходит регрессия процесса до нормы.
В отношении ПВИ, которая играет важную роль в развитии патологии ШМ, существуют также альтернативные методы лечения, такие как иммунотерапия (интерфероны, иммуномодуляторы, индукторы интерферона), витаминотерапия, озонотерапия.
Иммунотерапия повышает вероятность самоэлиминации ВПЧ и способствует регрессии LSIL. При персистенции LSIL через год рекомендуется проведение абляции или эксцизии, а при HSIL предпочтительной является эксцизия.
Имеется ряд работ о положительных результатах комплексного применения в схемах лечения ВПЧ иммуномодулятора и индол-3-карбинола, избирательно ингибирующих синтез вирусом протеина Е7 в эпителиальных клетках, что делает обоснованным исследование эффективности применения иммуномодулятора в сочетании с индол-3-карбинолом. Включение этих препаратов в комплекс терапии может повысить ее эффективность.
В настоящее время мы используем в качестве иммуномодулятора Азоксимера бромид, который обладает выраженной иммуномодулирующей активностью и, прежде всего, действует на систему врождённого иммунитета (факторы неспецифической защиты организма, доиммунные факторы резистентности к инфекциям): клетки моноцитарно-макрофагальной системы, нейтрофилы и естественные клетки-киллеры, вызывая повышение их функциональной активности при исходно сниженных показателях (включая усиление цитотоксичности естественных киллеров). Под действием Азоксимера бромида активируется вся иммунная система организма. Данная активация аналогична формированию иммунной реакции в ответ на антигенный (патогенный) фактор.Азоксимера бромид оказывает активирующее действие на неспецифическую резистентность организма, фагоцитоз, гуморальный и клеточный иммунитет, действует на все звенья иммунного ответа. Препарат повышает функцию естественных клеток-киллеров только в том случае, если она была исходно понижена. На нормальные уровни цитотоксичности лимфоцитов он влияния не оказывает.
Наряду с иммуномодулирующим действием, Азоксимера бромид обладает выраженной детоксикационной активностью, которая определяется высокомолекулярной природой препарата. Детоксикационный потенциал Азоксимера бромид очень велик, он в сотню раз выше гемодеза. Антиоксидантное и мембранопротекторное действие, также, как и детоксицирующее, тесно связаны с особенностями химической структуры Азоксимера бромид, который существенно снижает чувствительность клеток к повреждающему действию лекарственных средств, в частности антибиотиков, противовирусных, гормональных препаратов и др. Азоксимера бромид, кроме иммуностимулирующего, детоксиксикационного, антиоксидантного и мембраностабилизирующего эффектов, обладает свойствами гепатопротектора.
При ВПЧ инфекции и патологии шейки матки Азоксимера бромид назначается по следующей схеме: интравагинально по 12 мг ежедневно в течение 3-х дней. Далее по 12 мг 1 раз в 3 дня. Курс 10 введений.
В качестве таргетной терапии мы предлагаем использовать Индинол и Промисан в качестве лечения дисплазии шейки матки 2-3 степени тяжести препарат. Препараты индинол ипромисан блокируют процесс формирования и дальнейшего развития атипии в клетках и препятствуют развитию CIN, вызывают апоптоз клеток, инфицированных ВПЧ, блокируют выработку онкобелков Е6 и Е7, нормализуют баланс метаболитов эстрогенов. Эти препараты являются безопасным средством негормонального происхождения, безопасны при длительном применении, так как отсутствуют токсические эффекты, характерные для химиотерапевтических препаратов. При ВПЧ инфекции и патологии шейки матки индинол назначается по 2 капсулы 2 раза в день в течение 6 месяцев или промисан по 1 капсуле 2 раза в день в течение 6 месяцев.
ПРОФИЛАКТИКА РАКА ШЕЙКИ МАТКИ
Диспансерное наблюдение после лечения фоновых заболеваний проводится в женской консультации в течение года.
Реальной профилактикой рака шейки матки (РШМ) является ранняя диагностика и своевременное лечение предраковых процессов, к которым относится цервикальная интраэпителиальная неоплазия (Cervical intraepithelial neoplasia, CIN). Новые данные об этиологии и патогенезе РШМ привели к тому, что диагностические и лечебные возможности расширились, и тактика ведения женщин с той или иной патологией ШМ стала более щадящей.
Практическому врачу приходится постоянно пополнять свои знания в области современных технологий и индивидуализировать подходы к ведению пациенток, опираясь на достижения доказательной медицины.
На сегодняшний день хорошо известно, что вирус папилломы человека (ВПЧ) приводит к развитию РШМ. Инфицирование происходит преимущественно половым путем, в большинстве случаев – в начале половой жизни женщины (18-25 лет). С момента инфицирования до развития инвазивного РШМ проходят годы или десятилетия, поэтому есть определенный промежуток времени, чтобы выявить и эффективно излечить предраковое заболевание. Методов определения ВПЧ в крови не существует, поскольку он поражает исключительно эпителиальную ткань.
Вирус проникает через поврежденные участки в эпителий ШМ и может персистировать там длительное время, после чего начинает активно размножаться, что приводит к дисплазии, а потом и к РШМ.
В зависимости от уровня нарушения в строении эпителия выделяют три степени дисплазии. Чем большее количество слоев имеет нарушенную структуру и морфологию, тем тяжелее заболевание.
Профилактика РШМ в большей мере связана с профилактикой ПВИ и других инфекций, передающихся половым путем, и должна включать целый комплекс мероприятий:
- определение факторов риска распространения инфекций и их ликвидация;
- отказ от курения и других вредных привычек, пропаганда барьерной контрацепции;
- раннее выявление РШМ и предраковых заболеваний с помощью цитологического и других методов исследования;
- своевременное излечение и последующее наблюдение;
- широкое внедрение лицензированных профилактических вакцин.
Основная роль в первичной профилактике отводится так называемым интервенционным программам, направленным на повышение уровня сексуального образования населения.
Одним из последних достижений науки явилось создание эффективных профилактических вакцин против РШМ, а именно против ВПЧ. На сегодняшний день они широко внедряются в практику.
Вторичная профилактика заключается в проведении скрининга, т.е. в раннем выявлении различных форм предрака и РШМ при тотальном обследовании уязвимых групп населения. Скрининг эффективно снижает заболеваемость РШМ в том случае, если он хорошо организован, охватывает большинство представительниц группы риска и предусматривает активный вызов пациенток на обследование.
Повышение эффективности профилактики связывают с увеличением охвата женского населения периодическими обследованиями, а также с внедрением новых технологий, таких как жидкостная цитология, ВПЧ-тестирование, компьютерная диагностика и др.
ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ.
После проведенного лечения заболевания шейки матки женщины должны состоять на диспансерном учете в женской консультации в течении года. Периодичность осмотров- через 1 месяц, 3, 6 мес. и 1 год. При выздоровлении снятие с учета.
После лечения предраковых процессов (дисплазия плоского эпителия различных степеней выраженности) диспансерное наблюдение должно проводиться в течении 2 лет. Эффективность проведенного лечения необходимо контролировать не только взятием мазков- отпечатков с шейки матки для онкоцитологического исследования, но также кольпоскопией в динамике и гистологическим исследованием биопсийного материала через 1 и 2 года после лечения. При подозрении на прогрессирование диспластического процесса или переход его в интраэпителиальный рак, биопсия должна быть выполнена в другие необходимые сроки.
Пациентки, снятые с учета, должны, как и другие женщины проходить ежегодные гинекологические осмотры с исследованием шейки матки в зеркалах, взятием мазков-отпечатков, проведением простой и расширенной кольпоскопии или хотя бы пробы Шиллера.
Не менее важным, чем сами осмотры, является правильно организованная санитарно-просветительноя работа, разъясняющая цель и значение профосмотров, заинтересованность в них каждой женщины и, наконец, необходимость своевременного обращения к врачу при появлении малейших признаков, вызывающих подозрение на рак.
ЛИТЕРАТУРА
- Алиева Т.Д. Скрининг рака шейки матки. Ошибки в диагностике и пути их предупреждения//материалы международного конгресса «Международный Конгресс «Здоровье для всех: Хронические заболевания. Проблемы. Решения», Вестник АГИУВ, май 2013
- Аполихина И.А. Папилломавирусная инфекция гениталий у женщин // ГЭОТАР-МЕД., 2004, 112 страниц
- Болгова Л.С. Главные акценты современной организации цитологического скрининга рака шейки матки//Здоровье Украины, №1/2, 2009.-с.28
- Заболевания шейки матки: Руководство для врачей (изд. 2-е, перерарб. И доп.) / Т.Е. Белокриницкая, Е.С.Свердлова. — Чита, 2011. — 48 с.
- Семенова Л.А., Киселев Ф.Л., Петренко А.А., Иванова Т.А., Ешилев Э.М., Киселева Н.П., Беляков И.С., Блиев А.Ю., Кобзева В.К., Мазуренко Н.Н, Павлова Л.С. Молекулярные маркеры рака шейки матки// Вестник Российской Академии медицинских наук, 2002.-N 1.-С.8-14
- Ранняя диагностика рака шейки матки на уровне первичной медико-санитарной помощи. Цитологический скрининг//Методические рекомендации под редакцией д.м.н. Нургазиева К.Ш. –Алматы, 2012






