Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Инфекции мочевыводящих путей у детей"
Автор:
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Педиатрия/Неонатология, Семейная медицина/Терапия
Просмотров: 5 617
Дата проведения: с 07.10.2014 по 07.10.2015
Актуальность темы.
Заболевания почек и мочевыводящих путей в последние годы все больше привлекают внимание специалистов, что в значительной степени связано с распространенностью этой патологии среди взрослых и детей, серьезностью прогноза, интенсивными поисками путей ранней диагностики, новых принципов лечения и профилактики тяжелых осложнений. Среди всех заболеваний мочевой системы доминируют именно микробно-воспалительные поражения, распространенность которых составляет 19,1 на 1000 детского населения. Успех ранней диагностики, правильно назначенной терапии в значительной степени зависит от знаний врачами основ детской нефрологии.
Общая цель
Усовершенствовать знания и умения по диагностике и лечению инфекционно-воспалительных заболеваний мочевыводящих путей у детей
Конкретные цели
На основании знаний этиологических и патогенетических факторов развития инфекционно-воспалительных поражений почек и мочевыводящих путей уметь анализировать клиническую картину, составлять план обследования, анализировать данные лабораторных и инструментальных обследований и владеть основными принципами лечения, реабилитации и профилактики инфекций мочевой системы у детей.
Содержание обучения
Теоретические вопросы
- Основные положения об инфекциях мочевой системы у детей.
- Причины развития, основные клинические проявления циститов и бессимптомной бактериурии у детей.
- Определение, этиология, патогенез, классификация и клиника пиелонефритов у детей.
- Методика объективного обследования больного с инфекцией мочевой системы.
- Основные лабораторные и инструментальные методы обследования больного с инфекцией мочевой системы.
- Основные принципы дифференциальной диагностики цистита, пиелонефрита у детей.
- Методы лечения инфекций мочевой системы (цистита, пиелонефрита) у детей.
- Профилактика и прогноз при пиелонефрите у детей.
Ориентировочная основа деятельности
Во время подготовки к занятию необходимо ознакомиться с основными теоретическими вопросами с помощью источников литературы.
Инфекции мочевыводящих путей (ИМВП) являются распространенным заболеванием у детей, уступая немногим по распространенности инфекциям верхних дыхательных путей и кишечным инфекциям.
Распространенность ИМВП колеблется от 5,6 до 27,5%. В среднем она составляет 18 случаев на 1000 детской популяции. Заболеваемость ИМВП у детей зависит от пола и возраста. На первом году жизни, преимущественно в первые 3 мес., ИМВП чаще развиваются у мальчиков (3,7 %), чем у девочек (2 %); в дальнейшем эти показатели меняются и составляют 3 % у девочек и 1,1 % у мальчиков. ИМВП служат самой частой причиной лихорадки неясного генеза у мальчиков в возрасте до 3 лет. Клинические проявления ИМВП у грудных детей и детей раннего возраста могут варьировать от лихорадки до симптомов со стороны желудочно-кишечного тракта (ЖКТ), а также симптомов со стороны верхних и нижних отделов МВП.
Мочевыделительная система – самый частый источник инфекции у детей. ИМВП являются наиболее распространенными бактериальными инфекциями у детей в возрасте до 2 лет. Исходы ИМВП обычно благоприятные, но на первом году жизни они могут прогрессировать в склероз почек, особенно при наличии врожденных аномалий МВП. Отдаленные последствия, связанные со склерозом почек, включают в себя артериальную гипертензию, протеинурию, нарушение функции почек вплоть до развития хронической почечной недостаточности, требующей проведения диализа у значительного числа взрослых.
Риск ИМВП в течение первых 10 лет жизни составляет 1 % для мальчиков и 3 % для девочек. За период обучения в школе предположительно 5 % девочек и до 0,5 % мальчиков переносят как минимум 1 эпизод ИМВП.
Частота бессимптомной бактериурии составляет 0,7-3,4 % у новорожденных, 0,7—1,3 % — у детей до 3 мес. и 0,2-0,8 % — у мальчиков и девочек дошкольного возраста. Распространенность бактериурии, сопровождающейся клиническими симптомами, составляет 0,14 % у новорожденных и затем увеличивается до 0,7 % у мальчиков и до 2,8 % у девочек в возрасте до 6 мес. Общая частота рецидивов ИМВП составляет 25-55 %.
Этиология
Наиболее частыми возбудителями ИМВП у детей являются грамотрицательные бактерии, главным образом кишечной группы. Из них E. coli (кишечная палочка) ответственна за развитие 90 % всех эпизодов ИМВП. Грамположительные микроорганизмы (в частности, энтерококки и стафилококки) выделяются в 5—7 % случаев.
Нозокомиальные инфекции характеризуются широким спектром агрессивных возбудителей, таких как Klebsiella, Serratia и Pseudomonas spp.
Стрептококки групп А и В относительно часто встречаются среди возбудителей ИМВП у новорожденных.
Для развития воспалительного процесса в мочевыводящих путях необходимы следующие факторы:
- способность микроорганизма к адгезии
- вирулентность
- наличие фимбрий
- способность микроорганизма вырабатывать факторы, повреждающие эпителий мочевыводящих путей.
Штаммы E.coli являются ведущим этиологическим фактором в силу своих особенностей строения, которые позволяют успешно бороться с защитными силами организма. На поверхности E.coli находятся Р-фимбрии (пили), при помощи которых бактерии прикрепляются к клеткам уроэпителия. Капсулярные антигены (К-АГ) способствуют подавлению опсонизации, фагоцитоза и комплиментзависимой бактерицидной активности иммунной системы. Эндоплазматические антигены (О-АГ) вызывают эндотоксический эффект, способствующий снижению перистальтической активности гладкой мускулатуры мочевых путей вплоть до полной ее блокады. В число уропатогенных включены штаммы кишечной палочки, обладающие антигенами О2, О6, О75, О4, О1. Серогруппы О2 и О6 считаются наиболее частыми возбудителями хронического рецидивирующего пиелонефрита.
Персистированию инфекции способствует существование безоболочечных форм возбудителей (L-форм и протопластов), которые не выявляются при обычном посеве мочи, а патогенные свойства и лекарственную резистентность сохраняют. При благоприятных формах они могут переходить в активные формы. К факторам, поддерживающим жизнедеятельность бактерий относят высокую осмолярность и концентрацию мочевины и солей аммония в мозговом слое почки, низкую резистентность паренхимы почек к инфекции.
Шифр по МКБ-10:
N10 Острый тубулоинтерстициальный нефрит
N11 Хронический тубулоинтерстициальный нефрит
N11.0 Необструктивный хронический пиелонефрит, связанный с рефлюксом
N11.1 Хронический обструктивный пиелонефрит
N11.8 Другие хронические тубулоинтерстициальные нефриты
N11.9 Хронический тубулоинтерстициальный нефрит неуточненный
N12 Тубулоинтерстициальный нефрит неуточненный, как острый и хронический
N13 Обструктивная уропатия и рефлюкс-уропатия
N30 Цистит
N30.0 Острый цистит
N39.0 Инфекция мочевыводящих путей без уточненной локализации
Определение и классификация.
Инфекции мочевых путей (ИМП) у детей – группа заболеваний инфекционно – воспалительного происхождения одного или нескольких сегментов мочевого тракта от периренальнои фасции к наружному отверстию уретры без конкретной локализации патологического процесса. По мнению экспертов ВОЗ, первичная, неосложненная и относительно быстро проходящая манифестация ИМП не требует проведения специальных методов исследования. Однако при повторении эпизода ИМП пациент должен обязательно пройти полное клиническое обследование для установления топического диагноза. ИМП у детей может протекать в виде клинически значимой самостоятельной инфекции, которая имеет конкретную клиническую картину, и асимптоматической (асимптомное) бактериурии. Диагноз ИМП у ребенка устанавливается при наличии клинических проявлений заболевания и по данным бактериологического исследования мочи. Речь идет о бактериурии, если в моче, взятой из средней порции при естественном мочеиспускании, бактериурия составляет 104-5 и более КОЕ в 1 мл, или в моче, полученной при катетеризации мочевого пузыря, – 103 и более КОЕ в 1 мл, или в моче, полученной способом надлобковой пункции – любое количество микробных тел в 1 мл.
Диагноз асимптоматической бактериурии (АБУ) в качестве самостоятельного правомочен, если у ребенка нет никаких симптомов заболевания, а степень бактериурии при каждом из вышеописанных способов забора мочи аналогичная, как и при ИМП.
ИМВП у детей можно классифицировать как первый эпизод или рецидив, а также по степени тяжести (нетяжелые и тяжелые).
Рецидивирующие инфекции мочевыводящих путей подразделяют на 3 группы:
- Неразрешившаяся инфекция: субоптимальные дозы антибиотиков, несоблюдение режима лечения, синдром мальабсорбции, резистентные возбудители.
- Персистирование возбудителя: может быть обусловлено формированием очага персистирующей инфекции в МВП; может потребоваться хирургическое вмешательство или медикаментозное лечение для устранения нарушенной функции.
- Реинфекция: каждый эпизод представляет собой новое инфицирование представителями микрофлоры периуретрального пространства, промежности или прямой кишки.
С клинической точки зрения ИМВП следует разделять на нетяжелые и тяжелые, поскольку тяжесть симптомов до известной степени определяет срочность и объем необходимого обследования и лечения (табл. 1).
Таблица 1.
Клиническая классификация ИМВП у детей
|
Тяжелые ИМВП |
Нетяжелые ИМВП |
|
Лихорадка > 39 °С |
Небольшое повышение температуры тела |
|
Упорная рвота |
Сохранена возможность приема жидкости внутрь |
|
Сепсис |
Активация воспалительного процесса, обусловленная инфекцией |
|
Выраженная дегидратация |
Незначительная дегидратация |
Тяжелые инфекции мочевыводящих путей
Для тяжелых ИМВП характерны наличие лихорадки (> 39 °С), плохое общее самочувствие, упорная рвота и умеренная или выраженная дегидратация.
Нетяжелые инфекции мочевыводящих путей
У ребенка с нетяжелой ИМВП может наблюдаться только небольшое повышение температуры тела, при этом он может пить и принимать лекарства внутрь. Дегидратация отсутствует или выражена незначительно. Ребенок готов соблюдать режим лечения.
В зависимости от основного критерия, который положен в основу деления всей совокупности ИМП на группы, выделяют:
Табл.2
|
По локализации |
Условия развития ИМВП |
По органной принадлежности |
В зависимости от клинических проявлений |
По характеру клинического течения ИМВП |
В зависимости от вида возбудителя |
|
•инфекции верхних мочевых путей (острый и хронический пиелонефрит) •инфекции нижних мочевых путей (цистит, уретрит)
|
|
•пиелонефриты
•циститы
•уретриты |
•бессимптомные
•симптоматические
|
• спорадические
•рецидивирующие |
•бактериальные
•вирусные
•микотические
•невыясненной этиологии |
Цистит – неспецифическое микробное воспаление слизистой оболочки мочевого пузыря. Различают острый и хронический цистит.
Пиелонефрит (ПН) – неспецифическое микробное воспаление почки с преимущественным очаговым повреждением тубулоинтерстициальной ткани, чашечек и лоханок.
Табл.3
КЛАССИФИКАЦИЯ ПИЕЛОНЕФРИТА У ДЕТЕЙ
|
По форме
|
По течению
|
По активности |
По функции почек
|
|
1.Первичный
2.Вторичный:
– обструктивный
– необструктивный
– дисметаболический
|
1.Острый
2.Хронический:
– рецидивирующий
– латентный
|
1.Активная стадия
2.Клинико-лабораторная ремиссия:
|
1.Сохранена
2.Нарушена
3. ХПН
|
ПН считается острым при продолжительности его течения до 3 месяцев.
Рецидив ПН документируется при наличии, кроме клинико-лабораторных симптомов, того же возбудителя, что и при предыдущем эпизоде заболевания, и может быть представлен незаконченной инфекцией (нерациональное лечение, резистентный к антибиотику возбудитель) или персистенцией (обособленный очаг бактериовыделения). Выявление нового возбудителя при бактериологическом исследовании мочи свидетельствует о реинфекции. По состоянию уродинамики выделяют: первичный процесс, когда при использовании современных методов диагностики не удается определить причины фиксации микроорганизмов в тубулоинтерстициальной ткани почек и вторичный, когда известны факторы, способствующие развитию воспалительного процесса. Среди вторичных ПН различают – обструктивный тип (развивается при наличии органической или функциональной обструкции) и необструктивный (при дисметаболических нефропатиях, иммунодефицитных состояниях, почечном дизембриогенезе т.п.). Обструкция мочевых путей имеет функциональный характер при нейрогенных расстройствах мочеиспускания, пузырно-мочеточниковом рефлюксе, врожденных нервно-мышечных дефектах лоханочно-мочеточникового соединения, мочеточников, мочевого пузыря; органический характер при аномалиях мочевой системы (синдром Фролея, гидронефроз, уретерогидронефроз, мегауретер), внутрипузырных обструкциях (контрактура шейки мочевого пузыря, клапаны, дивертикулы, стеноз мочеиспускательного канала), в результате травм, при сжатии опухолями, конкрементами.
Табл.4
Степень активности ПН
|
Признак |
Степень активности |
||
|
1 |
2 |
3 |
|
|
Температура тела |
нормальная, субфебрильная |
< 38,5 °С |
°С |
|
Интоксикация |
незначительная |
умеренная |
значительная |
|
Лейкоцитоз, х 10 9 |
< 10 |
11-14 |
|
|
СОЭ, мм/час. |
< 15 |
16-24 |
|
|
С-реактивный белок |
-/ |
||
|
В-лимфоциты, % |
< 30 |
31-40 |
|
|
ЦИК, у.е. |
< 0,095 |
0,096-0,20 |
|
Патогенез и факторы риска
МВП представляют собой стерильное пространство с непроницаемой внутренней выстилкой. Микроорганизмы могут поступать в мочевыводящую систему тремя путями:
- гематогенным
- лимфогенным
- восходящим
Самым частым механизмом развития инфекций является ретроградное восходящее проникновение возбудителей. Нозокомиальное инфицирование и вовлечение МВП в процесс в результате системной инфекции (гематогенный и лимфогенный пути) встречаются реже.
Наиболее частыми причинами ИМВП у детей служат обструкция и функциональные нарушения МВП.
Развитию ИМВП может способствовать широкий спектр врожденных аномалий, приводящих к обструкции МВП, таких как клапаны уретры, обструкции лоханочно-мочеточникового сегмента или необструктивный застой мочи. К не менее значимым причинам ИМВП относятся сращение половых губ, фимоз и хронический запор.
Функциональные нарушения мочеиспускания у практически здоровых детей могут сопровождаться редким опорожнением мочевого пузыря, которому способствуют такие привычные действия, как сидение со скрещенными ногами и сидение на корточках. Нейрогенная дисфункция мочевого пузыря (при spina bifida, диссинергии сфинктера мочевого пузыря и др.) может способствовать скоплению остаточной мочи в мочевом пузыре и вторичному ПМР.
Для развития пиелонефрита необходимы такие компоненты, как пузырно-мочеточниковый рефлюкс, внутрипочечный рефлюкс и инфекция мочевыводящих путей. Все эти факторы должны воздействовать одновременно в раннем детском возрасте, когда растущая почка особенно чувствительна к инфекциям паренхимы. В более позднем возрасте наличие бактериурии, по-видимому, не имеет отношения к прогрессированию существующих или появлению новых склеротических изменений в почках. Еще одним вмешивающимся фактором является то, что многие так называемые «почечные рубцы» представляют собой дисплазию почечной ткани, которая развивается еще во внутриутробном периоде. Этапы патогенеза пиелонефрита представлены в таблице 5.
Таблица 5.
Ведущие факторы риска развития пиелонефрита у детей в соответствии с этапами его патогенеза
|
Этапы патогенеза пиелонефрита |
Результат действия факторов риска |
Группы факторов риска развития пиелонефрита
|
|
|
Эндогенные факторы |
Экзогенные факторы |
||
|
Пребывание уропатогенов в исходном биотопе (преморбидный этап) |
Снижение колонизационной резистентности и появление источника уропатогенов |
Дисбиоз (дисбактериоз) кишечника Новорожденность, недоношенность Острая и хроническая патология (в том числе ОКИ, ОРВИ болезни печени и ЖКТ) Первичные и вторичные иммунодефицитные состояния |
Контакты с потенциальными уропатогенами (в т.ч. внутриутробный контакт)
Искусственное вскармливание детей Антибиотико- и химиотерапия Экополютанты с иммунодепрессивным действием |
|
Миграция уропатогенов в почки (этап транслокации) |
Интенсификация процесса транслокации уропатогенов, развитие бактериемии и инфицирования почек |
Дисбиоз (дисбактериоз) кишечника Острая и хроническая патология (в том числе ОKИ, ОРВИ, болезни печени и ЖKТ) Иммунодефицитные состояния (в том числе при онкопатологии и эндокринопатиях) |
Острые и хронические стрессовые воздействия (в том числе переохлаждения, травмы) Экополютанты с иммунодепрессивным действием Антибиотико- и химиотерапия |
|
Заселение уропатогенами почек (этап колонизации) |
Облегчение фиксации уропатогенов в почках |
Наличие рецепторов на уроэпителии Иммунодефицитные состояния (главным образом, связанные с дефицитом sIgА) Морфофункциональные нарушения уродинамики (АОМС, ПМР, НДМП, МКБ) |
Тератогенные факторы при беременности
Острые и хронические стрессовые воздействия
Нарушения диеты, ведущие к повышению экскреции кальция, оксалатов и уратов |
|
Инициация воспалительного процесса в почках (этап альтерации) |
Потенцирование и модифицирование воспалительного процесса в почках |
ТИН различной этиологии Уропатии, рефлюкс-нефропатии, дисметаболическая нефропатия, нефролитиаз Гипопластическая дисплазия почек иммунодефицитные состояния |
Хронические стрессовые воздействия Экополютанты с иммунодепрессивным и нефротоксическим действием |
|
Элиминация уропатогенов из почек (этап санации) или персистенция уропатогенов в почках (этап персистенции) |
Снижение эффективности механизмов саногенеза и формирование условий для персистенции уропатогенов в почках |
Иммунодефицитные состояния (в том числе связанные с дефицитом sIgА) Нарушения гемо- и уродинамики в почках (в том числе связанные с нефросклерозом) |
Экополютанты с нефротоксическим и иммунодепрессивным действием Антибиотико- и химиотерапия |
|
Примечание. ОКИ – острые кишечные инфекции; ОРВИ – острые респираторные вирусные инфекции; ЖКТ – желудочно-кишечный тракт; АОМС – аномалии органов мочевой системы; ПМР – пузырно-мочеточниковый рефлюкс; НДМП – неврогенная дисфункция мочевого пузыря; МКБ мочекаменная болезнь; ТИН – тубуло-интерстициальный нефрит. |
|||
ПАТОМОРФОЛОГИЯ
Поражение почек при остром пиелонефрите характеризуется очаговыми признаками воспаления интерстициальной ткани с деструкцией канальцев:
- интерстициальным отеком стромы;
- нейтрофильной инфильтрацией мозгового вещества почки;
- периваскулярной лимфогистиоцитарной инфильтрацией.
Наиболее характерными признаками хронического пиелонефрита являются:
- соединительнотканные разрастания (рубцы);
- лимфоидные и гистиоцитарные инфильтраты в интерстиции;
- участки расширения канальцев, часть из которых заполнена коллоидными массами («тиреоидоподобная» трансформация канальцев)
После перенесенного острого пиелонефрита сморщивания почки не происходит, поскольку развитие рубцовых изменений носит не диффузный, а очаговый характер. При хроническом пиелонефрите в терминальных стадиях поверхность почки неровная, имеются множественные рубцовые втяжения, Корковый слой истончен, неровный.
Важнейший признак, позволяющий дифференцировать пиелонефрит от других тубулоинтерстициальных поражений почек – обязательное вовлечение в процесс чашечно-лоханочной системы почек.
Проявления и симптомы
Наиболее подвержена инфицированию мочевая система новорожденных и детей раннего возраста (первых 2 лет жизни). Это связано с анатомо-физиологическими особенностями (внутрипочечным расположением лоханок, извитыми и гипотоничными мочеточниками, незрелостью их нервно-мышечного аппарата) и физиологическим иммунодефицитным состоянием, характерным для данного возраста.
В клинической картине ИМВП выделяют 3 ведущих синдрома:
- интоксикационный
- болевой
- дизурический
При поражении верхних отделов мочевой системы (пиелонефрит) ведущим является интоксикационный синдром, в то время как для инфекций нижних отделов (цистит) – дизурический.
Симптомы ИМВП у детей неспецифичны и могут отличаться в зависимости от возраста и степени тяжести заболевания.
В клинической картине ИМС у новорожденных и детей раннего возраста преобладают неспецифические симптомы интоксикации: лихорадка, бледность или мраморность кожных покровов, вялость, снижение аппетита, рвота и срыгивание, недостаточная прибавка массы или ее потеря, диарея. Единственным симптомом ИМС у детей раннего возраста (особенно у новорожденных и первого года жизни) может быть повышение температуры (лихорадка). Редко ИМВП может проявляться септическим шоком
Эквивалентом дизурий у детей первого года жизни могут быть беспокойство или плач во время и после мочеиспускания, покраснение лица, кряхтенье, мочеиспускание малыми порциями, слабость, прерывистость струи мочи.
Начиная с 2-х летнего возраста у детей наряду с симптомами интоксикации выявляются локальные симптомы: боли в животе и поясничной области, болезненность в реберно-позвоночном углу при поколачивании и пальпации, болезненность в надлобковой области и дизурия.
Клинические признаки цистита
• Учащенное болезненное мочеиспускание малыми порциями
(дизурии).
• Болезненность при пальпации в надлобковой области.
• Недержание мочи.
• Субфебрильная или нормальная температура.
• Лейкоцитурия.
• Бактериурия.
Клинические признаки пиелонефрита
• Преимущественно фебрильная температура (38°С и выше).
• Боли в поясничной области, животе.
• Симптомы интоксикации (бледность, вялость, снижение аппетита, головная боль, рвота).
• Лейкоцитурия.
• Бактериурия.
• Протеинурия (незначительная или умеренная, как правило, не превышающая 1 г/сут).
• Нарушение процесса концентрирования мочи, особенно в острый период.
• Нейтрофильный лейкоцитоз со сдвигом влево.
• Увеличение СОЭ (более 20 мм/ч).
• Высокий уровень СРБ и прокальцитонина.
Табл.6
Особенности клинической картины пиелонефрита у детей раннего и старшего возраста
|
Признаки
|
Дети первого года жизни
|
Дети старшего возраста
|
|
Дебют заболевания
|
Преобладают симптомы общеинфекционного характера |
Синтез симптомов общеинфекционного характера, болевого и дизурического |
|
Симптомы интоксикации |
Выраженные, вплоть до нейротоксикоза |
Зависят от характера течения, возраста, наличия обструкции |
|
Менингеальные знаки |
Возможны |
Крайне редки |
|
Лихорадка
|
Фебрильная, реже субфебрильная, возможны беспричинные подъемы температуры |
Фебрильная, реже субфебрильная, часто беспричинные подъемы температуры |
|
Срыгивания, рвота
|
Частые срыгивания, возможна рвота |
Рвота при выраженной интоксикации
|
|
Боли в животе, поясничной области |
Эквивалент боли – беспокойство
|
Присутствуют
|
|
Нарушения мочеотделения |
Учащенное или редкое, вплоть до полной задержки мочи |
Недержание мочи, ускоренное, болезненное |
|
Кишечный синдром
|
Нередко, чаще в дебюте заболевания |
Редко |
|
Гепатолиенальный синдром |
У 1/3 детей |
Редко |
Диагностика
Стандарты диагностики.
1 Лабораторные исследования.
А. Обязательные:
– Анализ крови клинический;
– Анализ крови биохимический с определением уровня креатинина, мочевины;
– Общий анализ мочи;
– Анализ мочи по Нечипоренко;
– Анализ мочи по Зимницкому;
– Бактериологическое исследование мочи;
– Для девушек – мазок из влагалища.
Б. Уточняющие:
– Скорость клубочковой фильтрации;
– Определение суточной протеинурии или микроальбуминурии;
– Бактериологическое исследование мочи с определением микробного числа и чувствительности микрофлоры к антибактериальным препаратам;
– Исследования на энтеробиоз;
– Анализ кала на дисбиоз.
2 Инструментальные исследования.
А. Обязательные:
– Термометрия;
– Контроль артериального давления;
– УЗИ мочевых системы;
– Экскреторная урография, КТ, МРТ;
– Микционная цистография;
– Динамическая и статическая реносцинтиграфию (при хроническом процессе).
Б. Вспомогательные:
– Экскреторная урография;
– Цистоуретероскопия;
– Функциональные исследования мочевого пузыря (при необходимости);
– Допплерография сосудов почек;
– Суточный мониторинг артериального давления;
– Ангиография сосудов почек (при необходимости);
– Компьютерная томография почек (при необходимости);
– Магнитно-резонансное исследование почек (при необходимости).
3 Консультации специалистов: гинеколога, уролога, оториноларинголога, при необходимости – других.
Лабораторные тесты
Для подтверждения диагноза ИМВП у детей необходимо получение положительного результата культурального исследования мочи. Для бактериологического исследования образец мочи следует собирать с соблюдением соответствующих условий. Положительным результатом считается наличие в моче уропатогена в концентрации > 104-5КОЕ/мл. У детей в возрасте до 4 лет сбор мочи может оказаться затруднительным, поэтому, учитывая наличие высокого риска контаминации образца, предлагаются различные методы взятия материала.
Количественная оценка бактериурии
Конечное количество бактерий в моче напрямую зависит от метода ее сбора, диуреза, условий хранения и транспортировки образца. Клинически значимой бактериурией по-прежнему считается количество уропатогена > 104-5 КОЕ/мл и зависит от клинической ситуации.
Наличие пиурии (> 5 лейкоцитов в поле зрения у мальчиков и > 8 лейкоцитов у девочек) и бактериурии в свежем образце мочи подтверждает клинический диагноз ИМВП.
Табл 7.
Критерии ИМВП у детей
|
Образец мочи, полученный при надлобковой пункции мочевого пузыря |
Образец мочи, полученный при катетеризации мочевого пузыря |
Моча, полученная при свободном мочеиспускании |
|
Любое количество КОЕ/мл (минимум 10 идентичных колоний) |
—50 000 КОЕ/мл |
4 КОЕ/мл при наличии клинических симптомов 5 КОЕ/мл при отсутствии клинических симптомов |
Другие биохимические маркеры
Наличие некоторых биохимических маркеров в образце мочи позволяет установить диагноз ИМВП. Наиболее часто используемыми маркерами являются нитриты и эстераза лейкоцитов, которые обычно определяются вместе при помощи тест-полосок.
Нитриты
Нитриты являются продуктом разрушения нитратов в результате метаболизма бактерий, в частности грамотрицательных микроорганизмов. При ИМВП, вызванных грамположительными бактериями, этот тест может быть отрицательным. Тест на определение нитритов имеет следующие ограничения:
- не все уропатогены восстанавливают нитраты до нитритов (например, P.aeruginosa, энтерококки);
- даже при наличии нитритпродуцирующих микроорганизмов результаты теста могут быть отрицательными из-за короткого времени нахождения мочи в мочевом пузыре при высоком диурезе и разведении мочи (например, у новорожденных). Тест на определение в моче нитритов обладает небольшой чувствительностью — всего 45—60%, но при этом характеризуется высокой специфичностью — 85—98%.
Лейкоцитарная эстераза
Эстераза лейкоцитов вырабатывается лейкоцитами. Тест на определение эстеразы лейкоцитов обладает чувствительностью 48—86% и специфичностью 17—93% Комбинация тестов на определение нитритов и эстеразы лейкоцитов повышает чувствительность и специфичность, однако сопряжена с риском получения ложноположительных результатов. Анализ мочи с помощью тест-полосок позволяет быстро и надежно исключить ИМВП при условии отрицательных результатах тестов на определение нитритов и эстеразы лейкоцитов. При положительных результатах последних 2 тестов их лучше подтвердить в сочетании с клиническими симптомами и данными других тестов.
С-реактивный белок
Несмотря на неспецифичность, определение С-реактивного белка у детей с лихорадкой и бактериурией помогает провести дифференциальную диагностику между пиелонефритом и другими причинами бактериурии. Клинически значимым считается повышение этого показателя > 20 мкг/мл.
N-ацетил-β-глюкозаминидаза мочи
Данный показатель является маркером повреждения почечных канальцев. Уровень N-ацетил-β-глюкозаминидазы повышается при ИМВП, сопровождающейся лихорадкой, и может быть надежным тестом для диагностики ИМВП, несмотря на то что он также повышается и при ПМР.
Методы визуализации мочевыводящих путей
Чтобы считаться «золотым стандартом», метод визуализации должен быть экономически оправданным, безболезненным, безопасным, с минимальным или отсутствием облучения и способным выявлять любые значимые структурные аномалии. Существующие методы визуализации не соответствуют всем указанным требованиям.
Ультразвуковое исследование
Благодаря своей безопасности, быстроте проведения и высокой точности УЗИ широко используется у детей для выявления структуры и размеров паренхимы и собирательной системы почек. Этот метод исследования является субъективным (не дает информации о функции почек) и тем самым зависит от квалификации выполняющего его специалиста. Тем не менее УЗИ позволяет выявлять склеротические изменения в почках, хотя и не так хорошо, как сканирование с димеркаптоянтарной кислотой, меченой технецием (технеций99m DMSA). Показано, что УЗИ является очень чувствительным методом исследования, поэтому экскреторная урография должна быть методом «резерва» и применяться только в тех случаях, когда полученные при УЗИ снимки требуют уточнений структуры.
Радионуклидные исследования
Технеций99m DMSA представляет собой радиофармпрепарат, который связывается с базальной мембраной клеток проксимальных почечных канальцев; половина введенной дозы определяется в корковом веществе почек спустя 6 ч. Этот метод позволяет выявить функционирующую почечную ткань и поставить точный диагноз склероза коркового вещества (участки сниженного накопления радиофармпрепарата укажут на потерю функции). ИМВП влияет на захват технеция99m DMSA клетками проксимальных почечных канальцев, что выглядит как очаговые дефекты накопления в почечной паренхиме. Дефекты накопления в форме звезды в паренхиме почек могут указывать на острый пиелонефрит. Очаговые дефекты накопления в корковом веществе обычно говорят о хроническом поражении или участке склероза.
Очаги склероза или равномерное снижение накопления (уменьшение почечной паренхимы) при сканировании с технецием99m DMSA принято считать признаком ПМР (рефлюкс-нефропатия).
Сканирование с технецием99m DMSA может помогать в ранней диагностике острого пиелонефрита. На первой неделе заболевания характерные изменения обнаруживаются приблизительно у 50—85 % детей. Минимальные дефекты накопления в паренхиме, т. е. очаги незначительно сниженной функциональной активности почечной ткани, могут исчезать после проведения антимикробной терапии. Однако дефекты накопления, сохраняющиеся > 5 мес., следует считать очагами склероза.
Сканирование с технецием99m DMSA считается более чувствительным методом выявления склеротических изменений в почках, чем экскреторная урография или УЗИ
Цистография
Традиционная микционная цистография
Микционная цистография (МЦ) является наиболее широко используемым методом рентгенологического исследования нижних отделов МВП, особенно при наличии ПМР. Этот метод считается обязательным в плане обследования у детей до 1 года с ИМВП. Основными недостатками МЦ служат риск инфицирования, необходимость ретроградного заполнения мочевого пузыря и возможное неблагоприятное влияние лучевой нагрузки на ребенка.
В последние годы с целью уменьшения такой нагрузки для диагностики ПМР у девочек стали применять специально разработанный вариант МЦ с использованием низкой дозы флюоресцирующих красителей. МЦ является обязательным методом исследования у детей с ИМВП и лихорадкой, даже при отсутствии изменений на УЗИ, только после купирования атаки пиелонефрита, при повторной плановой госпитализации. У 23% таких детей выявляют ПМР.
Радионуклидная (непрямая) цистография
Этот метод исследования является частью динамической нефросцинтиграфии и проводится путем увеличения периода сканирования после введения меченого технецием диэтилентриаминпентаацетата (ДТПА) или меркаптоацетилтриглицина (МАГ-3). Благодаря меньшей лучевой нагрузке такой метод представляет собой хорошую альтернативу традиционной цистографии, особенно при наблюдении пациентов с рефлюксом. Недостатком метода является низкое разрешение снимков и затруднения при выявлении нарушений со стороны нижних отделов МВП.
Ультразвуковое исследование мочевого пузыря
УЗИ мочевого пузыря с использованием контрастных веществ, проводимое во время мочеиспускания, было предложено как метод диагностики ПМР, не сопровождающийся лучевой нагрузкой. Для определения роли этого нового метода в диагностике ИМВП необходимо проведение дополнительных исследований.
Дополнительные методы визуализации
Экскреторная урография остается ценным методом оценки состояния МВП у детей, однако ее применение при ИМВП остается спорным, кроме тех случаев, когда предыдущее обследование выявило какие-либо изменения, требующие дальнейшего исследования. Основными недостатками этого метода у детей служат риск развития нежелательных лекарственных реакций, связанных с применением контрастного вещества, и лучевая нагрузка. По мере технического усовершенствования КТ и МРТ роль экскреторной урографии снижается, однако показания для применения этих методов при ИМВП пока тоже остаются ограниченными.
Уродинамическое исследование
При подозрении на нарушения мочеиспускания (например, недержание мочи, наличие остаточной мочи, утолщение стенок мочевого пузыря) следует рассмотреть вопрос о проведении уродинамического исследования с урофлоуметрией, видеоцистометрией, включая исследования по измерению давления потока и электромиографию.
План обследования
Максимум после 2-го эпизода ИМВП у девочек и первого эпизода ИМВП у мальчиков необходимо проводить комплексное обследование (рис. 1.), однако это не относится к случаям бессимптомной бактериурии. Необходимость проведения сканирования с ДТПА/ МАГ-3 определяется результатами УЗИ, в частности при подозрении на наличие обструкции.
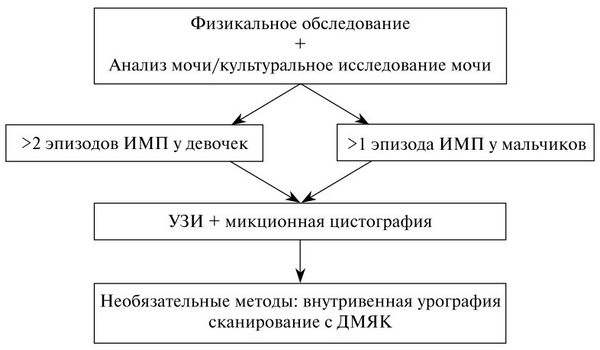
Рис. 1. План обследования ребенка с ИМВП
Табл.8
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
|
|
Острый пиелонефрит |
Острый гломерулонефрит |
|
Связь с интеркуррентным заболеванием |
в острый период бактериального или вирусного заболевания |
через 2-3 нед. после стрептококковой инфекции |
|
Температура тела |
постоянная или интермиттирующая лихорадка выше 380С, нередко «беспричинная» |
на фоне нормальной температуры тела |
|
Дизурические проявления |
как правило |
не характерны |
|
Отеки или пастозность тканей, артериальная гипертензия |
не характерны |
у большинства больных |
|
Общий анализ мочи |
значительная бактериурия, лейкоцитурия (больше 50% нейтрофилов), лейкоцитарные цилиндры, протеинурия менее 1 г/л
|
протеинурия более 1 г/л, гематурия, цилиндрурия. Количество лейкоцитов незначительно, преимущественно лимфоциты. Бактериурия отсутствует. |
|
Анализ мочи по Зимницкому |
без изменений |
снижение концентрационной способности почек |
|
Клиренс креатинина |
нормальный |
пониженный |
Лечение
Лечение ИМВП у детей имеет 4 основные цели.
1. Устранение симптомов заболевания и эрадикация возбудителя при остром эпизоде.
2. Профилактика склеротических изменений в почках.
3. Профилактика рецидивов ИМВП.
4. Коррекция сопутствующих урологических нарушений.
Лечение цистита.
Первый эпизод цистита у детей – противомикробная терапия 5 суток (препараты первого выбора – фуразидин, нитрофурантоин, сульфаметаксозол/триметроприм или цефалоспорины III генерации). Возможна профилактическая терапия у девочек 1-3 месяца одним из перечисленных препаратов. При рецидиве цистита консультация гинеколога или уролога, микционная цистограма, уретроцистоскопия, определение следующих возбудителей (Ig Ureapl. Urealiticum, Chlamid. Trachomatis, Mycoplasma Genitalium, Hominis и Trichom. Vaginalis.) Лечение 7 суток уроантисептиком или 5 суток цефалоспорином III генерации, затем профилактическое лечение.
Сопутствующая терапия (при хроническом цистите) – инстилляции мочевого пузыря: 3-15% диметилсульфоксид антисептик; 50% декаметоксин, гидроксиметилхиноксалиндиоксид, 2% раствор коллоидного серебра (под контролем индивидуальной переносимости препарата). При установлении атипичной этиологии цистита препаратами первого выбора являются макролиды.
Лечение бессимптомной бактериурии
Азитромицин – однократно, амоксициллин / клавуланат (при кокковой флоре) или нитрофураны – 7 дней; неоконченная инфекция или персистенция – согласно антибиотикограммы с учетом необходимости инстилляций мочевого пузыря.
Лечение ИМВП без определения топики.
7 дней цефалоспорины II-III поколения. Обструкция и дисфункция мочевого пузыря должны быть диагностированы (исключены) специалистом. При наличии энуреза показано назначение антидиуретического гормона.
Лечение пиелонефрита
1 Диетотерапия: стол 5, при нарушении функции почек – стол 7а, 7 Ограничение соли – при наличии нарушения функции почек и / или артериальной гипертензии. Ограничение мяса – при нарушении функции почек.
2 Употребление жидкости. Рекомендуется водная нагрузка из расчета 25-50 мл / кг / сут (достаточность питьевого режима оценивается по величине диуреза – 1,5-2 л) под контролем своевременного опорожнения мочевого пузыря (не реже 1 раза в 2-3 часа). Прием жидкости может ограничиваться при нарушении функции почек, артериальной гипертензии, обструктивной уропатии. Питьевой режим включает чай, щелочную минеральную воду, чистую воду, компоты (из сухофруктов). При щелочной реакции мочи показано увеличение кислых валентностей – морсы, напитки из клюквы, брусники.
2. Этиотропная терапия
Позднее начало адекватной антимикробной терапии у детей с ИМС ведет к серьезным последствиям: повреждению паренхимы почки (с возможным формированием участков сморщивания) и вероятности уросепсиса. Антимикробная терапия, назначенная детям с лихорадкой и подозрением на ИМС в первые 24 ч болезни, позволяет полностью избежать очаговых дефектов в паренхиме почки. Начало лечения в более поздние сроки (2–5 сут) приводит к появлению дефектов паренхимы у 30–40% детей.
Первоначальный выбор терапии ИМС основан на знании преобладающих уропатогенов у детей данной возрастной группы, предполагаемой антибактериальной чувствительности микрофлоры и клиническом статусе ребенка (табл.9). В подавляющем большинстве случаев оправдан эмпирический выбор защищенных пенициллинов, цефалоспоринов 3 поколения или аминогликозидов.
Табл. 9
Антимикробные средства, рекомендуемые для лечения пиелонефрита у детей
|
Препарат |
Чувствительность микрофлоры |
Способ введения и дозы |
|
Амоксициллин |
E. coli, Klebsiella |
Внутрь: детям до 2 лет 20 мг/кг на прием × 3-кратно; 2–5 лет 125 мг на прием × 3-кратно, 5–10 лет 250 мг на прием × 3-кратно, старше 10 лет 250–500 мг на прием × 3-кратно В/мышечно: 50 мг/кг в сутки в 2 введения |
|
Амоксициллин клавуланат (Аугментин) |
E. coli, Proteus mirabilis, Proteus vulgaris, Klebsiella |
В/в: детям первых 3 мес жизни 30 мг/кг на введение с интервалом 12 ч; детям в возрасте от 3 мес до 12 лет 30 мг/кг на введение каждые 6–8 ч; детям старше 12 лет разовая доза 1,2 г каждые 6–8 ч. Внутрь: детям младше 9 мес не назначается, детям младше 12 лет дается в виде сиропа; детям в возрасте от 9 мес до 2 лет — 2,5 мл (0,156 г/ 5 мл) на прием, от 2 до 7 лет — 5 мл (0,156 г/5 мл) на прием, от 7 до 12 лет — 10 мл (0,156 г/5 мл) на прием, старше 12 лет — 0,375 г на прием (в виде сиропа или таблеток). Прием аугментина 3-кратный |
|
Цефалексин |
E. coli |
Внутрь: детям с массой до 40 кг —25–50 мг/кг в сутки в 4 приема; более 40 кг — 250–500 мг каждые 6–12 ч |
|
Цефотаксим |
E. coli, Citrobacter, Proteus mirabilis, Klebsiella, Providencia, Serratia, Haemophilus influenzae, Pseudomonas aeruginosa |
В/м и в/в: 50–180 мг/кг в сутки в 2–6 введений |
|
Цефтриаксон |
E. coli, Citrobacter, Proteus, Klebsiella, Pseudomonas aeruginosa, Enterobacter |
В/м и в/в: новорожденным до 2 нед 20–50 мг/кг в сутки однократно; старше 2 нед — 50–100 мг/кг в сутки однократно |
|
Цефиксим |
E. coli, Proteus mirabilis, Moraxella (Branhamella) catarrhalis, N.gonorrhoeae, Haemophilus influenzae, Streptococcus pneumoniae, Streptococcus pyogenes |
Внутрь: детям от 6 мес до 12 лет 4 мг/кг каждые 12 ч. Детям старше 12 лет и массой более 50 кг 400 мг 1 раз/сут или 200 мг 2 раза/сут |
|
Гентамицин |
E. coli, Proteus, Klebsiella, Pseudomonas aeruginosa, Enterobacter
|
В/м и в/в: новорожденным и недоношенным 2–5 мг/кг в сутки в 2 введения; детям младше 2 лет —2–5 мг/кг в сутки в 2 введения, детям старше 2 лет — 3–5 мг/кг в сутки в 2 введения (допускается однократное введение суточной дозы гентамицина в/в) |
|
Амикацин |
E. coli, Klebsiella, Pseudomonas aeruginosa, Enterobacter
|
В/м и в/в: 1-я инъекция — 10 мг/кг, последующие 7,5 мг/кг (интервал введения 12 ч); допускается однократное введение суточной дозы амикацина в/в |
|
Нетромицин |
E. coli, Proteus, Klebsiella, Pseudomonas aeruginosa, Enterobacter
|
В/м и в/в: недоношенным и новорожденным младше 7 дней 6 мг/кг в сутки в 2 введения; новорожденным старше 7 дней детям до 2 лет — 7,5–9 мг/кг в сутки в 2 введения; детям старше 2 лет —6–7,5 мг/кг в сутки в 2 введения; допускается однократное введение суточной дозы нетромицина в/в |
|
Триметоприм |
E. coli, Proteus, Klebsiella |
Внутрь: 2–3 мг/кг в сутки однократно на |
|
Фуразидин (Фурамаг) |
E. coli, Proteus, Klebsiella, Enterobacter
|
Внутрь: детям старше 3 лет, 5 мг/кг в сутки в 3 приема |
|
Фосфомицина трометамол (монурал) |
E. coli, Proteus, Klebsiella, Enterobacter, Pseudomonas aeruginosa
|
Внутрь: Детям старше 2 лет 2 г фосфомицина трометамола однократно, лучше перед сном. |
|
Фуразидин (Фурагин) |
E. coli, Proteus, Klebsiella, Enterobacter
|
Внутрь: 2–3 мг/кг в сутки однократно на ночь |
Стартовая эмпирическая терапия длится 10-14 суток – цефалоспорины преимущественно III поколения (желательно с сульбактамом); «защищенные пенициллины» (амоксициллин/клавуланат, амоксициллин/сульбактам); – фторхинолоны 2-4 поколения (с 15 лет). Антибактериальная терапия проводится ступенчатым методом в стационаре (парентерально с переходом на прием препаратов (возможно – в пределах одной группы) per os после нормализации температуры), через рот – при амбулаторном лечении (с 2 месяцев жизни). При сохранении интоксикации, гипертермии, мочевого синдрома более 3 суток производят замену препарата (желательно с учетом чувствительности). К альтернативным препаратам относят – цефалоспорины IV поколения, аминогликозиды (нетромицин, амикацин, гентамицин, тобрамицин). Антибактериальные препараты резерва – карбапенемы, уреидопенициллины, гликопептиды. При сопутствующей урогенитальной инфекции используются соответствующие препараты – орнидазол, нитроимидазол, макролиды.
Длительность курса антимикробной терапии
Многочисленными исследованиями доказано, что длительность антимикробной терапии у детей с ИМС не должна быть меньше 7 дней. Оптимальная общая продолжительность лечения ИМС составляет 10–14 дней.
Оценка эффективности антибактериальной терапии
• Клиническое улучшение в течение 24–48 ч с момента начала лечения.
• Эрадикация микрофлоры (при правильно подобранном лечении моча становится стерильной через 24–48 ч).
• Уменьшение или исчезновение лейкоцитурии на 2–3-и сутки от начала лечения.
Необходимые исследования в период проведения антибактериальной терапии
• На 2–3-и сутки лечения провести микроскопию мочи. Показанием для повторного определения степени бактериурии и чувствительности микрофлоры мочи к антимикробным препаратам является отсутствие клинического улучшения в течение первых 48 ч терапии.
• После завершения антибактериальной терапии провести микроскопию мочи, назначить общий анализ крови.
Симптоматическая терапия.
Лечение дегидратации осуществляется путем водной нагрузки, дезинтоксикация – применением дезинтоксикационных препаратов. При отказе от перорального приема жидкости, признаках дегидратации, значительном интоксикационном синдроме проводится инфузионная терапия: введение 5% раствора глюкозы или физиологического раствора натрия хлорида.
При гипертермии применяются жаропонижающие – парацетамол, ибупрофен.
В случаях болевого синдрома назначаются антиспастические препараты.
При необходимости – прием про-, пре-и симбиотиков, антигистаминные и противогрибковые препараты.
Фитокомпоненты, эффективные при микробном воспалении мочевых путей: ортосифон, овес, березовые листья и почки, буквица лекарственная, бузина (корень, цветы), плоды боярышника, пастушья сумка, кукурузные рыльца, семена льна, медуница лекарственная, подорожник, спорыш, ягоды и листья земляники, василек, петрушка огородная (семена, корни), брусника, бурда, золотарник, лаванда колосковая, толокнянка обыкновенная, шишки хмеля, ягоды можжевельника, листьев черной смородины. Фитотерапия рекомендована фитониринговыми препаратами: канефрон Н, цистенал, уролесан, фитолизин, цистон.
Ингибиторы АПФ или блокаторы рецепторов ангиотензина II (БРА) назначаются при хроническом ПН для торможения склеротического процесса и антипротеинурического действия.
Профилактика рецидивов ИМС
• Соблюдать режим мочеиспускания (каждые 3 ч, не реже).
• Профилактика запоров.
• Анализ мочи ежемесячно в течение года с момента нормализации анализов мочи.
• Личная гигиена.
Основным показанием для назначения антибактериальной противорецидивной терапии являются аномалии развития мочевого тракта (прежде всего ПМР) и частые рецидивы (более одного за 6 мес).
В настоящее время для противорецидивной терапии ИМС рекомендуются следующие медикаменты.
• Фуразидин (Фурагин) (2–3 мг/кг в сутки однократно на ночь).
• Ко-тримоксазол (2 мг по триметоприму 10 мг по сульфаметоксазолу/кг в сутки однократно на ночь).
• Налидиксовая кислота (15–20 мг/кг в сутки однократно на ночь).
Длительность противорецидивной терапии, как правило, составляет не менее 3 мес.
После достижения ремиссии рекомендуется:
• информировать родителей пациента о необходимости консультации с лечащим врачом при появлении у ребенка таких симптомов, как лихорадка, дизурии, вялость, отсутствие аппетита, болей в животе;
• информировать родителей о необходимости обращать внимание на регулярность мочеиспускания (каждые 3 ч в период бодрствования ребенка), функцию кишечника (отсутствие запоров), увеличение объема потребляемой жидкости.
У детей в возрасте до 3 лет, которым трудно принимать лекарства перорально, целесообразным считается продолжение парентеральной терапии в течение 7—10 дней, что дает такие же результаты, что и пероральная терапия.
При наличии выраженных нарушений со стороны МВП (например, ПМР, обструкция) следует решить вопрос о проведении соответствующего урологического вмешательства. При выявлении склеротических изменений в почках требуется тщательное наблюдение пациента педиатром для своевременного обнаружения таких последствий, как артериальная гипертензия, нарушение функции почек и рецидивирующие ИМВП.
ЛИТЕРАТУРА
- Нефрология: учебное пособие для послевузовского образования/ под ред.Ю.М.Шилова.- М: ГЭОТАР-Медиа, 2007. – 688с.
- Оказание стационарной помощи детям. Карманный справочник. – Европа. -2006.
- Пропедевтика детских болезней/Под ред.Геппе Н.А., Подчерняевой Н.С.: учебник для студентов медицинских вузов. – М: ГЭОТАР-Медиа, 2008. – 464с.: ил.
- Педиатрия. Национальное руководство. Краткое издание / под ред. А. А. Баранова. — М. : ГЭОТАР-Медиа, 2014. — 768 с. : ил.
- Guideline on urological infections/ European Association of Urology 2011: http://www.uroweb.org/guidelines/.
- Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney inter., Suppl. 2012; 2: 279-335.






