Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ИННОВАЦИИ И ТРЕНДЫ В КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ ВАГИНАЛЬНЫХ ФОРМ ГЕСТАГЕНОВ"
Автор: Опрышко В.И., Носивец Д.С.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Акушерство и гинекология, Семейная медицина/Терапия
Просмотров: 3 196
Дата проведения:
Авторами на основании аналитического обзора отечественной и зарубежной литературы проанализированы фармакологические особенности и клиническая эффективность специальных вагинальных таблеток натурального микронизированного прогестерона. Описаны особенности лекарственных форм для вагинального введения, установлены преимущества таблеток для интравагинального введения. На основании проведенного анализа обоснована клиническая эффективность таблеток для вагинального введения.
 Ключевые слова: вагинальная лекарственная форма, фармакокинетика вагинальных лекарственных форм, биодоступность лекарственных веществ, прогестерон, таблетки.
Ключевые слова: вагинальная лекарственная форма, фармакокинетика вагинальных лекарственных форм, биодоступность лекарственных веществ, прогестерон, таблетки.
INNOVATIONS AND TRENDS IN CLINICAL PHARMACOLOGY VAGINAL FORMS PROGESTOGENS
Opryshko V. I., Nosivets D. S.
SE “Dnepropetrovsk Medical Academy Ministry of Health of Ukraine”
Abstract
The authors on the basis of an analytical review of the domestic and foreign literature reviewed pharmacological characteristics and clinical efficacy of natural progesterone tablets for vaginal administration of the drug by the example of “Luteina” production “Adamed”, Poland. The features of dosage forms for vaginal administration set benefits for intravaginal tablets. Based on the analysis proved the clinical efficacy of tablets for vaginal administration.
Keywords: vaginal dosage form, pharmacokinetics vaginal dosage forms, the bioavailability of drug substances, progesterone, tablets.
Прогестерон (П) – это прогестационный стероидный гормон, который играет огромную роль в жизни каждой женщины. От его достаточного количества зависит не только возможность возникновения беременности, но и ее благополучное течение и завершение, так как П запускает и контролирует множество биологических процессов в репродуктивной системе женщины [1-3].
Для улучшения биодоступности натурального П на сегодняшний день применяется микронизация – способ повышения растворимости с помощью уменьшения размера частиц лекарственного вещества. Эта методика реализуется с помощью сублимационной сушки, распылительной сушки, лиофильной сушки и др., которая приводит к тому, что при измельчении частиц происходит увеличение рабочей поверхности соприкосновения с водой, благодаря чему достигается ускорение процесса растворения [5, 6]. В ряде исследований установлено, что за счет изменения размеров и формы частиц лекарственных субстанций достигается не только более высокая биодоступность, но и значительно снижается частота возникновения нежелательных эффектов при приеме лекарственного средства. Экспериментально доказана и научно обоснована принципиальная значимость получения твердых дисперсий для повышения растворимости и скорости растворения лекарственного вещества [1, 3, 7, 8].
Также для повышения биодоступности вагинального П разработаны современные препараты П, в том числе гели и таблетки для интравагинального применения, так как установлено, что, чем больше концентрация П в плазме крови после вагинального приема, тем больше она и в органе мишени при применении вагинальной формы. В то же время вагинальный путь введения П имеет свою лекарственную форму – вагинальные таблетки и/или вагинальный гель, так как только эти формы П утверждены FDA для вагинального применения (по материалам http://www.accessdata.fda.gov).
В работе E. Cicinelli с соавт. (2000) при изучении концентрации П в сыворотке крови и ткани эндометрия после вагинального или внутримышечного введения препарата П установлено, что уровень П в эндометрии и сыворотке крови был заметно выше у женщин, получавших вагинальный П, по сравнению с внутримышечными инъекциями (р<0,005). Это было рандомизированное открытое исследование 14 женщин в постменопаузе, которые перенесли трансабдоминальную гистерэктомию. Женщины получали либо вагинальный П в форме геля (90 мг) или препарат П вводился внутримышечно (50 мг). Авторы пришли к выводу о том, что концентрации П в эндометрии и в сыворотке крови были выше после вагинального введения П, чем после внутримышечных инъекций, и исследователи исключили возможность «загрязнения» слизистой оболочки, взятой для гистерэктомии в результате контакта с препаратом [19].
Таким образом, исходя из вышеизложенного, в основе решения проблемы эффективного клинического применения и повышения клинической эффективности использования натурального П лежит необходимость соблюдения строгого соответствия между лекарственной формой, которую принимает пациентка, и путем введения этой лекарственной формы, что приводит в формированию оптимальных пиковых концентраций П в плазме крови.
Цель работы – обосновать эффективность применения микронизированного прогестерона для интравагинального введения на мировом и национальном уровне.
Эффективность клинического применения вагинальной формы П, как на ранних (табл. 1), так и на поздних сроках беременности (табл. 2) обусловлена, во-первых созданием высокой и стабильной концентрации препарата в плазме крови, которая обеспечивает создание физиологических концентраций на маленьких дозах препарата. Во-вторых, при использовании вагинальных форм П возникает т. н. «эффект первого прохождения П через матку», благодаря которому П оказывает влияние непосредственно на орган-мишень – матку и на ее шейку. И в-третьих, самая главная особенность вагинальной формы П, что нет эффекта прохождения через печень, что приводит к отсутствию метаболизма препарата, снижает риск побочных эффектов, одновременно повышая эффективность фармакотерапии.
Так, в исследовании R. Romero с соавт. (2012) установлено, что вагинальное введение П снижает риск преждевременных родов на 42% и неонатальной заболеваемости и смертности на 43% [13].
На XXI конгрессе FIGO (International Federation of Gynecology and Obstetrics) в 2015 г. была разработана стратегия профилактики и лечения преждевременных родов, которая основана на вагинальном назначении П в виде таблеток или вагинального геля [14].
Таблица 1. Клинические исследования, посвященные эффективности и безопасности микронизированного прогестерона для интравагинального введения на ранних сроках беременности
|
Автор |
Выборка |
Дизайн |
Схема терапии |
Критерии эффективности |
Результат |
|
Czajkowski K., Sienko J., Mogilinski M., Bros M. [et al.] 2007 |
Рандомизированное, с параллельными группами, двойное слепое плацебо-контролируемое исследование |
Сравнение влияния вагинального микронизированного прогестерона и перорального дидрогестерона на маточно-плацентарное кровообращение на ранних сроках беременности, осложненной угрозой прерывания |
53 пациентки с угрожающим абортом и живым эмбрионом |
Маточно-плацентарное кровообращение |
Прием вагинального прогестерона, в отличие от лечения пероральным дидрогестероном, привел к уменьшению ИП и ИР спиральной артерии на ранних сроках беременности, осложненной угрозой прерывания |
|
Галич С. Р. 2014 |
Клиническое исследование |
Оценка эффективности применения интравагинальной формы микронизированного прогестерона для обеспечения полноценной плацентации, течения беременности и родов у пациенток, которые перенесли передгравидарные эндоскопические операции по поводу генитального эндометриоза |
120 женщин, которым в предгравидарный период выполнено лапароскопическое удаление эндометриоидных гетеротопий по поводу внешнего генитального эндометриоза. Базисная терапия заключалась в ежедневном применении 100 мг микронизированного прогестерона интравагинально |
Течение беременности и родов |
Базовое использование интравагинально микронизированного прогестерона в дозе 100 мкг в сутки в предгравидарном периоде и в течение первого триместра беременности способствовало улучшению плацентации, снижению частоты развития гестационных и акушерских осложнений, а также улучшению перинатальных последствий у пациенток, перенесших предгравидарное хирургическое лечение наружного генитального эндометриоза. |
|
Пашковски Т. 2014 |
Клиническое исследование |
Мониторинг всех возможных нежелательных явлений и оценка переносимости природного микронизированного прогестерона, вводимого интравагинально, у пациенток с симптомами угрозы выкидыша во время первого триместра беременности |
49 пациенток • Возраст 18-40 лет. • Внутриматочная беременность, 1-й триместр. • Симптомы угрозы выкидыша. • Терапевтические показания для приема прогестерона |
Нивелирование симптоматики |
Исследование показало очень хорошую местную и системную переносимость прогестерона, вводимого в виде интравагинальных таблеток, на ранних стадиях беременности. |
В работе И.А. Жабченко (2015) представлен алгоритм лечебно-диагностических и профилактических действий при истмико-цервикальной недостаточности с использованием препарата микронизированного П, который назначается сублингвально, а затем вагинально два раза в сутки по 50-150 мг [11].
Так, в работе А.Г. Резникова (2004) доказано, что при приеме вагинальной формы П развитие головной боли снижается в 2 раза, а сонливость развивается в 6 раз реже, чем при других способах введения П, что подтверждено в работах и других исследователей [10, 15, 16].
Результаты клинических исследований, проведенных под руководством О.В. Булавенко с соавт. (2015) свидетельствуют, что применение препарата микронизированного прогестерона эффективно при лечении гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста с избыточной массой тела. Доказано, что назначение микронизированного прогестерона 80 женщинам (средний возраст составил 38,9±2,3 года), позднего репродуктивного возраста с гиперплазией эндометрия и избыточной массой тела (ИМТ – 25,16±4,66 кг/м2) в течение 6 мес. не вызывает нарушений со стороны функции печени, что позволяет рекомендовать его к широкому применению в акушерско-гинекологической практике для лечения женщин позднего репродуктивного возраста с избыточной массой тела и гиперпластическими процессами эндометрия [22, 23].
Таблица 2. Клинические исследования, посвященные эффективности и безопасности микронизированного прогестерона на поздних сроках беременности
|
Автор |
Выборка |
Дизайн |
Схема терапии |
Критерии эффективности |
Результат |
|
Romero R., Nicolaides K., Conde-Agudelo A., O’brien J.M. [et al.] 2016 |
Пять исследований с участием в общей сложности 974 женщин |
Обновлено систематический обзор и мета-анализ рандомизированных контролируемых исследований, сравнивающих вагинальный прогестерон с плацебо / отсутствием лечения
|
Прогестерон для вагинального применения при короткой шейке и угрозе преждевременных родов |
Нивелирование симптоматики |
Вагинальное введение прогестерона было связано со статистически значимым снижением риска преждевременных родов от <28 до <36 недель беременности |
|
Hassan S. S., Romero R., Vidyadhari D., Fusey S. [et all.] 2011 |
Многоцентровое, рандомизированное, двойное-слепое плацебо контролируемое исследование |
Здоровые беременные женщины с УЗ признаками короткой шейки матки (10-20 мм) от 19 + 0 до 23+ 6 недель беременности. |
465 женщин (вагинальный гель прогестерона, n = 235; плацебо, n = 223) |
Нивелирование симптоматики |
Введение геля вагинального прогестерона до 33 недель беременности связано с уменьшением частоты преждевременных родов на 45% и с улучшением неонатальной выживаемости |
|
Borna H., Borna S., Khazardous S., Hantoushzadeh S.[et all.] 2007 |
Рандомизированное, клиническое исследование |
70 женщин с преждевременными родами
|
Прогестерон в форме суппозиториев (400 мг) ежедневно до родов и контрольная группа, не получавшая лечение. |
Нивелирование симптоматики |
Применение вагинальных суппозиториев прогестерона после успешного парентерального токолиза связано с более длительным временем до наступления родов и уменьшением частоты повторных преждевременных родов |
|
Голяновський О.В., Рубинштейн А.М., Бачинська М.А. 2015 |
Клиническое исследование эффективности комбинированной терапии сублингвальной и вагинальной формами микронизированного прогестерона при угрозе преждевременных родов в сроках 22-30 недель |
Изучить эффективность использования сублингвальной формы препарата микронизированного прогестерона в комплексной терапии угрозы преждевременных родов |
60 беременных с угрозой преждевременных родов в сроках беременности 22–30 недель. Микронизированный прогестерон 100 мг сублингвально три раза в сутки, затем вагинально 300 мг в сутки, снижая до 100 мг в сутки |
Нивелирование симптоматики |
Использование сублингвальной формы микронизированного прогестерона и препаратов магния в период выраженной клинической симптоматики угрозы преждевременных родов позволяет получить максимально быстрый терапевтический эффект |
|
Dodd J.M., Flenady V., Cincotta R., Crowther C.A. 2008 |
Обзор 11 рандомизированных контролируемых исследований |
Оценка преимуществ и недостатков применения прогестерона для профилактики преждевременных родов у женщин высокого риска |
2714 женщин и 3452 новорожденных |
Нивелирование симптоматики |
Применение прогестерона (в некоторых исследованиях внутримышечно и вагинально в других) имеет позитивное воздействие, в том числе пролонгирует беременность, однако нет достаточной информации о других возможных преимуществах или вреде. Дальнейшие исследования проводятся |
|
Жабченко І.А., Олешко В.Ф. 2015 |
Клиническое исследование |
Предложен алгоритм диагностических и лечебно-профилактических действий врача при истмико-цервикальной недостаточности |
Прогестероновая поддержка (микронизированный прогестерон сублингвально 50–100 мг дважды в сутки) или вагинально 50-150 мг дважды в сутки |
Нивелирование симптоматики |
|
В исследовании В. И. Пироговой и С. А. Шурпяк (2011) изучено вагинальное использование микронизированного прогестерона в дозе 100 мг 2 раза в сутки до достижения эффекта (от 3-х до 14-ти недель) у 30 беременных с клинически подтвержденными проявлениями угрозы невынашивания и показана хорошая переносимость П для интравагинального применения и отсутствие местных и системных побочных реакций. Авторами доказана клиническая эффективность микронизированного прогестерона в купировании угрозы прерывания беременности и установлено, что при своевременно начатой терапии удается сохранить беременность до срока 37-38 недель у 86,7 % пациенток с исходно низким уровнем П [25].
Изучение литературы показало, что на сегодняшний день на мировом рынке присутствуют различные лекарственные формы П (таблетки, капсулы, гель, раствор и пр.), которые используются путем их назначения разными путями введения (per os, сублингвально, вагинально и внутримышечно) [9].
Однако именно вагинальная форма П, как средство предотвращения преждевременных родов, включена в клинические рекомендации европейских, канадских и американских профессиональных ассоциаций. Это свидетельствует о доскональном изучении данного вопроса и подтверждается рядом исследований, в которых говорится о том, что именно применение вагинальной формы П обеспечивает хорошие результаты в профилактике преждевременных родов [10-12].
При вагинальном введении препарата П целесообразно использование только таблеток и/или геля, которые были разработаны специально для вагинального применения, так как каждый путь введения лекарственного препарата имеет свою соответствующую лекарственную форму. Эта особенность таблеток для интравагинального введения связана с тем, что при разработке определенной лекарственной формы, которая будет применяться в соответствующем пути введения, применяются специальные технологии и определенные вспомогательные вещества.
Так, помимо активных субстанций, в состав любой вагинальной таблетки входят вспомогательные вещества, которые могут существенно влиять на фармакологическую активность лекарственного средства и потребительские качества препарата [17].
Известно, что вспомогательный состав и технология производства вагинальных таблеток способствуют повышению терапевтической эффективности основных составляющих препарата, обеспечивая максимальный контакт слизистой влагалища с веществами и достаточную длительность их присутствия в полости матки, в то же самое время минимизируя раздражение слизистой от лекарственного средства. Указанные особенности обеспечиваются следующими свойствами лекарственной формы вагинальных таблеток:
- компактная удлиненно-приплюснутая форма таблетки увеличивает площадь контакта со слизистой: она удобно располагается во влагалище, минимизируя ощущение инородного тела внутри;
- таблетка имеет гладкую глянцевую поверхность и округлые края, «скользит» после введения, не раздражая слизистую. Эта особенность таблетки обусловлена наличием в ее составе стеарата магния, который вводится в конце технологического процесса производства таблетки. Представляя собой совокупность «тонких» частиц, стеарат магния слоями распределяется по поверхности «матричной» таблетки: образующаяся пленка обеспечивает длительный «смазывающий» эффект;
- таблетка не распадается при контакте с железистым секретом влагалища, а начинает медленно послойно растворяться, что обусловлено ее специальной структурой. В частности, на начальном этапе производства вагинальной таблетки создаются двухуровневые гранулы, содержащие активные вещества;
- гранулы строго калибруются по размеру («некондиционные» отсеиваются), после чего обволакиваются специальной смесью (полимолекулярный компонент, разрыхлитель и связывающая субстанция), которая создает структуру «матричной» таблетки: гранулы активных веществ скрепляются связующими «мостиками». Во влажной среде эти «мостики» начинают постепенно (послойно) растворяться.
Эти свойства вагинальных таблеток жестко контролируются как на этапе производства препарата, так и в его готовой лекарственной форме. Важно также подчеркнуть, что производство вагинальных таблеток полностью соответствует стандартам производства GMP.
Известно, что вагинальные таблетки содержат минимальное количество лимонной кислоты, благодаря которой не изменяется кислотность среды во влагалище, что особенно важно при такой часто распространенной патологии, как вагиноз. Именно кислая среда влагалища выполняет роль эволюционного фильтра, так как такой кислотный барьер может преодолеть только здоровый сперматозоид. Если изменяется кислотная среда влагалища, то тогда теряется эта функция и оплодотворить яйцеклетку может абсолютно неполноценный сперматозоид.
Для клинического применения особенно важна такая характеристика препарата, как биодоступность, которая отражает его эффективность и безопасность. Основным параметром биодоступности является количество препарата, которое попадает в кровь, т. е. пиковая концентрация действующего вещества в плазме крови.
Так, в исследовании В.Д. Лукьянчук и О.В. Кузнецовой (2016) установлено, что таблетки для вагинального применения имеют высокую степень растворимости (распада), что способствует увеличению доступности активного вещества непосредственно в месте введения (аппликации) (рис. 1) [18].
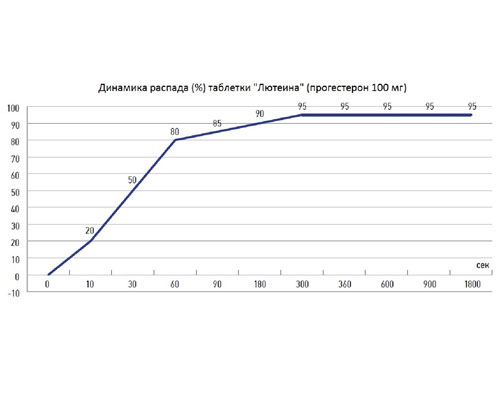
Рисунок 1. Динамика распада вагинальной таблетки в тесте «Растворение» (по материалам В.Д. Лукьянчук и О.В. Кузнецовой (2016) [18])
Авторами доказано, что исследованные вагинальные таблетки соответствуют современным требованиям к лекарственным средствам для интравагинального применения, поскольку в среде, приближенной к вагинальной, с рН 4,5 ± 0,5 и температуре 37 ± 0,50С таблетка растворяется в течение 5 минут. За это время освобождается активное вещество, что обеспечивает высокий уровень биодоступности действующего вещества [18].
В работе О.В. Голяновского с соавт. (2016) изучена эффективность применения микронизированного П в таблетированной лекарственной форме для вагинального введения в комплексной терапии угрозы прерывания беременности. Авторами доказано, что использование вагинальной формы микронизированного П для терапии и профилактики преждевременных родов достоверно снижает частоту данной патологии и улучшает перинатальные последствия [20]. Также авторами изучена динамика изменения концентрации П в плазме крови у 60 пациенток с угрозой преждевременных родов и установлено, что у пациенток 2 группы (прогестерон вводили внутримышечно) прирост концентрации на 3-е сутки был меньше, чем в 1 группе (прогестерон вводили вагинально), но на 7-е сутки он становился несколько больше.
На основании проведенного аналитического изучения данных отечественной и зарубежной литературы установлены преимущества и особенности таблеток для вагинального применения (табл. 3).
Таблица 3. Преимущества вагинальной таблетки
|
Быстрая растворимость |
|
Соответствует всем фармакологическим требованиям |
|
Содержит натуральный микронизированный прогестерон |
|
Компактная, удобно располагается во влагалище, минимизируя ощущение инородного тела внутри |
|
Стеарат магния (вспомогательное вещество) образует пленку на поверхности таблетки, обеспечивая ей «смазывающий» эффект. Таблетка «скользит», не раздражая слизистую, снижает риск микротравм влагалища |
|
Не несет риска бактериального инфицирования (имеется аппликатор) |
|
Разработана с учетом нормального рН влагалища (содержит подкисляющий компонент), поддерживая рН 4.5 в норме для развития лактофлоры |
|
Не изменяет биоценоз влагалища |
При анализе отечественной литературы установлено, что на сегодняшний день для вагинального введения П применяют такую лекарственную форму, как капсулы [21]. На основании аналитического изучения данных литературы нами проведена сравнительная характеристика различных лекарственных форм препаратов П (табл. 4).
Таблица 4. Сравнительная характеристика вагинальной таблетки и желатиновой капсулы
|
Вагинальная таблетка |
Желатиновая капсула |
|
Концентрация прогестерона в сыворотке крови 10,9 нг/мл |
Концентрация прогестерона в сыворотке крови 9,7 нг/мл |
|
Растворяется в течение 5 минут 95% препарата |
Медленно растворяется |
|
Высокая биодоступность |
Биодоступность ниже |
|
Быстро растворяется, не надо лежать |
Вытекает масло, которое пачкает белье |
|
Вагинальная форма |
Пероральная форма |
Как видно из представленной таблицы 5, особенностями вагинальных таблеток являются обеспечение более высокой концентрации П в сыворотке крови, быстрое растворение и высокая биодоступность препарата, а также возможность назначения на ранних и поздних сроках беременности.
Представленные исследования и данные по фармакологической активности различных препаратов П свидетельствуют о необходимости строгого соблюдения в назначении определенных лекарственных форм для вагинального введения. Высокие концентрации П в плазме крови косвенно свидетельствуют об уровне П в матке: чем больше концентрация П в плазме крови, тем больше она будет в органе-мишени, что позволяет варьировать дозы препарата микронизированного П.
Выводы.
Таким образом, на основании анализа отечественной и зарубежной литературы установлено, что:
- Для вагинального пути введения разработаны и должны применяться в клинической практике соответствующие лекарственные формы – таблетки и гель.
- Вагинальный путь введения препаратов прогестерона обеспечивает высокую биодоступность лекарственной формы и характеризуется безопасностью и удобством применения.
- Таблетированная лекарственная форма натурального микронизированного прогестерона для вагинального введения является одной из наиболее часто назначаемых и применяемых в клинической практике.
- Доказано, что при вагинальном способе введения П хорошо абсорбируется в системный кровоток, при этом пик плазменной концентрации достигается в течение 6-7 часов и период полувыведения препарата составляет 13 часов.
- Установлено преобладание концентрации прогестерона в сыворотке крови у пациенток при использовании интравагинального введения и доказано, что уровень прогестерона в сыворотке, достигаемый при вагинальном введении, составляет 10,9±4,2 нг/мл и достоверно (р<0,001) отличается от перорального приема.
- Досконально изучена клиническая эффективность, безопасность и рациональность клинического применения микронизированной формы натурального прогестерона при вагинальном применении.
- С точки зрения фармакоэкономической эффективности микронизированный прогестерон в виде вагинальных таблеток является наиболее доступным препаратом прогестерона при среднесуточной дозе терапии и в перерасчете на 100 мг действующего вещества.
Список литературы:
- Опрышко В.И. Инновации, меняющие стереотипы фармакологии будущего / В.И. Опрышко, Д.С. Носивец // Медицинские аспекты здоровья женщины. – 2016. – № 2 (98). – С. 2-6.
- Де Линьер Б. Натуральный прогестерон и его особенности / Брюно Де Линьер // Рос. вестник акушера-гинеколога. – 2003. – Т. 3, № 3. – С. 27-30.
- Опрышко В.И. Сублингвальная форма прогестерона: необходимость в инновациях или вызовы современной медицины / В.И. Опрышко, Д.С. Носивец // Здоровье женщины. – 2015. – № 10 (106). – С. 10-15.
- Беликов В.Г. Учебное пособие по фармацевтической химии / В.Г. Беликов. – М.: Медицина, 1979. – 441 с.
- Chaumeil J. C. Micronisation: a method of improving the bioavailability of poorly soluble drugs // Methods and Findings in Experimental and Clinical Pharmacology. – 1998. – 20. – P. 211-215.
- Никогосян Д.М. Применение микронизированного прогестерона для снижения риска преждевременных родов / Д.М. Никогосян, Л.И. Мальцева, Е.Ю. Юпатов // Практическая медицина. – 2012. – № 9 (65). – С. 61-64.
- Краснюк И.И. Повышение биодоступности лекарственных форм с применением твердых дисперсий. Автореф. дис. на соиск. уч. ст. докт. фарм. наук 14.04.01 – технология получения лекарств / Краснюк И.И. // ГОУ ВПО Московская медицинская академия имени И.М. Сеченова. – М.: 2010. – 28 с.
- Хомяк Н.В. Клинико-фармакологические особенности современных лекарственных форм микронизированного прогестерона, применяющихся во время беременности / Н.В. Хомяк, В.И. Мамчур, Е.В. Хомяк // З турботою про жінку. – 2014. – № 5 (53). – С. 1-3.
- Довідник лікарських засобів. Випуск 6. – Електрона версія CD-диск. – К., 2012.
- Каминский В.В. Применение прогестерона в акушерстве (обзор литературы) / В.В. Каминский, Л.Н. Онищик // Зб. наук. праць Асоціації акушерів-гінекологів України. – 2015. – Вип. 1. – С. 4-12.
- Жабченко И.А. Алгоритм акушерских действий при истмико-цервикальной недостаточности / И.А. Жабченко // Актуальні питання педіатрії, акушерства та гінекології. – 2015. – № 1. – С. 122-125.
- Дубоссарская З.М. Прегравидарная подготовка женщин с невынашиванием беременности / З.М. Дубоссарская // Здоровье женщины. – 2009. – № 8 (44). – С. 42-44.
- Vaginal progesterone in women with an asymptomatic sonographic short cervix in the midtrimester decreases preterm delivery and neonatal morbidity: a systematic review and metaanalysis of individual patient data / Romero, K. Nicolaides, A. Conde-Agudelo, A. Tabor [et al.]. // Am J Obstetrics & Gynecology. – 2012. – Vol. 2. – P. 124.e1- 124.e19.
- Abstracts XXI FIGO World Congress of Gynecology and Obstetrics Vancouver, Canada, 4-9 October, 2015 // International Journal of gynecology & obstetrics. – 2015. – 131, N 5 – P. 650.
- Резников А.Г. Препараты прогестерона: фармакологические особенности, преимущества, клиническое применение / А.Г. Резников // Практикующий врач. – 2004. – № 2. – С. 3-5.
- Сравнительная оценка эффективности применения микронизированного прогестерона перорально, интравагинально и сублингвально в циклах вспомогательных репродуктивных технологий и в І триместре наступивших беременностей / Е.Н. Борис, А.В. Каминский, В.В. Суменко, Л.Н. Онищик [и др.] // Здоровье женщины. – 2015. – № 3 (99). – С. 162-168.
- Алексеев К.В. Технологические аспекты производства современных твердых лекарственных форм / К.В. Алексеев // Фармацевтические технологии и упаковка. Лекарства по GMP. – 2009.
- Лук’янчук В. Д. Дослідження in vitro розчинності препарату в твердій дозованій лікарській формі для інтравагінального введення / В. Д. Лук’янчук, О. В. Кузнєцова // Медицинские аспекты здоровья женщины. – 2016. – № 1 (97). – C. 2-5.
- Direct transport of progesterone from vagina to uterus / Cicinelli, D. De Ziegler, C. Bulletti, M. G. Matteo [et al.]. // Obstet Gynecol. – 2000. – N. 95. – P. 403-406.
- ГоляновськийО.В. Ефективністькомбінованогозастосуваннясублінгвальноїтавагінальноїформмікронізованогопрогестеронувтерапіїзагрозипередчаснихпологів / О.В. Голяновський, А.М. Рубінштейн, М.А. Бачинська // Репродуктивнаендокринологія. – 2016. – № 1 (27). – С. 56 -62.
- Клинический обзор по препарату Утрожестан / С.В. Акиньшина, В.О. Бицадзе, А.Д. Макацария, З. К. Гадаева // Журнал РОАГ. – 2008. – № 2. – С. 34-41.
- Булавенко О.В. Лечение гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста с избыточным весом /О.В. Булавенко, Н.П. Дзись, О.В. Фурман // Репродуктивное здоровье. Восточная Европа. – 2015. – № 3 (39). – С. 121-127.
- Булавенко О.В. Лечение гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста с избыточной массой тела /О.В. Булавенко, Н.П. Дзись, О.В. Фурман // Здоров’я України. – 2015. – № 6. – С. 1-3.
- Пашковский Т. Оценка переносимости природного прогестерона, вводимого интравагинально, во время I триместра беременности / Т. Пашковский // Здоровье женщины. – 2014. – №1.- С. 1-3.
- Пирогова В.И. Гестагены при привычном невынашивании беременности / В.И. Пирогова, С.А. Шурпяк // Неонатологія, хірургія та перинатальна медицина. – 2011. – Т. І, № 2. – С. 75-81.







