Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Лечение бронхообструктивного синдрома у взрослых"
Автор: И.Г. Березняков, Д.Ю. Сидоров Харьковская медицинская академия последипломного образования
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Пульмонология, Семейная медицина/Терапия
Просмотров: 3 138
Дата проведения: с 22.06.2015 по 22.06.2016
 Патология органов дыхания занимает одно из ведущих мест в структуре заболеваемости и смертности населения нашей планеты. Значительный рост ее распространенности связан с негативным влиянием факторов окружающей среды, старением населения, возрастающей ролью аллергических состояний. Заболевания органов дыхания опасны прежде всего негативным системным эффектом на организм: при нарушении дыхательной функции страдают практически все органы и системы, быстро развивается сочетанная патология, лечение которой требует особых усилий. Затруднение свободного дыхания отрицательно влияет на общее самочувствие и работоспособность больного, способствует ранней инвалидизации и развитию депрессивных состояний. Эффективное лечение пациентов с такими распространенными патологиями, как бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ), является важной задачей не только пульмонологов, но и кардиологов, психиатров, педиатров, врачей общей практики.
Патология органов дыхания занимает одно из ведущих мест в структуре заболеваемости и смертности населения нашей планеты. Значительный рост ее распространенности связан с негативным влиянием факторов окружающей среды, старением населения, возрастающей ролью аллергических состояний. Заболевания органов дыхания опасны прежде всего негативным системным эффектом на организм: при нарушении дыхательной функции страдают практически все органы и системы, быстро развивается сочетанная патология, лечение которой требует особых усилий. Затруднение свободного дыхания отрицательно влияет на общее самочувствие и работоспособность больного, способствует ранней инвалидизации и развитию депрессивных состояний. Эффективное лечение пациентов с такими распространенными патологиями, как бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ), является важной задачей не только пульмонологов, но и кардиологов, психиатров, педиатров, врачей общей практики.
Среди лекарственных средств для лечения БА и ХОБЛ различают препараты для длительного применения (или, в случае БА, контролирующие течение заболевания) и препараты неотложной терапии (другое название – препараты по требованию). Средства для длительного применения принимаются ежедневно на протяжении значительных промежутков времени для предупреждения симптомов заболевания, поскольку обладают противовоспалительным действием и обеспечивают контроль над воспалением в бронхиальном дереве. К ним относятся ингаляционные глюкокортикостероиды (ИГКС), модификаторы лейкотриенов, ингаляционные β2 -агонисты длительного действия, теофиллины, кромоны, препараты для анти-IgEтерапии, аллергенспецифической иммунотерапии, м-холинолитики длительного действия, блокаторы фосфодиэстеразы 4 типа, длительная кислородотерапия в домашних условиях, CPAP (неинвазивная вентиляция легких посредством создания постоянного положительного давления в дыхательных путях) и BPAP-терапия (неинвазивная вентиляция двухуровневым положительным давлением). В свою очередь, препараты неотложной терапии действуют быстро, купируют симптомы заболевания и применяются по надобности. К этой группе медикаментов относят β2 -агонисты быстрого действия, ингаляционные антихолинергические средства, системные кортикостероиды, теофиллин.
Антихолинергические средства при лечении больных хронической обструктивной болезнью лёгких
Возрождение интереса к использованию антихолинергических средств в пульмонологии начинается в 70-х годах прошлого века в связи с накоплением новых теоретических и экспериментальных данных о роли холинергических механизмов в функционировании бронхолёгочной системы и патогенезе обструктивных заболеваний лёгких. Немалую роль в возрастании этого интереса сыграло внедрение в данный период в клиническую практику препарата ипратропиума бромида, который выгодно отличался от стандартного антихолинергического средства — атропина — большей силой и избирательностью терапевтического действия. Успех ипратропиума бромида стимулировал поиски новых высокоактивных и безопасных лекарств с указанным механизмом действия. В результате исследований было создано несколько оригинальных антихолинергических препаратов нового поколения, позволивших существенно улучшить возможности лечения пациентов с бронхолегочными обструктивными заболеваниями. Одновременно активизировались фундаментальные исследования в области молекулярных аспектов холинергической рецепции, подтипов мускариновых рецепторов, что позволило сформулировать теоретические основы для дальнейшего поиска селективных агонистов и антагонистов указанных рецепторов.
 Анатомически холинергические нервные волокна выходят из n. ambiguus (двойное ядро) и дорзальных двигательных ядер блуждающего нерва в стволе мозга и в составе данного нерва достигают парасимпатических ганглиев, располагающихся в бронхолёгочной системе. От этих ганглиев отходят короткие постганглионарные волокна к эффекторным клеткам. Раздражение блуждающего нерва вызывает высвобождение холинергического медиатора ацетилхолина из окончаний холинергических нервов, активацию мускариновых (м-) холинорецепторов, расположенных на плазматических мембранах гладкомышечных и железистых клеток бронхов, что проявляется в бронхоконстрикции и повышении секреции бронхиальной слизи.
Анатомически холинергические нервные волокна выходят из n. ambiguus (двойное ядро) и дорзальных двигательных ядер блуждающего нерва в стволе мозга и в составе данного нерва достигают парасимпатических ганглиев, располагающихся в бронхолёгочной системе. От этих ганглиев отходят короткие постганглионарные волокна к эффекторным клеткам. Раздражение блуждающего нерва вызывает высвобождение холинергического медиатора ацетилхолина из окончаний холинергических нервов, активацию мускариновых (м-) холинорецепторов, расположенных на плазматических мембранах гладкомышечных и железистых клеток бронхов, что проявляется в бронхоконстрикции и повышении секреции бронхиальной слизи.
Холинергическая иннервация в лёгких наиболее широко представлена в крупных воздухоносных путях и количественно уменьшается на уровне средних и особенно мелких бронхов и бронхиол. Соответственно, и эффекты стимуляции холинергических нервов наиболее выражены в трахее и крупных бронхах и слабее реализуются на периферии бронхиального дерева. В этом отношении холинергические структуры бронхолёгочной системы человека отличаются от β-адренергических, которые с равной степенью плотности представлены как в крупных, так и мелких бронхиальных структурах. Эти различия непосредственно связаны с клиникой, поскольку антихолинергические препараты по сравнению с агонистами β-адренорецепторов значительно менее эффективны при патологических процессах, затрагивающих преимущественно мелкие бронхиальные структуры.
Наряду с влиянием на тонус гладкой мускулатуры бронхов, м-холинорецепторы участвуют и в регуляции секреции бронхиальной слизи в ответ на стимуляцию блуждающего нерва. Возбуждение м-холинорецепторов приводит к активному стимулированию деятельности подслизистых желез и выделения слизи из бокаловидных эпителиальных клеток.
Холинергические реакции в бронхолёгочной системе реализуются при участии мускариновых холинорецепторов, расположенных на клетках-мишенях в воздухоносных путях. О структуре и функционировании м-холинорецепторов в настоящее время известно немало. В частности, выделены не менее 5 подтипов этих рецепторов (м1, м2, м3 и т. д.). Биологический смысл существования разных подтипов м-холинорецепторов, по-видимому, заключается в обеспечении возможности тонкой регуляции отдельных функций холинергической иннервации. Полагают, что функция м1-холинорецепторов состоит в усилении нейропередачи в парасимпатических ганглиях за счет модуляции функционирования никотиновых холинорецепторов, м2-холинорецепторов — в ингибировании высвобождения ацетилхолина в постганглионарных холинергических структурах (ауторецепторах) и взаимодействии с β2-адренорецепторами при их активации β2-агонистами, м3-холинорецепторов — в реализации холинергических влияний на уровне гладкомышечных и секреторных клеток подслизистых желез в воздухоносных путях.
Антихолинергические препараты тормозят рефлекторную бронхоконстрикцию, а уровень их активности в этом отношении зависит от выраженности реакции бронхиальной мускулатуры.
ХОБЛ сопровождается необратимым или не полностью обратимым сужением воздухоносных путей. Так, при хроническом обструктивном бронхите оно связано с комбинацией фиброза, прежде всего в периферических бронхах, и гиперплазии слизистой оболочки, тогда как при эмфиземе лёгких имеет место обтурация воздухоносных путей с потерей эластических элементов и утолщением альвеолярной стенки. Помимо этого, постоянно присутствует собственный бронхомоторный тонус, обусловленный активностью блуждающего нерва. В физиологических условиях этот тонус оказывает незначительное влияние на просвет дыхательных путей. Однако при их сужении в условиях ХОБЛ, из-за особенностей «геометрии» просвета бронхов, в которых развивается патологический процесс, вагальный бронхомоторный тонус оказывает значительно большее влияние на динамику дыхания, пропорциональное величине радиуса соответствующего бронха, возведенной в четвертую степень. В подобных условиях применение антихолинергических препаратов оказывает существенно большее бронхорасширяющее действие. Эффективность антихолинергических препаратов при лечении больных ХОБЛ по указанным выше причинам существенно выше, чем при БА, при которой бронхоконстрикторные реакции во многом обусловлены иными механизмами (в частности, непосредственным воздействием на гладкомышечные элементы медиаторов воспалительных реакций и отеком слизистой оболочки). Существенно и то, что положительная реакция больных ХОБЛ на антихолинергическую терапию свидетельствует о роли, которую играют холинергические механизмы (собственно вагальный бронхомоторный тонус и др.) в патогенезе данного вида лёгочной патологии. При обострениях ХОБЛ препараты с антихолинергическим механизмом действия эквивалентны или даже более эффективны, чем β2-агонисты, которые вызывают расслабление гладкой мускулатуры бронхов независимо от природы бронхоконстрикторных стимулов. Эффективность антихолинергической терапии обусловлена важной ролью, которую играет активность блуждающего нерва в патогенезе ХОБЛ. Хотя начало бронхорасширяющего эффекта антихолинергических препаратов развивается медленнее, чем действие β2-агонистов, то его продолжительность достаточно велика и достигает 6–8 часов, что существенно выше, чем у широко применяемых симпатомиметиков, в частности, сальбутамола. Указанные отличия в механизмах, сроках наступления и продолжительности действия позволяют рекомендовать комбинированное назначение антихолинергических и симпатомиметических средств для терапии больных ХОБЛ.
Однако влиянием на тонус гладкой мускулатуры не исчерпывается механизм действия антихолинергических препаратов при ХОБЛ. Существенную роль играет и их влияние на секрецию бронхиальной слизи. Прямая или опосредованная холинергическая стимуляция (например, за счет воздействия табачного дыма или других раздражителей на чувствительные афферентные холинергические окончания в слизистой оболочке воздухоносных путей) вызывает отчетливую активацию подслизистых желез и секреторной функции бокаловидных клеток, что усиливает бронхиальную обструкцию при ХОБЛ. В этих условиях ингаляция антихолинергических средств, ограничивающая секрецию бронхиальной слизи, может способствовать улучшению проходимости в периферических отделах бронхолёгочной системы.
Антихолинергические средства признаны препаратами первой линии при терапии ХОБЛ. Появление четвертичных аммониевых соединений позволяет почти полностью избежать мускариноподобных реакций, поскольку эти препараты не всасываются со слизистой дыхательных путей и желудочно-кишечного тракта (ЖКТ) при проглатывании. Наиболее широкое распространение получил ипратропиума бромид. Достоинством препарата является его безопасность. Редкими побочными эффектами ипратропиума бромида являются сухость во рту и металлический привкус, обострение глаукомы при попадании медикамента в глаза. Препарат не снижает активность мукоцилиарного транспорта и уменьшает количество мокроты без изменения ее вязкостных свойств. Ипратропиума бромид оказывает более длительное действие (в среднем 6-8 часов), чем симпатомиметики короткого действия. Препарат начинает действовать через 10 минут, а пик действия наступает через 1 час. Разовая доза ипратропиума бромида при использовании небулайзера составляет 0,25—0,5 мг, при использовании дозированного ингалятора — 40 (2 ингаляции) – 80 мкг (4 ингаляции).
В литературе опубликованы разные данные о сроках наступления и длительности бронхолитического эффекта после однократной ингаляции ипратропиума бромида. Большинство авторов указывает, что эффект наступает медленно, через 20-40 мин, в результате снижения сопротивления в центральных дыхательных путях, достигает максимума в течение 1-2 часов и продолжается до 5-6 часов. Другие авторы сообщают, что бронхолитический эффект после ингаляции ипратропиума бромида обнаруживается сравнительно быстро — на протяжении 3-30 мин, причем в течение первых 3 мин. проявляется 50% эффекта, а через 30 мин. — 80%.
У больных ХОБЛ увеличение объема форсированного выдоха за 1 секунду (ОФВ1) после теста с β2-агонистами обычно не превышает 15%, либо показатель не изменяется, в отличие от больных с БА, у которых обструкция дыхательных путей чаще всего обратимая (увеличение ОФВ1 более 15%). Тем не менее, даже небольшое увеличение ОФВ1, обычно трактуемое как необратимость обструкции дыхательных путей (или отсутствие эффекта), приводит у пациентов с ХОБЛ к положительному функциональному или симптоматическому улучшению. Это чрезвычайно важно для больных, особенно при тяжелом течении заболевания, поскольку даже незначительное увеличение ОФВ1 способствует уменьшению гипервоздушности лёгких, увеличению максимального давления на вдохе, уменьшению сопротивления дыхательных путей и работы дыхательных мышц и, соответственно, уменьшению выраженности одышки и увеличению объема физической активности больных. Кроме того, бронхолитики могут оказывать и другие полезные внелегочные эффекты, например, ускоряют мукоцилиарный клиренс, снижают давление в системе лёгочной артерии и др. Поэтому при применении бронхолитиков у больных с ХОБЛ нельзя ориентироваться только на обратимое изменение ОФВ1.
Следует учитывать и существующие различия в патологических значениях ОФВ1 и пиковой скорости выдоха (ПСВ) у больных ХОБЛ и БА. У пациентов с ХОБЛ уменьшение обоих показателей происходит непропорционально; как правило, величина ПСВ у больных с тяжелым течением ХОБЛ снижается в большей мере, чем ОФВ1, хотя на начальных этапах заболевания могут сохраняться и нормальные значения. Напротив, для пациентов с БА характерно пропорциональное уменьшение ОФВ1 и ПСВ. Поэтому у больных БА измерение ПСВ с помощью пикфлоуметра используется в диагностике и мониторировании заболевания.
Ипратропиума бромид применяется как для поддерживающей терапии ХОБЛ, так и при обострениях. Препарат является неселективным антагонистом м-холинорецепторов, блокирует м1-, м2- и м3-рецепторы в гладких мышцах дыхательных путей и предупреждает повышение внутриклеточной концентрации циклического гуанозинмонофосфата. Расположенные на окончаниях холинергических нервов м2-рецепторы ингибируют высвобождение ацетилхолина. Теоретически блокада этих рецепторов ипратропиума бромидом может приводить к чрезмерному высвобождению ацетилхолина в дыхательных путях и нивелировать блокаду других типов м-холинорецепторов.
В отличие от ипратропиума бромида, тиотропиум проявляет сопоставимую аффинность к м1–м5 подтипам мускариновых рецепторов. Стимуляция м3-рецепторов в гладкомышечных клетках дыхательных путей приводит к бронхоконстрикции посредством стимуляции фосфолипазы С, которая обусловливает образование диацилгликоля и инозитол трифосфата. Это, в свою очередь, стимулирует несколько каскадов внутриклеточных сигналов, ведущих к изменению гомеостаза кальция внутри клеток и бронхоконстрикции. Тиотропиум блокирует м3-рецепторы и вызывает вазодилатацию. Препарат предназначен для поддерживающей терапии ХОБЛ и не показан для стартовой терапии обострений этого заболевания. Длительность действия тиотропиума достигает 24 ч, медикамент применяется в ингаляциях 1 раз в сутки. При использовании разных ингаляторов разовая доза препарата колеблется в пределах 5–18 мкг. Тиотропиум применяется у больных с частыми обострениями ХОБЛ, выраженной одышкой и при их сочетании, а также у пациентов с установленным диагнозом ХОБЛ вне зависимости от состояния функции легких.
В 2013 г. авторы Кокрановского сотрудничества проанализировали влияние ипратропиума бромида и тиотропиума на качество жизни, обострения, симптомы, функцию легких и переносимость у больных ХОБЛ. Длительность вмешательств колебалась от 12 недель до 1 года, общее количество включенных больных составило 1073 человека в возрасте 40 лет и старше со стажем курение не менее 10 пачко-лет, исходный ОФВ1 – в среднем 40% от должного. Через 3 мес. ОФВ 1 в группе больных, получавших тиотропиум, увеличился на 109 мл по сравнению с пациентами, получавшими ипратропиума бромид. Через 1 год качество жизни больных, получавших тиотропиум, было лучше. Средняя разница в показателях респираторного опросника больницы Святого Георгия (SGRQ) составила 3,3 пункта. Однако переоценивать эти данные не следует. Минимальные различия в изученных показателях, которые имеют клиническое значение, составляют соответственно 150 мл и 4 пункта. Другими словами, выявленные различия имеют статистическое, но не клиническое значение.
Переносимость тиотропиума была лучше (риск возникновения тяжелых нежелательных лекарственных явлений и отказов от продолжения лечения был ниже, чем при назначении ипратропиума бромида). Риск обострений ХОБЛ, нуждающихся в курсовом лечении кортикостероидами, антибиотиками, либо их комбинацией и риск госпитализации по любому поводу также были ниже в группе в группе лиц, лечившихся тиотропиумом. Однако риск смертности от любой причины в группах сравнения оказался сопоставимым (рис. 1).
Рис. 1
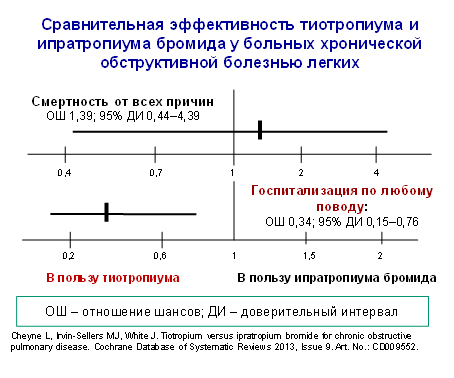
Авторы пришли к выводу, что полученные данные свидетельствуют в пользу применения тиотропиума вместо ипратропиума бромида в терапии больных со стабильной ХОБЛ, однако отметили скудость доказательной базы и выразили озабоченность по поводу неопределенности с выбором оптимального доставочного устройства при использовании тиотропиума.
Продолжаются дискуссии о целесообразности изолированного применения ипратропиума бромида у больных ХОБЛ и его эффективности по сравнению с β2 -симпатомиметиками. Данные многочисленных исследований 80-х – начала 90-х годов прошлого столетия свидетельствуют, что ипратропиума бромид по меньшей мере столь же эффективен, что и β2-симпатомиметики короткого действия, и может превосходить их по эффективности в популяции больных ХОБЛ пожилого и старческого возраста в связи с возможным снижением ответа на β2-агонисты вследствие уменьшения количества адренорецепторов по мере увеличения возраста. Кроме того, агонисты β2-рецепторов чаще, чем антихолинергические препараты, вызывают тахикардию и тремор. Авторы Кокрановского сотрудничества, первоначально запланировавшие сравнить эффективность ипратропиума бромида и β2-адреномиметиков короткого действия, в связи с появлением в конце 90-х годов β2-адреномиметиков длительного действия переключились на сравнение ипратропиума бромида уже с этим классом медикаментов. Согласно полученным ими данным, с точки зрения улучшения симптомов ХОБЛ и переносимости физических нагрузок разница при длительном применении м-холинолитика или сальметерола минимальная. Тем не менее, сальметерол более эффективен в улучшении функции легких (ОФВ1 и ПСВ). В свою очередь, комбинация ипратропиума бромида и сальметерола превосходит монотерапию сальметеролом по влиянию на улучшение качества жизни, функцию легких после ингаляции бронходилататора и уменьшению приема β2-агонистов по требованию.
Большинство исследователей сообщает о повышении эффективности при увеличении дозы ипратропиума бромида или при его комбинации с другими бронхолитиками. При сочетании ипратропиума бромида и β2-агонистов благодаря воздействию на разные механизмы бронхообструкции, включающие блокаду парасимпатической и стимуляцию симпатической нервной систем, и разным точкам приложения действия препаратов (проксимальные и дистальные бронхи) наблюдается аддитивность или синергизм бронхолитического эффекта, ускоряется его начало и улучшается комплаентность больных. Кроме того, усиление эффекта при комбинированной терапии не сопровождается появлением дополнительных нежелательных эффектов.
Эффективность комбинации препаратов, по-видимому, зависит от последовательности назначения бронхолитиков. Так, при назначении β2-агониста (сальбутамола) после ипратропиума бромида у больных ХОБЛ выраженность бронходилатации не увеличивается, в то время как эффект приема м-холинолитика после β 2-агониста значительно превосходит эффект последнего. Это наблюдение позволяет говорить о преимущественной эффективности ипратропиума бромида у больных ХОБЛ.
У пациентов с ХОБЛ ипратропиума бромид одинаково эффективен у молодых и пожилых и более эффективен в группе лиц, бросивших курить. Дозозависимое улучшение толерантности к физической нагрузке, увеличение ОФВ1 и мощности физической нагрузки у больных со стабильным течением ХОБЛ позволяет говорить о целесообразности индивидуального тестирования дозы препарата.
При тяжелом обострении ХОБЛ результаты тестов с бронхолитиками непредсказуемы и непостоянны, а по их результатам затруднительно предсказать ожидаемый ответ на лечение бронхолитиками вне обострения заболевания.
Ипратропиума бромид, даже при использовании в небулайзере в дополнение к фенотеролу, не влияет на частоту сердечных сокращений и ударный выброс, что позволяет использовать его и в интенсивной терапии.
В последние годы возрастает число работ о достоинствах применения ипратропиума бромида с помощью струйных и ультразвуковых небулайзеров. У больных ХОБЛ через небулайзер с успехом применяют и комбинированный препарат, в 1 мл раствора которого содержится 250 мкг ипратропиума бромида и 500 мкг фенотерола.
Селективные β2-агонисты адренергических рецепторов в лечении хронической обструктивной болезни лёгких
Дискуссия о месте и роли β2-агонистов адренергических рецепторов в терапии ХОБЛ ведется с начала их применения при этом заболевании. Обсуждаются вопросы о том, могут ли симпатомиметики претендовать на роль препаратов первой линии в терапии ХОБЛ, превосходит ли по эффективности комбинация препаратов этой группы с антихолинергическими средствами монотерапию каждым из них, с какого препарата предпочтительнее начинать лечение, какова должна быть длительность терапии и как она влияет на прогрессирование болезни.
ХОБЛ рассматривается как неуклонно прогрессирующее заболевание, характерными чертами которого являются малообратимая обструкция дыхательных путей, нарушение архитектоники терминальных отделов паренхимы лёгких и повышение секреции мокроты. Современный уровень знаний и клинический опыт, к сожалению, не позволяют предупредить развитие ХОБЛ или существенно снизить скорость потери лёгочной функции. Цель современной фармакотерапии ХОБЛ — предупредить развитие симптомов и обострения, сохранить легочную функцию в настоящее время и в будущем, повысить активность пациента при повседневной жизни, улучшить качество жизни.
Общепринято, что бронхорасширяющая терапия при ХОБЛ занимает одно из главных мест. Как правило, после приема бронхорасширяющих препаратов у больных уменьшается субъективное ощущение диспноэ и увеличивается толерантность к физической нагрузке. С этой целью применяют бронходилататоры различных фармакологических групп: антихолинергические средства, β2-агонисты адренергических рецепторов и метилксантины.
Теоретической основой использования β2-агонистов в терапии ХОБЛ является способность вызывать расслабление гладкой мускулатуры бронхов, улучшать мукоцилиарный клиренс в результате привлечения в просвет бронхиального дерева ионов хлора и воды, учащения движения ресничек мерцательного эпителия бронхов, оказывать бронхопротективное, антиаллергическое и противовоспалительное действие.
В настоящее время симпатомиметики существуют в растворах для инъекций или инфузий, таблетированных и ингаляционных (порошкообразных и в виде спреев) лекарственных формах. В терапии ХОБЛ предпочтение отдается ингаляционному пути их введения, позволяющему доставить препарат непосредственно к органу-мишени, достичь быстрого начала действия, снизить частоту и выраженность системных эффектов. При этом можно использовать препараты, не всасывающиеся или разрушающиеся в желудочно-кишечном тракте.
Различают ингаляционные лекарственные формы β2-агонистов адренергических рецепторов короткого и пролонгированного действия. Препараты короткого действия вызывают быстрое развитие фармакологического эффекта и используются для быстрого купирования симптомов ХОБЛ и диспноэ, вызванного физической нагрузкой. Ингаляционные β2-агонисты начинают действовать через 5–10 минут, продолжительность действия – 4–5 часов. Для лучшей доставки препарата, облегчения техники ингаляции и уменьшения побочных эффектов рекомендуется применение спейсеров.
В ходе изучения эффективности ингаляционных пролонгированных лекарственных форм β2-агонистов при ХОБЛ установлено, что сальметерол, формотерол, индекатерол значительно улучшают качество жизни больных, но не оказывают существенного влияния на годовую динамику показателей функции внешнего дыхания.
Особое место в терапии ХОБЛ занимают комбинированные лекарственные формы препаратов с различным механизмом действия. Жесткие фиксированные комбинации не всегда являются целесообразными из-за особенностей фармакокинетики и фармакодинамики входящих в их состав препаратов. Примером удачной комбинации является сочетание симпатомиметика (фенотерол) и холинолитика (ипратропиума бромид). Препарат выпускается в двух лекарственных формах: в виде дозированного аэрозоля и раствора для ингаляции. В качестве раствора для ингаляции через небулайзер он используется при обострении ХОБЛ, в лечении обострения БА, затяжного приступа БА, астматического статуса как препарат выбора до введения глюкокортикостероидов и аминофиллина, при обострении хронического обструктивного бронхита в составе комплексного лечения, в отделении физиотерапии в качестве плановой бронходилатирующей терапии.
При лечении симпатомиметиками следует учитывать следующие факторы:
1) при отсутствии эффекта и/или развитии парадоксальной реакции использование препаратов данной группы не рекомендуется;
2) использование спейсера для облегчения техники ингаляции ведет к повышению эффективности терапии и снижению выраженности системных эффектов;
3) количество ингаляций в течение месяца – не более 200–300 доз (1 дозированный ингалятор);
4) пациентов следует проинструктировать о максимальном количестве ингаляций в день: обычно 8–12, а во время обострения 12–24 ингаляции;
5) следует строго следить за кратностью приема пролонгированных лекарственных форм из-за возможной кумуляции и передозировки;
6) в домашних условиях ингаляция больших доз симпатомиметиков через небулайзер не рекомендуется.
Эффективность комбинированной терапии объясняется следующими факторами: синергизм действия применяемых компонентов, различные точки приложения действия в дыхательных путях, разная продолжительность действия. Преимущество комбинированной терапии заключается в возможности уменьшения дозы каждого из компонентов и снижении частоты побочных эффектов, расширении фармакологического спектра препарата, увеличении выраженности и продолжительности действия, превышающих простую сумму эффектов компонентов.
Несмотря на то, что ХОБЛ характеризуется необратимостью бронхиальной обструкции, бронходилататоры являются препаратами первой линии в терапии обострения. Даже небольшое повышение проходимости дыхательных путей приводит к улучшению клинического состояния. Использование бронходилататоров предполагает увеличение доз и частоты введения. Существующий круг различных доставочных устройств для ингаляционной терапии позволяет оптимизировать лечение больных путём индивидуального подбора типа ингалятора с учётом возраста пациента, сопутствующей патологии, тяжести состояния. При тяжёлых обострениях и у больных пожилого и старческого возраста предпочтение отдается небулайзерной терапии. Режимы дозирования бронходилататоров представлены в табл. 1.
Таблица 1.
Режимы дозирования бронходилататоров
|
Препарат |
Форма выпуска |
Доза |
|
Сальбутамол |
Раствор для небулайзеров по 2,5 и 5 мл ДАИ* со спейсером 100 мкг/доза |
2,5-5 мг каждые 4-6 часов 2-4 ингаляции каждые 4-6 часов |
|
Фенотерол |
Раствор для небулайзеров 1 мг/мл ДАИ со спейсером 100 мкг/доза |
0,5-1,0 мг каждые 4-6 часов 2-4 ингаляции каждые 4-6 часов |
|
Ипратропиума бромид |
Раствор для небулайзеров (0,25 мг/мл) ДАИ со спейсером 40 мкг/доза |
0,25-0,5 мг каждые 6-8 часов 2-4 ингаляции каждые 6-8 часов |
|
Комбинированный препарат ипратропиума бромида и фенотерола |
Раствор для небулайзеров (0,25 мг 0,5 мг)/мл ДАИ 20 50 мкг/доза |
2-4 мл каждые 4-6 часов 2-4 ингаляции каждые 6-8 часов |
*ДАИ – дозированные аэрозольные ингаляторы.
Купирование приступов удушья при бронхиальной астме
Около 5% взрослого населения и почти 10% детей в развитых странах мира страдают БА. Препараты для купирования симптомов применяются лишь по требованию, т.е. тогда, когда пациент чувствует, что у него возникает затрудненное дыхание или он находится под воздействием неблагоприятных факторов, которые могут вызвать острое нарушение бронхиальной проходимости — приступ бронхоспазма.
Даже при очень хорошем контроле над БА не существует гарантий полного отсутствия симптомов и обострений. Контакт с аллергеном, в том числе неожиданный, пребывание в накуренном помещении и другие подобные ситуации могут вызвать затруднение дыхания, появление кашля и внезапное развитие приступа удушья. Это может случиться в любом месте и в любое время, а значит – необходимо иметь при себе средство для неотложной помощи и, конечно, уметь его применять. Оптимальной формой введения препаратов является ингаляционная. Широко используются β2-агонисты короткого (4–6 ч) действия: фенотерол, сальбутамол, тербуталин. Ингаляционные антихолинергические препараты для лечения БА представлены ипратропиума бромидом. По силе и скорости наступления эффекта антихолинергические препараты уступают β2-агонистам, однако совместное их использование оказывает выраженный бронхолитический эффект, особенно при среднетяжелой и тяжелой астме, а также у пациентов с БА и сопутствующим хроническим обструктивным бронхитом. Примером таких комбинированных препаратов является сочетание ипратропиума бромида и β2-агониста короткого действия фенотерола.
Бронхолитическое действие фенотерола связано с избирательным возбуждением β2-адренорецепторов бронхов, активацией сопряженной с адренорецептором аденилатциклазы, что приводит к увеличению образования циклического аденозинмонофосфата. Последний стимулирует работу кальциевого насоса, в результате чего снижается концентрация кальция в миофибриллах и наступает бронходилатация. Ипратропиума бромид устраняет бронхоспазм, связанный со стимулирующим влиянием блуждающего нерва, а при ингаляционном введении вызывает бронходилатацию, обусловленную, главным образом, местным, а не системным антихолинергическим действием. Препарат не оказывает отрицательного влияния на секрецию слизи в дыхательных путях, мукоцилиарный клиренс и газообмен. Комбинация фенотерола и ипратропиума бромида повышает эффективность бронхолитической терапии заболеваний, сопровождающихся повышением тонуса бронхов и гиперсекрецией слизи, а также позволяет использовать лекарственные средства в более низких дозах, чем при монотерапии.
Селективность фенотерола несколько меньше, чем у сальбутамола, в силу чего повышается риск развития таких нежелательных эффектов, как тремор и сердцебиение. В действительности дискуссии о безопасности β2-агонистов продолжаются уже более 50 лет. Впервые об этом заговорили после внедрения в клиническую практику изопротеренола форте – низкоселективного ингаляционного β2-агониста короткого действия и последующей эпидемии смертей среди больных БА. Поскольку возрастание смертности происходило параллельно росту применения β2-агонистов короткого действия, были высказаны гипотезы о кардиотоксичности этих средств, либо об индукции ими приобретенной резистентности. В действительности, большинство смертей произошло у пациентов, прекративших прием пероральных кортикостероидов, и именно это обстоятельство в последующем было связано с возрастанием смертности у больных БА.
В начале второй волны дебатов о безопасности β2-агонистов короткого действия смертность у детей с БА связывали с применением фенотерола, однако впоследствии упор был сделан на неадекватное лечение пациентов, включая недостаточное применение ИГКС. Более того, фенотерол чаще использовали больные с тяжелой БА, а после коррекции по исходному риску было установлено, что препарат не повышает риск тяжелых обострений заболевания.
В последние годы обсуждается главным образом безопасность продолжительного использования β2-агонистов длительного действия (сальметерол, формотерол). В 2010 г. FDA (Комиссия по контролю качества продуктов питания и лекарственных средств США) после всестороннего рассмотрения проблемы пришла к следующему заключению. «Польза от использования β2-агонистов длительного действия по-прежнему превосходит [возможный вред] при условии адекватного применения препаратов…» Тем не менее, FDA предлагает резервировать их для больных, у которых не удается добиться контроля над БА с помощью таких средств, как ИГКС. До тех пор, пока не станут доступны данные крупных рандомизированных контролируемых исследований по безопасности совместного использования ИГКС и β2-агонистов длительного действия, FDA предлагает ограничить продолжительное применение последних только теми больными, кто нуждается в их длительном приеме.
Возвращаясь к фенотеролу, следует отметить, что многие пациенты с обструктивными заболеваниями легких отдают предпочтение именно этому препарату, поскольку ощущают его действие как “более сильное”. Некоторые больные БА для облегчения симптомов используют комбинацию фенотерола и ипратропиума бромида. В большинстве случаев это предпочтение бывает оправданным, поскольку согласуется с индивидуальными особенностями заболевания. Прежде всего, это случаи БА с ваготонией – выраженным повышением тонуса парасимпатической нервной системы. Хотя БА сейчас классифицируют в первую очередь по степени тяжести, существует и классификация по клинико-патогенетическим вариантам течения, в рамках которой выделяется холинергическая астма. Ее особенностями являются преимущественно пожилой возраст пациентов, повышенная потливость, гипергидроз ладоней, частое сочетание с язвенной болезнью, преобладание приступов в ночные и ранние утренние часы, нередко продуктивный кашель со слизистой пенистой мокротой (“влажная астма”), выраженная реакция на неспецифические провоцирующие факторы (физическая нагрузка, холодный воздух, резкие запахи), симптомы со стороны сердечно-сосудистой системы – склонность к брадикардии, гипотонии и нарушениям ритма. При признаках холинергической астмы представляется оптимальным использовать комбинацию фенотерола и ипратропиума бромида, содержащую малые дозы β 2-агониста быстрого действия и воздействующую на тонус парасимпатической системы.
Ночные приступы удушья могут быть следствием ассоциации БА с желудочно-пищеводным рефлюксом. Выраженность бронхоконстрикции у пациентов с рефлюкс-эзофагитом указывает на вовлечение в патологический процесс вагусных рецепторов при наличии воспалительного процесса в слизистой пищевода. Высказано предположение о наличии специфических ноцицепторов, участвующих в рефлекторной бронхоконстрикции. Включение комбинации фенотерола и ипратропиума бромида в стандартную схему терапии БА в сочетании с гастроэзофагальной рефлюксной болезнью позволяет достичь значимого уменьшения частоты приступов и улучшения показателей бронхиальной проходимости.
При развитии обострения БА или ХОБЛ, спровоцированного острым респираторным заболеванием вирусной этиологии, задействован холинергический механизм. Высвобождение ацетилхолина из парасимпатических нервов дыхательных путей активирует постсинаптические мускариновые рецепторы, присутствующие в гладких мышцах, подслизистых железах и кровеносных сосудах. Это является триггером бронхоспазма, гипертрофии мускулатуры, секреции слизи и вазодилатации. Высвобождение ацетилхолина из парасимпатических нервов в легких, вызванное различными стимулами, подавляется угнетающей активностью нейрональных м2-рецепторов посредством механизма обратной связи.
При вирусных респираторных инфекциях возникают нарушения парасимпатической регуляции тонуса бронхов, связанные с дисфункцией рецепторов. Для лечения развившейся на их фоне обструкции (острый бронхит, обострение БА) также показано использование комбинации фенотерола и ипратропиума бромида, поскольку она устраняет нарушения парасимпатической регуляции, возникающие вследствие дисфункции м-холинорецепторов.
Сочетание взаимодополняющих компонентов (фенотерол и ипратропиума бромид) позволяет получить выраженный бронхолитический эффект при использовании вдвое меньшей дозы фенотерола (50 мкг), что сводит к минимуму вероятность нежелательных эффектов (они возникают в основном при передозировке). Благодаря этому фиксированную комбинацию указанных препаратов можно назначать и пациентам с сопутствующими заболеваниями сердечно-сосудистой системы.
В целом, применение комбинации фенотерола и ипратропиума бромида для купирования БОС при БА показано при:
- наличии у пациентов измененного β2-рецептора (генетическая аномалия β2-рецептора, заключающаяся в замещении в 16 позиции глицина на аргинин и формированием генотипа рецептора, нечувствительного к любым β2-агонистам);
- уменьшении рецепторной β2-активности;
- наличии выраженных проявлений сердечно-сосудистых заболеваний;
- явлениях «ночной астмы» (варианта БА, при котором приступы удушья возникают во второй половине ночи на фоне бронхиальной обструкции, вызванной активностью блуждающего нерва);
- вирусных инфекциях, усиливающих бронхиальную обструкцию.
Кроме того, фиксированная комбинация фенотерола и ипратропиума бромида может с успехом применяться для облегчения симптомов при сочетании ХОБЛ с БА. Ее можно назначать и при трахеобронхиальной дискинезии, а также для профилактики удушья, связанного с вдыханием холодного воздуха. Таким образом, существует немало клинических ситуаций, в которых для облегчения симптомов бронхиальной обструкции подходит именно комбинация фенотерола и ипратропиума бромида. В настоящее время эта фиксированная комбинация внесена в международные клинические рекомендации по лечению пациентов с БА и ХОБЛ.
Чаще всего для купирования симптомов бронхообструкции применяют многодозовые ингаляторы. Эти устройства обеспечивают доставку препарата непосредственно в дыхательные пути; при этом эффект наступает быстро и достигается с помощью меньшей дозы, а системное влияние на организм сводится к минимуму. При симптомах БА бронхолитики с быстрым началом действия обычно назначают по 1–2 ингаляции с промежутком в 1–2 мин.
Однако многие пациенты испытывают трудности с использованием дозированного аэрозольного ингалятора (ДАИ), из-за чего лекарство не попадает в нужные отделы дыхательных путей и эффективность ингаляции снижается. Поэтому желательно проводить ингаляцию через спейсер или использовать другие облегчающие системы доставки, а при каждом визите пациента к врачу контролировать правильность выполнения ингаляции. Между легочной депозицией бронходилататоров и клиническим эффектом препарата существует линейная зависимость.
Согласно международным стандартам лечения БА и ХОБЛ, небулайзерная терапия является высокоэффективным методом, особенно при оказании неотложной помощи, поскольку препарат практически мгновенно доставляется непосредственно в очаг поражения. При этом требуются более низкие дозы лекарственного вещества, поскольку увеличивается активная поверхность взаимодействия со слизистой, а следовательно, значительно снижается риск нежелательных реакций, связанных с системным действием препаратов. Этот вид доставки лекарственного препарата очень удобен в период обострений БА и ХОБЛ, а также при тяжелом течении заболеваний, поскольку в данном случае не задействуется дыхательная мускулатура.
Абсолютными показаниями для небулайзерной терапии являются невозможность доставки лекарственного препарата в дыхательные пути с помощью какого-либо другого ингаляционного устройства и состояние пациента, не позволяющее использовать никакой другой вид ингаляционной терапии. Относительными показаниями служат необходимость введения больших доз препаратов (например, при тяжелой бронхиальной обструкции), предпочтение пациента и практическое удобство. Фиксированную комбинацию фенотерола и ипратропиума бромида в виде раствора для ингаляций можно применять с помощью различных компрессорных и ультразвуковых небулайзеров. При обострении БА легкой и умеренной степени тяжести у взрослых комбинация применяется однократно по 1 мл, при тяжелых обострениях дозу увеличивают до 2,5 мл. У пациентов в тяжелом состоянии в условиях стационара возможно применение максимальной дозы – 4 мл. Небулайзерное введение комбинации фенотерола и ипратропиума бромида рекомендуется лицам с тяжелым течением БА и ХОБЛ, у которых отмечаются частные обострения; препарат вводится до 4 раз в сутки по 1-2 мл на каждый прием.
Доказательная база эффективности фиксированной комбинации фенотерола и ипратропиума бромида при БА и ХОБЛ соответствует уровню А и получена в ходе рандомизированных контролируемых исследований (РКИ), постмаркетинговых исследований и обобщений реальной клинической практики. Метаанализ 32 РКИ, в которые были включены 3611 пациентов, показал, что применение комбинации холинолитиков с β2-адреномиметиками при лечении обострения БА приводит к достоверному снижению частоты госпитализаций у детей и у взрослых, а также значимому увеличению показателей спирометрии. Небулизация ипратропиума бромида/фенотерола у пожилых больных с тяжелым обострением БА не сопровождалась кардиотоксическим действием и была высокоэффективной. При анализе клинических случаев ведения больных БА с частыми обострениями эффективность ипратропиума бромида/фенотерола была высокой как при использовании ДАИ, так и при небулизации.
Применение ипратропиума бромида/фенотерола в течение почти 40 лет закрепило позиции комбинации в современных всемирных инициативах GOLD и GINA, где бронхолитики короткого действия рекомендуются к использованию с начальных стадий ХОБЛ и БА, а потребность в их применении является одним из информативных критериев контроля над БА.
Список литературы:
1. Roffel A.F., Mews Н., Ziugsnia J. Muscarinic receptors and the lung: Relevance chronic obstructive pulmonary disease and asthma. In: Bames P.J., Buist A.S., editors: The role of anticholinergics in chronic obstructive pulmonary disease and chronic asthma. — UK, Gardiner-Caldwell Communication LTD 1997 — 92-125.
2. Gross NJ. Ipratropium bromide. N. Engl. J. Med. 1988; 319: 486-494.
3. Cheyne L, Irvin-Sellers MJ, White J. Tiotropium versus ipratropium bromide for chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews 2013, Issue 9. Art. No.: CD009552.
4. Bousquet J., Bourdin A., Demoly P. Safety of β2-agonists: a 50-year debate closed? Eur Respir J 2014; 43: 6–9.
5. Appleton S., Jones T., Poole P., et al. Ipratropium bromide versus long-acting beta-2 agonists for stable chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews 2006, Issue 3. Art. No.: CD006101.
6. Combivent inhalation study group. In chronic obstructive pulmonary disease, a combination of ipratropium and albuterol is more effective than either agent alone. An 85-day multicentertrial. Chest 1994; 105 (5): 1411-92.
7. Anthonisen N.R., Cornel J.E., el al. Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. The lung health study. J. Am. Med. Assoc. 1994; 272: 1497-1505.
8. Ikedu A., Nishinura K., et al. Dose response study of ipratropium bromide aerosol on maximum exercise performance in stable patients with chronic obstructive pulmonary disease. Thorax 1996; 51 (I): 48-53.
9. Daries J., Angus M.I., Cirverley Р. Bronchodilator responsiveness in patients admitted with acute exacerbations of chronic obstructive pulmonary disease. Am. J. Respir. Critic. Care. Med. 1997; 155 (4 part 2 of 2 pts): A598.
10. Чучалин А.Г. Бронхиальная астма. Сальбутамол./ Под ред. Акад. РАМН Чучалина А.Г. и док. Хамида И. М., ФАРМЕДИНФО, 1992.
11. van Herwaarden С., Dekhuijzen P., van Schayck C., et al. Drug treatment of chronic obstructive pulmonary disease. Ned. Tijdschr. Geneeskd. 1996; 140 (14): 761-5.
12. Jones P., Bosh T. Quality of life changes in COPD patients treated with salmeterol. Am. J. Respir. Crit. Care Med. 1997; 155 (4): 1283-9.
13. Steffensen I., Fawschou P. Formoterol as inhalation powder in the treatment of patients with reversible obstructive lung diseases. A 3-month placebo-controlled comparison of the effects of formoterol and salbutamol, followed by a 12-month period with formoterol alone. Ugeskr. Laeger. 1996; 158 (49): 7092-6.
14. ATS. Comprehensive outpatient management of COPD. Resp. Crit. Care Med. 1995; 152 (Supl 10): S84-S96, S97-S106.
15. Terainoto S., Fuhichi Y., Ouchi Y. A week-long course of inhaled beta-agonist or anticholinergic agent may reduce dyspnea during exercise in COPD. Chest 1996; 109 (6): 1666-7.
16. Фещенко Ю.И., Яшина Л.А., Полянская М.А., Гуменюк Л.Г. Ингаляционная терапия в пульмонологии//Рациональная фармакотерапия. – 2007. – том 3. – №2. – С. 20 – 26.
17. Низовцева О.A. Астма та алергія. 2013; 4.
18. Chowdhury B.A., Dal Pan G. The FDA and safe use of long-acting beta-agonists in the treatment of asthma. N. Engl. J. Med. 2010; 362: 1169–71.
19.Корабельников Д.И. Бронхиальная астма и сопутствующие заболевания органов пищеварения. Пульмонология. 2002; (1): 87–92.
20. Плешко Р.И. и соавт. Тяжелая бронхиальная астма и гастроэзофагальный рефлюкс: морфологические аспекты сопряженности. Пульмонология. 2006; (1): 60–63.
21. Бездетко Т.В. и соавт. Клинический опыт применения комбинированного препарата на основе фенотерола и ипратропия бромида в комплексной терпи бронхиальной астмы в сочетании с гастроэзофагальной рефлюксной болезнью. Укр. пульмонол. журнал 2012; 3.
22. Rodrigo G.J., Castro-Rodriguez J.A. Anticholinergics in the treatment of children and adults with acute asthma: a systematic review with metaanalysis. Thorax 2005; 60 (9): 740–6.
23. Маколкин В.И., Овчаренко С.И., Передельская О.А., Аксельрод А.С. Влияние больших доз бронхолитических препаратов на состояние сердечнососудистой системы при лечении тяжелого обострения бронхиальной астмы. Кардиология 2004; 44 (2): 65–69.
24. Овчаренко С.И. Беродуал и его место в лечении больных бронхиальной астмой. Астма и аллергия 2013; 3: 15–19.
25. Визель А.А., Визель И.Ю. Бронхиальная астма: эволюция ингаляционной терапии и пример из клинической практики. Consilium Medicum 2008; 10 (10): 27–30.






