Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Лечение бронхообструктивного синдрома у детей"
Автор: И.Г. Березняков, Д.Ю. Сидоров Харьковская медицинская академия последипломного образования
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Педиатрия/Неонатология, Пульмонология, Семейная медицина/Терапия
Просмотров: 2 930
Дата проведения: с 22.06.2015 по 22.06.2016
Бронхообструктивный синдром (БОС) – комплекс клинических проявлений, возникающий в результате генерализованного сужения просвета бронхов разной этиологии. Сужение просвета мелких бронхов требует большего положительного внутригрудного давления для производства выдоха, что способствует большему сдавлению крупных бронхов; это приводит к их вибрации и возникновению свистящих звуков. Клинические проявления БОС складываются из удлинения выдоха, появления экспираторного шума (свистящее дыхание), приступов удушья, участия вспомогательной мускулатуры в акте дыхания, малопродуктивного кашля. При выраженной обструкции может появиться увеличение частоты дыхания, развитие усталости дыхательных мышц и снижение парциального напряжения кислорода крови.
У детей известно около 100 болезней, сопровождающихся БОС. Среди них можно упомянуть следующие:
· заболевания органов дыхания: инфекционно-воспалительные (острая респираторная вирусная инфекция, бронхит, бронхиолит, пневмония), аллергические (бронхиальная астма), бронхолегочная дисплазия, пороки развития бронхолегочной системы, облитерирующий бронхиолит, туберкулез, опухоли трахеи и бронхов;
· инородные тела трахеи, бронхов, пищевода;
· заболевания желудочно-кишечного тракта (ЖКТ): гастроэзофагальный рефлюкс, трахеопищеводный свищ, пороки развития желудочно-кишечного тракта, диафрагмальная грыжа;
· заболевания сердечно-сосудистой системы врожденного и приобретенного характера: врожденные пороки сердца с гипертензией малого круга кровообращения, аномалии крупных сосудов, врожденные неревматические кардиты;
· неврологические и психические заболевания: черепно-спинальная травма, детский церебральный паралич, миопатии, нейроинфекции (полиомиелит и др.), истерия, эпилепсия;
· наследственные болезни: муковисцидоз, синдром мальабсорбции, рахитоподобные заболевания, мукополисахаридозы, дефицит α1-антитрипсина, синдром Картагенера;
· врожденные и приобретенные иммунодефицитные состояния, а также травмы, ожоги, отравления, воздействие различных физических и химических факторов внешней среды, сдавление трахеи и бронхов внелегочного происхождения (тимомегалия и др.).
 С практической точки зрения в зависимости от этиопатогенеза бронхообструкции можно выделить 4 варианта БОС: 1) инфекционный, 2) аллергический, 3) обтурационный, 4) гемодинамический.
С практической точки зрения в зависимости от этиопатогенеза бронхообструкции можно выделить 4 варианта БОС: 1) инфекционный, 2) аллергический, 3) обтурационный, 4) гемодинамический.
У детей различают острый БОС (клинические проявления БОС сохраняются не более 10 дней), затяжной, рецидивирующий и непрерывно-рецидивирующий (в случае бронхолегочной дисплазии, облитерирующего бронхиолита и др.). По выраженности обструкции выделяют: легкую степень тяжести, среднетяжелую, тяжелую и скрытую бронхиальную обструкцию. Критериями тяжести течения БОС являются: наличие свистящих хрипов, одышки, цианоза, участие вспомогательной мускулатуры в акте дыхания, показатели функции внешнего дыхания (ФВД) и газов крови. Кашель отмечается при любой степени тяжести БОС. Для легкого течения БОС характерно наличие свистящих хрипов при аускультации, отсутствие в покое одышки и цианоза. Показатели газов крови в пределах нормы, показатели ФВД (объем форсированного выдоха за 1 сек. (ОФВ1) и максимальная скорость выдоха) составляют более 80% от нормы. Самочувствие ребенка, как правило, не страдает. Течение БОС средней степени тяжести сопровождается наличием в покое одышки экспираторного или смешанного характера, цианоза носогубного треугольника, втяжения уступчивых мест грудной клетки. Свистящее дыхание слышно на расстоянии. Показатели ФВД составляет 60-80% от нормы, парциальное давление кислорода (РаО2) и углекислого газа (РаСО2) в артериальной крови соответственно более 60 мм рт. ст. и менее 45 мм рт. ст. При тяжелом течении приступа бронхиальной обструкции самочувствие ребенка страдает, характерны шумное затрудненное дыхание с участием вспомогательной мускулатуры, наличие цианоза. Показатели ФВД ниже 60% от нормы, РаО2 менее 60 мм рт. ст., РаСО2 более 45 мм рт. ст. При скрытой бронхиальной обструкции не определяется клинических и физикальных признаков БОС, но при исследовании ФВД регистрируется положительная проба с бронхолитиком (увеличение ОФВ1 более чем на 12% после ингаляции с бронхолитиком и/или увеличение суммы прироста максимальных объемных скоростей выдоха (МОС25-75) на 37% и более).
Диагностика бронхиальной астмы (БА) у детей в возрасте до 5 лет представляет чрезвычайно сложную задачу. Диагноз основывается на жалобах на повторяющиеся кашель или хрипы, вызванные физической нагрузкой, кашель по ночам в отсутствие вирусной инфекции, данных анамнеза, указывающих на проявления атопии, отягощенной наследственности по БА или аллергии у родителей и осмотра. Симптомы бронхиальной обструкции провоцируются многочисленными триггерами и включают вирусные инфекции, внутренние и внешние аллергены, физическую нагрузку, табачный дым и загрязнение воздуха. Контакт с аллергеном у младенцев приводит к ранней сенсибилизации, а сочетание сенсибилизации с высокой экспозицией круглогодичных аллергенов в месте проживания приводит к персистированию симптомов бронхиальной обструкции. На фоне атопического дерматита и/или специфических IgE-антител к пищевым аллергенам возрастает риск сенсибилизации к ингаляционным аллергенам, что может быть прогностическим критерием для развития астмы. Нередко диагноз можно поставить только в процессе длительного катамнестического наблюдения, проведения дифференциальной диагностики и оценки реакции ребенка на бронхолитик и/или противовоспалительное лечение.
В развитии обструкции бронхов существенная роль принадлежит эпителию дыхательных путей. У больных БА снижается продукция бронходилатирующих факторов, обусловленная повреждением эпителия. Десквамация эпителия ведет к обнажению нервных окончаний, а воздействие на них медиаторов воспаления приводит к бронхиальной гиперреактивности и рефлекторному бронхоспазму.
Пассивный контакт с табачным дымом является наиболее существенным триггером развития рецидивирующего кашля/свистящего дыхания и симптомов астмы у детей, особенно в раннем возрасте. Курение матери во время беременности приводит к нарушению роста легких у развивающегося плода, что сочетается с формированием бронхиальной реактивности в раннем возрасте. Табачный дым увеличивает выраженность оксидативного стресса и повышает активность воспалительного процесса как в нижних, так и в верхних дыхательных путях, способствует персистированию заболевания.
Течение БА у детей и подходы к лечению существенно отличаются от таковых у взрослых. Подходы к лечению астмы у детей как до, так и старше 5 лет изложены в обновленных документах Всемирной инициативы по лечению астмы (GINA, 2014).
β2-Адренергические рецепторы обильно представлены в дыхательных путях и присутствуют на гладкомышечных клетках, эпителии, подслизистых железах, альвеолах, пресинаптических нервах и др. Принципиальное действие β2-агонистов состоит в стимуляции β2-адренергических рецепторов гладкой мускулатуры, ведущей к бронходилатации. Физиологическая функция β2-адренергического рецептора реализуется через увеличение уровня циклического аденозинмонофосфата (цАМФ) в клетке. Повышенные концентрации цАМФ, кроме расслабления гладких мышц бронхов, ингибируют высвобождение медиаторов реакции гиперчувствительности немедленного типа, особенно из тучных клеток, что важно у детей с атопией.
Нейротрансмиттер ацетилхолин, освобождающийся в холинергических нервных окончаниях, приводит к сокращению гладкой мускулатуры, усиливает секрецию подслизистых желез. Триггеры обострения, такие как гистамин, холодный воздух, физическая нагрузка, могут вызывать обструкцию путем прямого воздействия на рецепторы и активации холинергического пути, усиливая бронхиальную гиперреактивность. Гладкомышечные клетки дыхательных путей способны продуцировать интерлейкины, фактор роста и провоспалительные цитокины, которые могут инициировать и поддерживать воспаление. В ответ на сенсибилизацию в гладкомышечных клетках выделяется γ-интерферон, который может взаимодействовать с м2-рецептором, ингибируя его функцию, что ведет к увеличению выделения ацетилхолина.
При БА нарушается нормальный баланс между бронхоконстрикцией и бронходилатацией. При недостаточном бронхолитическом эффекте β2-агонистов дополнительное введение ипратропиума бромида, обладающего антихолинергическим действием, приводит к синергическому эффекту. Ипратропиума бромид блокирует м-холинорецепторы бронхов, устраняет бронхоконстрикторные влияния блуждающего нерва, при этом часть дозы аэрозоля, оседающая в полости рта и глотке и попадающая в желудок, плохо всасывается из ЖКТ, поэтому препарат практически не оказывает системного холиноблокирующего действия.
Широкое применение в медицине нашел комбинированный препарат, содержащий β2-адреномиметик фенотерол и холинолитик ипратропиума бромид. Механизм действия фенотерола связан с активацией сопряженной с рецептором аденилатциклазы, что приводит к увеличению образования цАМФ, который стимулирует работу кальциевого насоса. В результате снижается концентрация кальция в миофибриллах и происходит дилатация бронхов. Фенотерол расслабляет гладкую мускулатуру бронхов и сосудов и противодействует развитию бронхоспастических реакций, обусловленных влиянием гистамина, метахолина, аллергенов и холодного воздуха (реакция гиперчувствительности немедленного типа). Он блокирует высвобождение медиаторов воспаления и бронхообструкции из тучных клеток, а также усиливает мукоцилиарный клиренс, не подвергается метилированию и не трансформируется в метаболиты с β-блокирующей активностью. В свою очередь, ипратропиума бромид эффективно устраняет бронхоспазм, связанный с влиянием блуждающего нерва, уменьшает секрецию желез, в том числе бронхиальных. Комбинация этих веществ потенцирует бронхолитическое действие и увеличивает его продолжительность. Взаимодополняющее действие таково, что для достижения желаемого эффекта требуется более низкая доза β-адренергического компонента, что позволяет практически полностью избежать побочных эффектов.
По данным авторов Кокрановского сотрудничества (2013 г.), совместное применение ипратропиума бромида и β2-симпатомиметиков короткого действия у детей в возрасте 1–18 лет в качестве стартовой терапии среднетяжелой и тяжелой БА по сравнению с монотерапией β2-агонистами короткого действия сопровождалось значительным снижением риска госпитализации (рис. 1). Для предупреждения 1 госпитализации комбинацию ипратропиума бромида с β2 -симпатомиметиками короткого действия следовало назначить 16 пациентам (95%-ный доверительный интервал 12–29). В группе комбинированной терапии установлено также большее улучшение функции легких, лучшее насыщения крови кислородом, меньшая потребность в повторном использовании бронходилататоров до выписки из приемного покоя. Кроме того, переносимость комбинированной терапии была лучше: тошнота и тремор встречались статистически значимо реже, чем в группе монотерапии β2-агонистами короткого действия.
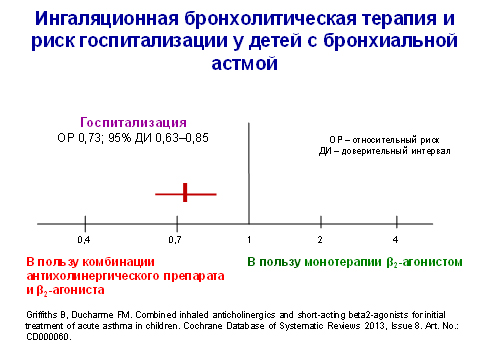
Рисунок 1.
У детей использование дозирующих аэрозольных ингаляторов с бронхоспазмолитическими препаратами нередко затруднено в связи с недостатками ингаляционной техники, связанными с возрастными особенностями, тяжестью состояния, что оказывает влияние на дозу, попадающую в легкие, и, следовательно, ответную реакцию. Небулайзерная терапия у детей занимает особое место, в связи с легкостью выполнения, высокой эффективностью, возможностью применения с первых месяцев жизни. Небулайзерная терапия за короткий период времени позволяет доставить терапевтическую дозу препарата в аэрозольной форме при любой степени тяжести приступа. Предпочтение отдается ингаляции через рот, что достигается путем дыхания через мундштук, у детей первых лет жизни может использоваться специально подобранная, плотно прилегающая маска. Продолжительность ингаляции 5–10 мин, до полного прекращения распыления препарата. Наличие различных форм доставки препарата фенотерол/ипратропиума бромид в виде как дозированного аэрозольного ингалятора, так и в виде раствора для небулайзера позволяет использовать препарат в различных возрастных группах, начиная с первого года жизни. Небольшая доза фенотерола в сочетании с антихолинергическим препаратом (1 доза — 50 мкг фенотерола и 20 мкг ипратропиума бромида) характеризуется высокой эффективностью и низкой частотой побочных эффектов. Раствор препарата фенотерол/ипратропиума бромид используется для ингаляций через небулайзер у детей до 6 лет в дозе 0,5 мл (10 капель) до 3 раз в сутки или 50 мкг фенотерола на кг массы тела на прием (но не более 0,5 мл), детям старше 6 лет – 10–20 капель до 4 раз в сутки. Рекомендуемая доза разводится физиологическим раствором.
В современном алгоритме неотложной терапии β2-агонисты представляют первую линию терапии обструкции бронхов при легкой, среднетяжелой и даже тяжелой астме, обеспечивая обратимость бронхоспазма. Лечение обострений астмы начинается независимо от того, где лечится пациент — дома, у врача общей практики или в стационаре:
- ингаляции короткодействующими β2-агонистами (спейсер): два или четыре вдоха (эквивалентно 200 мкг сальбутамола) каждые 10–20 минут в течение часа; при отсутствии улучшения — госпитализация;
- β2-агонисты через небулайзер (могут повторяться каждые 20–30 минут);
- комбинация растворов β2-агониста и ипратропиума бромида: ингалируется через небулайзер каждые 20–30 минут;
- кислород для обеспечения нормальной оксигенации;
- оральные/внутривенные стероиды: доза преднизолона — 1–2 мг/кг (обычно достаточно до 3 дней лечения).
При легком/среднетяжелом обострении ингаляции β2-агонистов короткого действия используют со спейсером большого объема (с лицевой маской у детей раннего возраста) (1 вдох каждые 15–30 с) или через небулайзер. При тяжелом приступе предпочтение отдается небулайзерной терапии. В том случае, когда больной получает плановую терапию и при этом сохраняется необходимость в дополнительном назначении ингаляционных симпатомиметиков, чаще всего стоит вопрос о неадекватности проводимой терапии. Использование ингаляционных симпатомиметиков должно сводиться к минимуму и назначать их следует по потребности как средство «скорой помощи», так как течение контролируемой БА, как правило, не требует их частого применения. Чувство улучшения, возникающее на фоне лечения β2-агонистами, не должно вести к прерыванию противовоспалительной терапии. Осторожность в назначении β-агонистов на регулярной основе обусловлено и опасениями развития тахифилаксии к бронходилататорам.
У маленьких детей с ограниченным вентиляционным резервом риск развития дыхательной недостаточности наибольший. Если состояние прогрессивно ухудшается и не поддерживается достаточная оксигенация, ребенок должен быть переведен в отделение интенсивной терапии.
Повышение активности парасимпатических нервов у детей с БА встречается при БОС, вызванном вирусной респираторной инфекцией. Для него характерны обратимая обструкция дыхательных путей, гиперсекреция слизи, вазодилатация и повышение проницаемости сосудов. В экспериментальных исследованиях продемонстрирована дисфункция м2-рецепторов на модели бронхиальной гиперреактивности, индуцированной различными триггерами, включая вирусы, атмосферные поллютанты и аллергены. Эти механизмы объясняют эффективность ингаляций ипратропиума бромида при наиболее распространенных заболеваниях дыхательных путей у детей. Антихолинергические препараты и их комбинации с β2-адреномиметиками рекомендуются при БОС у детей первых лет жизни. М-холинорецепторы сформированы с раннего возраста и потому у детей острые респираторные вирусные инфекции сопровождаются частым развитием обструкции, обусловленной отеком бронхов и продукцией очень вязкого бронхиального секрета. Поэтому применение в качестве бронхолитиков препаратов с антимускариновым действием у данной группы пациентов представляется весьма перспективным. Индуцированная вирусом (чаще риновирусами) бронхиальная обструкция связана в первую очередь с образованием большого количества медиаторов воспаления, которые раздражают окончания блуждающего нерва с блокадой м2- и активацией м1- и м3-холинорецепторов, что приводит к развитию парасимпатической гиперчувствительности. Этот эффект может сохраняться в течение нескольких недель после разрешения острой инфекции.
По данным авторов Кокрановского сотрудничества (2014), применение антихолинергических средств через небулайзер в дополнение к β2 -симпатомиметикам короткого действия не сокращает сроки пребывания в стационаре госпитализированных детей с БА (рис. 2) и не улучшает другие показатели ответа на лечение (потребность в дополнительном назначении противоастматических средств, функцию легких и т.д.). Поэтому в действующих международных рекомендациях по лечению БА не рекомендуется использование ингаляций антихолинергических средств у госпитализированных детей с обострением заболевания (Всемирная инициатива по лечению астмы – GINA, 2014). К сожалению, в настоящее время невозможно говорить о каком-либо влиянии комбинированной терапии антихолинергическим препаратом и β2-симпатомиметиком короткого действия на длительность пребывания детей с БА в отделениях реанимации и интенсивной терапии – в связи с отсутствием подобных исследований.
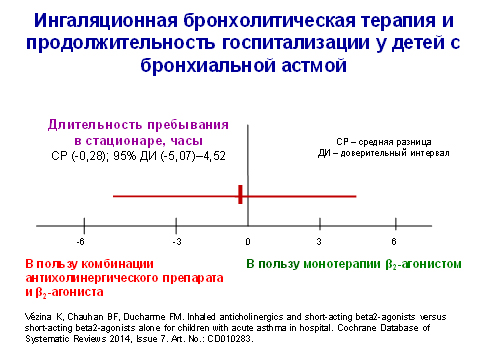
Рисунок 2.
Ингаляции фиксированной комбинации фенотерол/ипратропиума бромид могут дополняться введением амброксола со 2–3 дня обострения, что обеспечивает более быстрое купирование бронхообструкции в связи с улучшением бронхиальной проходимости вследствие более быстрого отхождения мокроты, отхаркивающего эффекта препарата, ускоряющего мукоцилиарный клиренс, уменьшающего вязкость мокроты.
В педиатрической практике фиксированную комбинацию фенотерол/ипратропиума бромид можно использовать у детей старше 12 лет в той же дозировке, что и у взрослых; у детей 6–12 лет при обострениях легкой и средней степени тяжести применяется доза 0,5–1 мл, в случае тяжелого обострения она может быть увеличена до 2 мл. Максимальная доза препарата для детей составляет 3 мл и используется исключительно в условиях стационара. Рекомендованную дозу фиксированной комбинации непосредственно перед применением разводят физиологическим раствором до объема 3–4 мл и ингалируют через небулайзер в течение нескольких минут, пока раствор не будет израсходован полностью. В случае необходимости повторные ингаляции проводятся с интервалом не менее 4 ч.
С учетом вышесказанного, фиксированная комбинация фенотерол/ипратропиума бромид является эффективным средством для купирования острого БОС, развивающегося у больных БА и при других клинических ситуациях. Этот оригинальный комбинированный препарат, несмотря на появление новых бронхолитиков длительного действия, по-прежнему занимает достойное место в лечении больных БА прежде всего в амбулаторной практике. Являясь высокоэффективным и безопасным лекарственным средством, фиксированная комбинация фенотерол/ипратропиума бромид показана для профилактики и симптоматического лечения заболеваний дыхательных путей, сопровождающихся обратимой бронхиальной обструкцией.
Список литературы:
1. Бронхообструктивный синдром у детей. Учебное пособие для врачей-интернов, клинических ординаторов, врачей-педиатров.//Сероклинов В. Н., Фёдоров А. В. Барнаул, 2010.
2. Практическая пульмонология детского возраста: справочник / под ред. В.К. Таточенко. – 3-е изд. – М., 2006. – с. 24-25, 85.
3. Зайцева О.В. Инфекции респираторного тракта у детей раннего возраста / под ред. Самсыгиной Г.А. – М., 2006. – с. 142-182.
4. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика» – М., 2008. – 108 с.
5. Гавалов С.М., Зеленская В.В. Особенности клинических проявлений и течения различных форм бронхолегочной патологии у детей с малыми формами дисплазии соединительной ткани / Педиатрия, 1999, №1, с. 49-52.
6. Демин В.Ф., Ключников С.О., Ключников М.А. Значение соединительно-тканных дисплазий в патологии детского возраста / Вопросы современной педиатрии, 2005, т. 4, №1, с. 50-56.
7. Коровина О.В., Гаспарян Э.Г., Ласкин Г.М. Бронхообструктивный синдром как «маска» гипотиреоза / Тез. Докл. 6 нац. Конгресса по бол. орг. дых. – М., 1996. – №2144.
8. Котлуков В.К., Блохин Б.М., Румянцев А.Г., Делягин В.М., Мельникова М.А. Синдром бронхиальной обструкции у детей раннего возраста с респираторными инфекциями различной этиологии: особенности клинических проявлений и иммунного ответа / Педиатрия №3, 2006, с. 14-21.
9. Котлуков В.К., Бычков В.А., Кузьменко Л.Г., Блохин Б.М. Упорно рецидивирующая обструкция бронхов у часто болеющих детей раннего возраста без атопии / Педиатрия №5, 2006, с. 42-47.
10. Кухтинова Н.В. Респираторный хламидофиллез. Гл. 5 в кн. «Хламидиоз ↔ дисбиоз, интегральные взаимоотношения» / Под ред. Гавалова С.М. – Новосибирск, 2003. – с. 99-142.
11. Харламова Ф.С., Легкова Т.П., Фельдфикс Л.И., Гриненко Н.А., Чернова Е.В., Чувиров Г.Н., Учайкин В.Ф. Иммунокорригирующая и противовирусная терапия персистирующей герпетической инфекции у детей с рецидивирующим крупом и обструктивным бронхитом / Педиатрия №4, 2007, с. 73-78.
12. Global Initiative for Asthma (GINA). Pocket guide for asthma management and prevention (for children 5 years and younger). Revised 2014. Доступно на сайте www.ginasthma.org
13. Griffiths B., Ducharme F.M. Combined inhaled anticholinergics and short-acting beta2-agonists for initial treatment of acute asthma in children. Cochrane Database of Systematic Reviews 2013, Issue 8. Art. No.: CD000060.
14. Vézina K, Chauhan BF, Ducharme FM. Inhaled anticholinergics and short-acting beta2-agonists versus short-acting beta2-agonists alone for children with acute asthma in hospital. Cochrane Database of Systematic Reviews 2014, Issue 7. Art. No.: CD010283.
15. Овчаренко С.И. Беродуал и его место в лечении больных бронхиальной астмой. Астма и аллергия 2013; 3: 15–19.






