Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "МИОКАРДИОДИСТРОФИЯ (ВТОРИЧНАЯ КАРДИОПАТИЯ) У ДЕТЕЙ"
Автор: Пшеничная Е.В.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Педиатрия/Неонатология
Просмотров: 4 457
Дата проведения: с 18.11.2014 по 18.11.2015
Актуальность проблемы. В настоящее время в структуре сердечно-сосудистых заболеваний у детей значительно возрос удельный вес неспецифических поражений миокарда невоспалительного генеза. Необходимость изучения метаболических заболеваний миокарда в педиатрии обусловлена широкой распространенностью этой патологии у детей и подростков, увеличением частоты метаболических заболеваний сердечной мышцы на фоне неблагоприятной экологической ситуации. Сложность диагностики миокардиодистрофии также объясняется отсутствием патогномоничной клинической симптоматики и длительным бессимптомным течением миокардиодистрофии (Острополец С.С. 1989, Василенко В.Х. 1989, Бисярина В. П. 1989, Лебедькова С.Е. 1998, Кушаковский М.С. 2000, Леонтьева И.В. 2005, Тутельман К.М., 2008). Крайне важным следует считать выделение стадий заболевания, определение лечебной тактики, прогноза течения миокардиодистрофии.
Общая цель: уметь диагностировать и определить тактику ведения ребенка с миокардиодистрофией.
Конкретные цели: выделить основные признаки миокардиодистрофии, составить план обследования больного, провести дифференциальную диагностику, поставить наиболее вероятный клинический диагноз, определить план лечебно-профилактических мероприятий ребенка с миокардиодистрофией.
Содержание обучения
Теоретические вопросы
1. Определение, классификация миокардиодистрофии.
2. Этиопатогенез миокардиодистрофии у детей.
3. Современные методы обследования детей с миокардиодистрофией.
4. Принципы лечения миокардиодистрофии в детском возрасте.
5. Прогноз клинического течения миокардиодистрофии у детей.
6. Меры профилактики миокардиодистрофии у детей.
Ориентировочная основа деятельности
Во время подготовки к занятию необходимо ознакомиться с основными теоретическими вопросами с помощью источников литературы.
Терминология
Для обозначения поражения миокарда метаболического генеза в настоящее времени используются различные термины. Ими являются: миокардии, миокардозы, миокардиодистрофия, метаболическая кардиомиопатия. Этот факт создает значительные трудности для обобщения данных литературы по этой проблеме и унифицированного накопления статистических данных о распространенности и клинических особенностей течения данной патологии.
Термин метаболические кардиомиопатии используется в англоязычной литературе для обозначения группы обменных повреждений миокарда, причины которых не установлены и возможно связаны с дефектами метаболизма миокарда на молекулярном уровне.
Термин миокардиодистрофия наиболее часто используется в отечественной кардиологии. Этот термин происходит от греческих слов туоs – мышца, каrdiа – сердце и distrophe – нарушенное питание. Он был предложен великим русским клиницистом Г.Ф. Лангом. Термин отражает заболевание сердца, в основе которого лежит нарушение метаболизма в миокарде.
В настоящее время наиболее приемлемым является определение миокардиодистрофии как заболевания сердца, в основе которого лежит нарушение метаболизма в миокарде. Миокардиодистрофию характеризует первичное по отношению к морфологическим изменениям миофибрил и обратимое на ранних стадиях нарушение обмена веществ, образования транспорта и утилизации энергии в миокарде, приводящее к дистрофическим изменениям в кардиомиоцитах и проводящей системе сердца, что может привести к снижению сократительной функции сердца.
Эпидемиология
Необходимость изучения проблемы метаболических заболеваний миокарда в педиатрии обусловлена широкой распространенностью этой патологии у детей и подростков. В настоящее время на фоне неблагоприятной экологической ситуации отмечается негативная тенденция к увеличению частоты метаболических заболеваний сердечной мышцы в структуре сердечно-сосудистой патологии. По данным популяционных исследований на ее долю приходится от 3 до 15% среди сердечно-сосудистых заболеваний в детском возрасте (Лебедькова С.Е., Дембо А.Г.). Однако отсутствие единого подхода к определению поражения миокарда метаболического генеза создает значительные трудности для унифицированного накопления статистических данных о распространенности и клинических особенностях течения данной патологии.
Этиология
До настоящего времени этиология миокардиодистрофии остается до конца неизученной. Согласно современным представлениям, миокардиодистрофия рассматривается как мультифакториальный процесс.
Василенко В.X. и соавт. (1989) выделяют десять основных причин дистрофии миокарда:
1) анемия;
2) недостаточное питание, ожирение;
3) витаминная недостаточность;
4) поражение печени, почек;
5) нарушения отдельных видов обмена веществ;
6) заболевания эндокринной системы;
7) системные заболевания;
8) интоксикации;
9) физическое перенапряжение;
10) инфекции.
В последнее время в литературе встречаются указания на возможные генетически обусловленные молекулярные дефекты обмена веществ в клетках миокарда, которые могут послужить причиной развития метаболических болезней сердца (Кушаковский М.С., 2000). Можно высказать предположение, что некоторые варианты дистрофий миокарда с самого начала формируются как первичные заболевания, а в остальных случаях миокардиодистрофия носит всего лишь синдромальный характер.
Патогенез
Патогенез разнообразных дистрофических очаговых и диффузных изменений в миокарде неоднозначен. «Основной» преобладающий патогенетический механизм развития дистрофии миокарда можно выделить только в ряде случаев, а чаще задействовано несколько патогенетических механизмов.
Сердце, наряду с мозгом и почками, относится к органам, наиболее чувствительным к дефициту клеточной энергии, при котором нарушаются пластические процессы и структура клеток сердца.
Условно можно выделить три группы состояний, приводящих к нарушению обменных процессов в миокарде:
1) уменьшение поступления энергетических субстратов;
2) нарушение клеточного дыхания и окислительного фосфорилирования;
3) повышение энергетических потребностей миокарда.
Недостаточное поступления субстратов энергетического процесса может встречаться при разнообразной патологии: алиментарная дистрофия, нарушение кишечного всасывания, печеночная недостаточность, эндокринопатии. При этом дистрофия миокарда носит вторичный характер.
Нарушение клеточного дыхания и окислительного фосфорилирования может носить первичный и вторичный характер.
Первичная патология клеточного дыхания и окислительного фосфорилирования генетически детерминирована и обусловлена:
1) нарушениями переноса электронов в митоходриальной цепи дыхательных ферментов;
2) нарушениями энзимных реакций энергетического обмена;
3) патологией цикла трикарбоновых кислот.
Причиной вторичной патологии могут являться нарушения электролитного баланса, экзогенные интоксикации, хронические инфекции, эндокринопатии.
Тканевая гипоксия является одной из наиболее частых причин нарушения энергетического баланса. Она характеризуется разобщением клеточного дыхания и фосфорилирования. По происхождению выделяют несколько форм гипоксии:
1) экзогенная (снижение р02 во вдыхаемом воздухе);
2) дыхательная (при патология органов дыхания);
3) циркуляторная (при патологии сердечно-сосудистой системы);
4) гемическая (при анемии различного генеза, метгемоглобинемии);
5) тканевая (при повреждении дыхательной цепи, патологии цикла трикарбоновых кислот в клетке и т.д.).
Все варианты гипоксии в изолированной форме встречаются редко, возникшая гипоксия одного типа в дальнейшем приобретает смешанный характер. Гипоксия и собственно энергетический дефицит, являются мощным стрессорным фактором в организме. Они активируют систему адренокортикоидный гормон – глюкокортикоиды, усиливают симпатико-адреналовые влияния.
Хроническое кислородное голодание приводит к сдвигу гликолиза в анаэробную сторону: снижению поступления ацетилкоэнзима А в цикл Кребса, накоплению лактата и, тем самым, к снижению производства макроэргов, недостатку химической энергии.
При гипоксии нарушается и жировой обмен, происходит снижение окисления жирных кислот, усиление их эстерификации, отложение триглицеридов, липофосфатидов в миоплазме. В то же время, отмечается усиление перекисного окисления липидов, в результате происходит накопление гидроперекисей, взаимодействующих с различными клеточными структурами, что приводит к разрыву клеточных мембран митохондрий, саркоплазматического ретикулума, лизосом, сарколеммы. Усиление перекисного окисления липидов также отрицательно сказывается и на микроциркуляции, что проявляется повреждением эндотелия, отложением в стенке сосудов PAS-положительных веществ, утолщением базальной мембраны и последующим гиалинозом стенки сосудов.
Возникающие на фоне гипоксии внутриклеточный ацидоз, избыток жирных кислот и липофосфатидов приводят к нарушению ультраструктурной организации мембран (сарколеммы, мембран Т–систем, мембран лизосом). Освобождение лизосомальных протеаз ведет к аутолизу субклеточных структур. Данные процессы могут приводить к повреждению ультраструктуры и разрушению «энергетических станций» клетки – митохондрий. Энергия, полученная в результате окисления, не аккумулируется в виде макроэргов (АТФ, КФ), а расходуется в виде тепла.
Расстройства субстратного и витаминного обеспечения миокарда – частая причина нарушения клеточной энергетики в миокарде. Дефицит или напротив – избыток глюкозы, жирных кислот, витаминов, аминокислот всегда отражается на метаболизме клеток сердца и может приводить к нарушению генерации энергии и дистрофии миокарда. Подобные состояния встречаются при эндокринопатиях, расстройствах пищеварения и нарушениях функции печени, тубулярной патологии почек, голодании, ожирении.
Состояния, сопровождаемые расстройствами электролитного обмена и кислородно-основного состояния, могут явиться причиной развития энергетического дефицита и дистрофии миокарда. Особенно часто данные состояния развиваются при гипо- или гиперкалиемии, гипер- и гипокальцемических состояниях, при нарушениях функции щитовидной железы, надпочечников, гипоталамуса.
Гипоксия является также одной из причин нарушений ионного баланса. Гипоксия сопряжена с уменьшением образования АТФ, что сопровождается снижением активности K /Na –зависимой АТФазы и лимитирует функционирование электрогенного насоса мембран. Ионы начинают перемещаться по градиенту концентрации (К во внешнюю среду, а Na внутрь клетки). Возникновение электролитного дисбаланса в клетке с потерей ионов калия кардиомиоцитами и накопление данного иона в экстрацеллюлярной среде приводит к снижению потенциала покоя, а увеличение внутриклеточной концентрации ионов натрия способствует уменьшению длительности потенциала действия. Нарушение концентрации ионов в интра- и экстрацеллюлярном пространствах ведет к гиперосмии – отеку клетки. Гипокалигистия является причиной возникновения некрозов миокарда и сердечных аритмий.
Повышенные энергетические потребности миокарда, способствующие развитию его дистрофии в связи с гиперфункцией, могут встречаться на фоне состояний, требующих избыточных энергетических затрат от миокарда. Гиперсимпатикотония приводит к повышенным энергетическим потребностям миокарда, что сочетается с ослаблением биологического окисления и нарушением его эффективности.
Избыточное адренергическое воздействие на клетки миокарда сопровождается неэкономным внутриклеточным расходованием кислорода с одновременным уменьшением выхода АТФ, что приводит к нарушению процессов окислительного фосфорилирования и развитию гипоксии миокарда.
Любое стрессорное состояние (физическое перенапряжение, гипо- и гипертермия, травма, голодание, боль, психоэмоциональное напряжение) может приводить к чрезмерной активации симпатикоадреналовой системы, гипоксии, энергетическому дефициту. При этом активируется процесс перекисного окисления, нарушаются состояния клеточных структур саркоплазматического ретикулума и цепи дыхательных ферментов. Это наиболее часто возникает на фоне физического перенапряжения. Для обеспечения высокого уровня физической активности необходимы повышенные энергозатраты, что сопровождается избыточными симпатикотоническими влияниями.
Низкая двигательная активность в сочетании с большим эмоциональным перенапряжением также способствуют углублению вегетативной дисфункции. Вегетативный дисбаланс на фоне нейроэндокринной перестройки, может приводить к нарушениям микроциркуляции, коронарным расстройствам, метаболическим или электролитным нарушениям, тем самым, способствуя развитию дистрофических изменений в миокарде. Длительная гипокинезия или инфекционные заболевания (в периоде реконвалесценции), при которых снижаются функциональные резервы сердца, могут служить фоном для физического перенапряжения и при этом даже небольшая нагрузка может стать чрезмерной.
Причиной гиперфункции миокарда также являются состояния, обусловленные повышенной постнагрузкой на сердце, что наблюдается при стойкой артериальной гипертензии, а также при таких врожденных пороках сердца, как аортальный стеноз, коарктация аорты. Данные состояния приводят к диспропорции между повышенной потребностью в необходимых веществах и их реальным поступлением.
Нарушение центрального контроля за трофикой тканей следует считать еще одним патогенетическим механизмом дистрофии миокарда. Располагая «многоэтажными» афферентными системами, сердце, а точнее его внутрисердечный нервный аппарат, связан практически со всеми информативно-регулирующими подкорковыми структурами, с лимбической областью и корой головного мозга. В этих случаях нарушение обмена веществ в кардиомиоцитах может быть обусловлено нарушениями микроциркуляции и иннервации сердца, либо усиленной работой сердца.
В совокупности все указанные механизмы ведут к дистрофии миокарда, независимо от этиологии процессов их вызывающих. Степень вариабельности данных процессов может приводить либо к умеренному обратимому нарушению функционирования метаболизма и структуры миокарда, либо к возникновению очагов некроза, которые в дальнейшем подвергаются рубцеванию и становятся основой некоронарогенного кардиосклероза.
Патоморфология
Кардиомиоциты, являющиеся высокодифференцированными и долгоживущими клетками сердца, отвечают на действия различных патогенных агентов стереотипными реакциями. Одним из важных резервных механизмов, обеспечивающих приспособительную гиперфункцию ультраструктур, является их функциональная гетерогенность. Для деятельности всех ультраструктур клетки характерен свой ритм рабочего цикла, который представляет собой периодическую смену состояний функциональной активности и относительного покоя. В условиях повышенной функциональной активности клеток и ультраструктур, например митохондрий, происходит усиленное расходование энергетического и пластического материала, а в состоянии покоя – их восстановление. По мнению Саркисова Д.С. (1981), ультраструктурный механизм дистрофии органов является нарушением принципа «перемежающейся активности функционирующих структур», когда в деятельность включаются все ультраструктуры, выпадает период их относительного покоя и восстановления.
Многочисленные работы по изучению миокарда с помощью электронной, люминесцентной и поляризационной микроскопии, гистохимических и гистотопографических исследований выявили признаки «дистрофии миокарда» в виде внутриклеточного миоцитолиза, контрактурного повреждения и первичного глыбчатого распада миофибрилл (Саркисов Д.С., 1969; Вайль С.С., 1976; Целлариус Ю.Г., Семенова Л.А., 1978). В различные фазы миолиза вакуольная дистрофия, мелкокапельное ожирение наблюдаются как в единичных кардиомиоцитах, так и в их группах. Мозаичность дистрофических изменений проявляется даже в пределах миокардиальной клетки, в изолированном повреждении клеточных органелл или мембран. При развитии миолиза органеллы погибших клеток приобретают антигенные свойства и развивается аутоиммунная реакция с образованием комплексов антиген – антитело (Палеев Н.Р., 1982). Воздействие этих комплексов приводит к усиленному высвобождению биологически активных веществ (гистамина, серотонина, гепарина, ацетилхолина и пр.) лимфоцитами, макрофагами, лейкоцитами, тромбоцитами. Биологически активные вещества нарушают структуру микрососудов, вызывая сокращение эндотелиальных клеток, что приводит к нарушению проницаемости сосудистой стенки, развитию геморрагий и отека. Наблюдается, в сущности, картина аллергического воспаления (аллергического повреждения) миокарда. Деструкция органелл кардиомиоцита характеризуется набуханием и вакуолизацией митохондрий, просветлением их матрикса, разрушением крист, истончением и деформацией миофибрилл, расширением канальцев саркоплазматической сети. В результате повреждения митохондрий появляются осмиофильные гранулы, представляющие собой отложения солей кальция и неорганического фосфата. В ряде кардиомиоцитов отмечаются разрушения мембран (плазмолеммы и органелл), которые проявляются образованием цитоплазматических отростков из плазмолеммы кардиомиоцита, ее утолщением. Наблюдается образование микропор в ядерной мембране и сарколемме, очаговые разрушения мембран крист митохондрий и лизосом. Происходит активация заключенных в лизосомах протеолитических ферментов, что вызывает денатурацию белка органелл, т.е. миолиз.
Дистрофия миокарда может быть очаговой, послойной, захватывать стенки только одного из желудочков, при этом морфологические проявления этих повреждений неоднородны в различных очагах.
Поражение мышечных волокон при дистрофии сочетается с изменениями стромы, нарушениями микроциркуляции (в кровеносном и лимфатическом руслах) и иннервации сердца. В капиллярах мышечной стромы может определяться деструкция эндотелия в виде вакуолизации цитоплазмы, истончения цитоплазматических отростков. Повреждение эндотелия на отрезке микроциркуляторного русла является ведущим фактором гипоксии.
Определенную роль в развитии повреждения кардиомиоцита играют изменения иннервационного аппарата в условиях гипоксии и ацидоза. Они проявляются дистрофией нервных межмышечных стволиков и окончаний, демиелинизацией и распадом миелиновых оболочек, формированием миелиноподобных телец. В нервных окончаниях наблюдаются расслоение и фрагментация миелиновых пластин. Терминальные веточки становятся утолщенными, окончания погружены в саркоплазму. Исследование этих структур методом люминесцентной микроскопии показало специфическое желтоватое свечение норадреналина в подходящих к кардиомиоциту нервных окончаниях.
Не вызывает теперь сомнения и возможность эволюции некробиотических и дистрофических изменений миокарда в мелкоочаговый фиброз, сопровождающийся компенсаторной гипертрофией мышечных клеток в окружности даже незначительных фокусов склероза (Вайль С.С., 1976).
Следует помнить, что структурные изменения могут возникать раньше или одновременно с функциональными, но никогда не развиваются позже них (Саркисов Д.С., 1984). В настоящее время признана правомочность представлений о гипертрофии и кардиосклерозе, как исходах дистрофического состояния миокарда.
Классификация
В основу классификации миокардиодистрофии положен преимущественно этиологический фактор, также учитывается характер течения заболевания. Одна из наиболее подробных современных классификаций дистрофии миокарда с учетом не только этиологического фактора и характера течения процесса, но и механизмов нарушения реполяризации предложена Кушаковским М.С. в его монографии «Метаболические болезни сердца»(2000 г.).
Классификация миокардиодистрофии (М.С. Кушаковский, 2000)
I. Этиология (наименование формы)
1. Алкогольная.
2. Дисовариальная (климактерическая)
3. Дисэлектролитая.
4. Нейрогенная.
5. Эндокринно-обменная.
6. Диспротеинемическая.
7. Анемическая.
8. Токсическая.
9. Тонзиллогенная.
10. При физическом напряжении («спортивная»).
11. При физических воздействиях на сердце («тупые» травмы, радиация).
12. Инфильтративная.
13. При системных нейромышечных заболеваниях.
14. Послеродовая.
II. Характер течения, формирование кардиосклероза
1. Острое, возможно с развитием сердечной недостаточности, подострое.
2. Хроническое, необратимое (кардиомегалия, фиброз, гипертрофия).
3. Острое с развитием сердечной недостаточности.
III. Механизмы нарушения реполяризации
(устанавливаются фармакологическими электрокардиографическими пробами)
1. Калиевый тип.
2. Адренергический тип.
3. Недостаточная стимуляция катехоламинами.
4. Токсический тип.
Острополец С.С. предложил классификацию миокардиодистрофий у детей с учетом этиологии, характера течения заболевания и развития осложнений в виде сердечной недостаточности. Согласно этой классификации, в зависимости от этиологии выделяют 7 форм миокардиодистрофии.
1. Интоксикационные:
a) острые инфекционные заболевания;
b) очаги хронической инфекции;
c) отравления.
2. Дисметаболические:
a) дистрофии;
b) гипо-, гипервитаминозы;
c) анемии;
d) энзимопатии.
3. Нейровегетативные.
4. Гормональные:
a) эндокринные заболевания;
b) возрастной пубертатный дисгормоноз.
5. Аллергические.
6. Гиперфункциогенные.
7. Смешанного генеза.
По характеру течения выделяется 3 формы: транзиторная (до 1 месяца), стойкая (до 1 года), хроническая (более года). Также указывается степень недостаточности кровообращения (НКо, НК I, НК IIа степени).
Клиника
Дистрофия миокарда не имеет специфической клиники. Симптомы миокардиодистрофии нередко маскируются, уходят на второй план, на фоне проявлений основного заболевания. Клиническая картина дистрофии миокарда является выражением нейротрофических расстройств со стороны сердечно-сосудистой системы. Жалобы, с которыми родители и дети обращаются к врачу, отличаются чрезвычайным полиморфизмом. Их характер, в определенной мере, обусловлен преобладанием активности того или иного отдела вегетативной нервной системы, проявлением вегетативной дисфункции.
Боли в области сердца экстракардиального генеза являются наиболее частой жалобой, они чаще кратковременные, приступообразные, колющего характера, иногда – более продолжительные, ноющие, редко могут иррадиировать в область левой лопатки. Возникают кардиалгии обычно в связи с эмоциональными перенапряжениями, реже – с физической нагрузкой. Некоторые дети жалуются на неприятные ощущения, «чувство тяжести» в области сердца, чувство неполноты вдоха или одышку при физической нагрузке (быстрой ходьбе, подъеме на лестницу). Нередко кардиалгии сочетаются с другими вегетативными нарушениями – сердцебиением при эмоциональном напряжении, головокружением, раздражительностью, неустойчивым настроением.
Другая группа жалоб определяется основным заболеванием. Так, довольно частыми жалобами детей с хроническими заболеваниями лор-органов, составляющими высокий удельный вес в структуре интоксикационной дистрофии миокарда, являются указания на частые простудные заболевания, артралгии, миалгии и др. При заболеваниях желудочно-кишечного тракта и желчевыводящих путей пациентов беспокоят снижение аппетита, боли в животе, тошнота.
В то же время некоторые дети жалоб вообще не предъявляют, сохраняя удовлетворительную физическую активность. Изменения со стороны сердца у них являются случайной находкой врача, который диагностирует в этих случаях «функциональный шум», «функциональные изменения со стороны сердца» и только тщательное обследование ребенка помогает уточнить природу выявленной симптоматики.
Следует помнить об отсутствии строгого параллелизма между сердечно-сосудистыми расстройствами и клиническими проявлениями основного заболевания. В ряде случаев субъективные нарушения превалируют над объективными признаками патологии сердца.
Физикальные изменения. Аускультативно у абсолютного большинства детей над верхушкой определяется приглушенность I тона. Во II межреберье слева, особенно в пре- и пубертатном возрасте может регистрироваться акцент II тона. Над верхушкой и в V точке определяется систолический шум, разнообразный по интенсивности, длительности и тембру, однако, за пределы сердца он, как правило, не проводится. Шум яснее выслушивается в горизонтальном положении, ослабевает или исчезает после нагрузки. У большинства детей с дистрофией миокарда границы сердца соответствуют возрастным нормам. Только в случаях остро развивающейся дистрофии миокарда перкуторно и с помощью инструментальных методов исследования выявляется расширение сердца в поперечнике, степень которого зависит от тяжести патологического процесса. При этом необходимо проводить дифференциальную диагностику с миокардитом.
Клиническим проявлением нейрогуморальных расстройств также является лабильность пульса, выявляемая при перемене положения, физической нагрузке, хотя в покое частота сердечных сокращений у большинства детей соответствует физиологическим нормативам. В ряде случаев может регистрироваться тахикардия. Уточнить ее генез можно с помощью подсчета частоты сердечных сокращений во время сна и при выполнении функциональных проб. При неврогенной тахикардии в обоих случаях пульс урежается на фоне проб с рефлекторным повышением тонуса блуждающего нерва (проба Вальсальвы, рефлекс Ашнера, раздражение корня языка и др.), а также во сне. Одышка может возникать только при большом физическом напряжении.
При анемии часто выслушивается систолический шум над верхушкой и легочной артерией; при тиреотоксикозе нередки боли в области сердца, выраженная тахикардия, повышение систолического и пульсового давления; при микседеме – одышка, редкий пульс, гипотензия, глухость сердечных тонов, рано появляются признаки сердечной недостаточности.
На ранних стадиях дистрофии миокарда отсутствуют гемодинамические признаки сердечной недостаточности. Однако при ее прогрессирующем течении постепенно к симптоматике заболевания могут присоединяться одышка и тахикардия в покое, нарушения сердечного ритма и т.д. По мнению Кушаковского М.С. (2000), эти признаки появляются лишь в фазе фиброза миокарда.
Диагностика
Клинико-анамнестическое и генеалогическое обследование. При сборе анамнеза собираются сведения о наследственной отягощенности по сердечно-сосудистым заболеваниям в семье, при этом необходимо уточнить возраст манифестации сердечно-сосудистой патологии у родственников. Анализируется течение беременности и родов с целью выявления возможной перинатальной патологии. Необходимо выяснить наличие конфликтных ситуаций в семье и школе, способствующих хроническому психоэмоциональному напряжению, сопровождающемуся избыточными симпатикотоническими влияниями. Большое внимание следует уделять нарушению режимных моментов (недосыпание), а также семейным пищевым традициям (нерегулярное, несбалансированное питание). Необходимо оценить уровень физической активности: гиподинамия или напротив повышенный уровень физической активности – занятия в спортивных секциях, что может привести к синдрому спортивного перенапряжения.
Электрокардиография является основным методом диагностики дистрофических изменений в миокарде. Следует отметить, что многообразные нарушения метаболизма сердечной мышцы сопровождаются однотипными изменениями конечной части желудочкового комплекса ЭКГ.
Критериями ЭКГ-диагностики дистрофии миокарда являются изменения «обменного участка», а именно – SТ-Т комплекса (рис. 1):
¾ снижение, уплощение или инверсия волны Т;
¾ смещение интервала SТ более чем на 1,5 мм выше или 0,5 мм ниже изолинии.
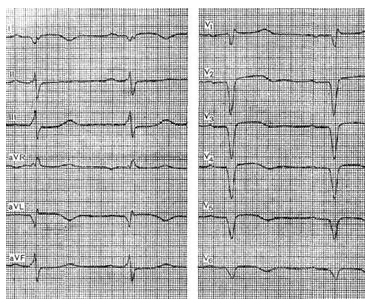
Рисунок 1. ЭКГ при миокардиодистрофии
Одним из ранних признаков дистрофического поражения миокарда может являться изменение зубца Р в виде снижения амплитуды, уширения, изменения формы (появления зазубренности, двувершинности, изредка – двухфазности).
Изменения конечной части желудочкового комплекса, а именно полярности зубца Т, в некоторых случаях, можно объяснить неравномерностью процесса реполяризации в соседних мышечных группах, что приводит к формированию двухфазных (- ) или ( -) неравносторонних или двугорбых, уширенных зубцов Т.
Наиболее существенными факторами, вызывающими изменения SТ-Т комплекса, являются катехоламины и другие симпатомиметики. Избыточные эффекты катехоламинов отражаются на ЭКГ в виде инверсии или сглаженности зубца Т.
Также на ЭКГ при дистрофии миокарда встречаются деформация комплекса QRS по типу QS или QrS, уменьшение вольтажа комплекса QRS, нарушения проводимости (синдром слабости синусового узла, атриовентрикулярная блокада 1-й степени, блокада правой ножки пучка Гиса, другие нарушения внутрижелудочковой проводимости). Возможна комбинация вариантов.
При дисэлектролитных синдромах: гипер- и гипокалиемии, гипер- и гипокальциемии ЭКГ-признаки дистрофии миокарда носят специфический характер.
Гиперкалиемия вызывает изменения на ЭКГ, затрагивающие как процессы реполяризации (SТ-Т комплекс), так и процессы деполяризации (расширение QRS комплекса). При гиперкалиемии первыми на ЭКГ появляются высокие, заостренные зубцы Т, названные в англоязычной литературе «tented» или «pinched» сдвиг.
При дальнейшем увеличении уровня калия PR интервал удлиняется, при этом амплитуда Р волны уменьшается и может совсем не определяться. Дальнейшее повышение уровня калия приводит к нарушению внутрижелудочкового проведения, что отражается в расширении QRS комплекса. Наиболее опасным проявлением гиперкалиемии могут явиться асистолия и внезапная смерть.
Гипокалиемия. Характеризуется выраженными изменениями ST-T комплекса: депрессия сегмента ST, инверсия и/или сглаженность зубца Т, появление выраженной волны U, которая в ряде случаев имеет более высокую амплитуду, чем Т.
Гиперкальциемия. Продолжительность реполяризации желудочков укорачивается, характерен короткий интервал QT, обусловленный укорочением сегмента ST. Зубец Т появляется сразу после QRS комплекса.
Гипокальциемия. Реполяризация желудочком удлинена. Характерен удлиненный интервал QT, обусловленный удлинением сегмента ST.
Эхокардиографическое исследование в последние годы вошло в обязательный диагностический ряд большинства патологий сердечно-сосудистой системы. Однако в большинстве случаев метаболических повреждений миокарда данное исследование не позволяет выявить характерные эхокардиографические признаки, патогномоничные для указанной патологии. Вместе с тем, неспецифическими эхокардиографическими критериями дистрофии миокарда являются:
1) признаки умеренного снижения сократительной способности миокарда;
2) небольшое увеличение размеров левого желудочка до 99 процентиля;
3) незначительная гипертрофия межжелудочкой перегородки и задней стенки левого желудочка;
4) диастолическая дисфункция (ранний диагностический критерий);
5) пролапс створок митрального клапана при локализации дистрофических изменений в области папиллярных мышц.
Реографические методы исследования центральной (тетраполярная грудная реоплетизмография) и периферической гемодинамики (реовазография, реопульмография, реогепатография и т.д.) позволяют неинвазивно оценить такие показатели гемодинамики, как ударный объем, сердечный индекс, общее и удельное периферическое сопротивление, давление наполнения левого желудочка, сократительная функция левого желудочка; провести фазовый анализ.
Пробы с дозированной физической нагрузкой позволяют оценить состояние и параметры функционирования сердечно-сосудистой системы в условиях, близких к реальной жизни. Золотым стандартом среди нагрузочных проб являются велоэргометрия и тредмил, позволяющие наиболее точно дозировать физическую нагрузку с учетом физического развития ребенка. При проведении проб осуществляется мониторинг электрокардиографических показателей и уровня артериального давления.
Наиболее удобным протоколом проведения велоэргометрии является непрерывный ступенчато-возрастающий метод дозирования физической нагрузки. Мощность первоначальной нагрузки составляет 0,5 Вт/кг, с ее увеличением на каждой последующей ступени на 0,5 Вт/кг. Длительность каждой ступени 4 минуты, именно это время необходимо для адаптации гемодинамики к текущему уровню нагрузки. Проба проводится до достижения субмаксимальной частоты сердечных сокращений или выявления пороговых причин, к которым относятся:
1. ЭКГ признаки: ишемические изменения сегмента ST, инверсия или углубление зубца Т, нарушения сердечного ритма и проводимости (экстрасистолия, пароксизмальная тахикардия, мерцательная аритмия и т.п.).
2. Клинические признаки: отказ от дальнейшего проведения по причине болей в области сердца, головокружения, резкая усталость, боли в ногах, повышение систолического артериального давления более 220 мм рт.ст. и/или диастолического более 120 мм рт. ст., снижение систолического артериального давления на 25-30% от исходного.
Проба с дозированной физической нагрузкой при дистрофии миокарда позволяет выявить:
1) снижение толерантности к физической нагрузке;
2) неадекватное обеспечение физической нагрузки.
Сцинтиграфия миокарда с таллием и технецием в настоящее время является ценным неинвазивным методом в диагностике дистрофии миокарда, позволяющим качественно оценить перфузионные и метаболические процессы в миокарде, оценить распространенность и локализацию дистрофического процесса, а также определить какой из механизмов (перфузия или нарушение метаболизма) является основным в патогенезе нарушений процессов реполяризация миокарда, а соответственно – и дистрофии миокарда.
В основе сцинтиграфии с таллием лежит тропность данного радионуклеида к нормальным клеткам миокарда, вследствие чего препарат после его введения фиксируется в функционирующих кардиомиоцитах. При сканировании сердца выявляются немые зоны (зоны, в которых таллий не фиксируется). По этим зонам можно определить локализацию и процент пораженного миокарда, размер некроза или рубца.
Сцинтиграфия с пирофосфатом, меченным технецием, основана на способности пирофосфата связывать ионы кальция внутри функционирующих кардиомиоцитов. Большинство ионов кальция в норме находятся внутри кардиомиоцитов. При некрозе ионы кальция выходят из кардиомиоцита, пирофосфат при этом соединяется с ними и фиксируется. Выявляются поля фиксации пирофосфата, которые отражают участки некроза. В рубцовых участках миокарда кальция нет, следовательно, там фиксации пирофосфата не происходит.
Указанные методики используются, как правило, вместе.
В диагностике метаболических повреждений миокарда достаточно широкое распространение получили лабораторные методы исследования, целью которых является косвенная оценка дефектов в определенных звеньях метаболизма и таким образом выявление «основного» патогенетического механизма.
Рекомендуется определение уровня:
1) тиреотропных гормонов (Т3, Т4, ТТГ);
2) катехоламинов (адреналин, норадреналин, метанефрин);
3) общего холестерина; при повышении его значений более 200 мг% – содержание холестерина в липопротеидах низкой и высокой плотности;
4) электролитов (калия, натрия, кальция, магния);
5) лактатдегидрогеназы и креатинфосфатдегидрогеназы;
6) лактата и пирувата на фоне стандартного глюкозотолерантного теста;
7) тропонина Т;
8) цитохимическое определение уровня сукцинатдегидрогеназы и глицерофосфатдегидрогеназы в лимфоцитах.
Дифференциальная диагностика
На основании схожести клинических проявлений дифференциальная диагностика дистрофии миокарда в первую очередь должна проводиться с органической патологией сердца: миокардитом, перикардитом, кардиомиопатиями.
Дифференциальный диагноз дистрофии миокарда и воспалительных заболеваний сердца достаточно сложен, вследствие отсутствия четких диагностических критериев заболеваний.
На наличие миокардита может указывать:
1) перенесенная инфекция, доказанная клинически или лабораторно (включая изоляцию возбудителя, динамику титров специфических антител, лейкоцитоз, увеличение СОЭ, наличие С-реактивного протеина);
2) остро возникающее расширение границ сердца;
3) синусовая тахикардия (иногда брадикардия);
4) ослабление I тона;
5) остро возникающие патологические изменения на ЭКГ (нарушения ритма сердца, реполяризации и др.);
6) повышение активности сывороточных ферментов, отражающих наличие воспалительного процесса в миокарде (ЛДГ, АсАТ, креатинфосфокиназы и др.);
7) сердечная недостаточность.
Перикардиты экссудативный и констриктивный являются одной из частых причин хронических изменений SТ-Т, которые носят ишемический характер, развиваясь на фоне рестриктивного синдрома. Наличие выпота в перикарде – характерный диагностический симптом экссудативного перикардита. Специфический признак рестриктивного перикардита – резкое утолщение листков перикарда.
Нарушения коронарного кровоснабжения наиболее сложно дифференцировать с дистрофией и ишемическими поражениями миокарда, что обусловлено сходными элекрокардиографическими изменениями в том и другом случае. В ряде случаев точная диагностика возможна только при проведении ангиографии. Наиболее частыми причинами нарушений коронарного кровообращения являются врожденные аномалии развития, метаболические нарушения, васкулиты, эмболии в коронарные артерии.
Наиболее частой причиной инфаркта миокарда у детей является врожденная аномалия коронарных артерий – аномальное отхождение левой коронарной артерии от легочной артерии (синдром Бланда-Уайта-Гарленда). Выделяют 2 типа заболевания. Инфантильный тип с плохо развитыми коллатералями коронарных артерий, что клинически проявляется инфарктом миокарда сразу после рождения или эпизодами ишемии (ангина кормления), приступами беспокойства, крика, плохим аппетитом, кардиомегалией, признаками сердечной недостаточности (тахикардия, одышка, гепатомегалия, застойные явления в легких). На электрокардиограмме – отклонение электрической оси влево, гипертрофия левого желудочка, признаки инфаркта миокарда (подъем SТ, инверсия Т, исчезновение или снижение вольтажа зубца R, изменение комплекса QRS на QS). При взрослом типе аномального отхождение левой коронарной артерии от легочной артерии за счет хорошо развитого коллатерального кровообращения в коронарных артериях заболевание длительно может протекать без жалоб.
Острые коронарииты встречаются при различных инфекционных заболеваниях, ревматических и неревматических кардитах. Причинами подострых и хронических коронариитов являются узелковые полиартерии, неспецифический аортоартериит (болезнь Такаясу), гигантоклеточный (темпоральный) артериит, болезнь Кавасаки, инфекционный эндокардит. Клиническая картина коронариита однотипна независимо от этиологического фактора и проявляется коронарной недостаточностью вплоть до инфаркта миокарда. Элекрокардиографическая картина характеризуется стойкими изменениями сегмента SТ.
Коллагенозы: системная красная волчанка, узелковый периартериит нередко сопровождаются развитием коронариитов. При этом хронические воспалительные изменения в мелких и крупных венечных сосудах приводят к постепенному сужению просвета сосудов и тромбозу, что и является причиной инфаркта миокарда.
Феохромоцитома может быть причиной развития выраженных нарушений процесса реполяризации на фоне гиперкатехоламинемии, в ряде случаев возможно развитие инфаркта миокарда. Длительная гиперкатехоламинемия приводит к высокой артериальной гипертензии, гипертрофии миокарда левого желудочка, утолщению стенок коронарных артерий, дистрофическим изменениям в миокарде. Развитию инфаркта миокарда при этом также способствует явления коронароспазма и гиперкоагуляционные изменения, связанные с гиперкатехоламинемией.
Чаще других дистрофию миокарда приходится дифференцировать с дилатационной кардиомиопатией (ДКМП). Оба эти заболевания могут в течение длительного времени протекать субклинически. ДКМП в большинстве случаев манифестирует симптомами недостаточности кровообращения: одышка, отеки, гепатомегалия и т.д. Реже первыми признаками ДКМП оказываются перебои в сердце, обмороки, приступы сердцебиений. Аускультативная картина при ДКМП характеризуется глухим I тоном, у 40-80% можно уловить патологический III тон, а в более тяжелых случаях – протодиастолический ритм галопа. Часто у верхушки, в IV межреберье слева от грудины отмечается продолжительный систолический шум митральной регургитации (расширение митрального отверстия, дисфункция папиллярных мышц).
Электрокардиографическая картина ДКМП характеризуется признаками перегрузки левого желудочка, часто регистрируются блокады левой и правой ножек пучка Гиса. На ЭхоКГ выявляют признаки дилатации левого желудочка с выраженным снижением сократительной способности миокарда, аномалии движения стенок левого желудочка, относительную митральную и трикуспидальную недостаточность.
Гипертрофическая кардиамиопатия – заболевание миокарда, характеризующееся гипертрофией миокарда левого желудочка, асимметричной или симметричной с обязательным вовлечением в гипертрофический процесс межжелудочковой перегородки. Для заболевания типична диастолическая дисфункция. Изменения ST-T комплекса обусловлены ишемией миокарда и явлениями кардиосклероза.
Рестриктивная кардиомиопатия характеризуется резким утолщением эндокарда, уменьшением полости одного или обоих желудочков в сочетании с увеличением размеров предсердий, снижением растяжения миокарда, ограничением наполнения желудочков, уменьшением ударного и минутного объема и развитием в связи с этим сердечной недостаточности. Дистрофия миокарда в этом случае носит вторичный характер.
Лечение
Лечение дистрофии миокарда должно быть направлено на устранение основного патологического процесса, вызвавшего метаболические нарушения в миокарде. Регулирование режима труда, предупреждение физических нагрузок, рациональное питание (коррекция обменных нарушений), санация хронических очагов инфекции. Лечение может быть успешным лишь при проведении его непрерывно, комплексно на трех основных этапах: клиническом, санаторном и поликлиническом (адаптационном).
Ведущие задачи клинического этапа включают устранение по возможности этиологических факторов, уменьшение и ликвидацию ведущих клинических признаков болезни. При отсутствии противопоказаний ребенок должен с первых дней заниматься лечебной гимнастикой, которая нормализует соотношение процессов возбуждения и торможения, оказывает стимулирующее и нормализующее влияние на трофику ткани сердечной мышцы. Расширение двигательной активности осуществляется под контролем нагрузочных проб, адекватных функциональному состоянию сердечно-сосудистой системы больного.
Диета должна быть гипохлоридной, витаминизированной, богатой солями калия и магния (картофель, баклажаны, капуста, чернослив, абрикосы, изюм, финики, инжир, зеленый горох, петрушка, помидоры, ревень, свекла, черная смородина, укроп, фасоль, хрен, шелковица, щавель). Рекомендуется часть животных жиров заменить растительными, содержащими полиненасыщенные жирные кислоты (подсолнечное, кукурузное, оливковое, хлопковое масло и др.).
Для улучшения обменных процессов в сердечной мышце применяется фитотерапия курсами по 1,5-3 мес.: мелисса лекарственная ; желтушник серый; ландыш майский; шиповник; астрагал шестисткоцветковый; горицвет весенний; боярышник колючий. Длительность включения того или иного препарата условно определяется индивидуальными особенностями ребенка и характером течения у него патологического процесса.
Медикаментозная терапия направлена на улучшение функционального состояния миокарда, повышение толерантности к физической нагрузке, профилактику сердечной недостаточности.
L-карнитин является ко-фактором β-окисления жирных кислот. Выраженный положительный эффект отмечен при заместительной терапии L-карнитином в дозе 50-75 мг/кг в сутки (в 2-4 приема), в комплексной терапии способствует повышению фракции выброса миокарда левого желудочка.
Коэнзим Q10 (убихинон 10) является небелковой жировой растворимой субстанцией, играющей важную роль в функционировании дыхательной цепи митохондрий. Клинический эффект препарата характеризуется улучшением проводимости и сократительной способности миокарда, положительной динамикой процесса реполяризации.
Цитохром С является важнейшим хромопротеином, митохондриальным ферментом тканевого дыхания, корригирует энергетические нарушения, возникающие вследствие первичной или вторичной митохондриальной недостаточности, обладает комплексным влиянием на многие метаболические процессы, является активным антиоксидантом, уменьшает перекисное окисление липидов и предотвращает свободно радикальное повреждение клеток, улучшает усвоение промежуточного кислорода и нивелирует последствия тканевой гипоксии, оказывает мембраностабилизирующее действие и позитивное воздействие на церебральную и периферическую гемодинамику, способствует значительному улучшению обменных процессов в миокарде, улучшает сократительную способность левого желудочка сердца.
Витамин В3 играет огромную роль в окислительно-восстановительных процессах, в том числе и транспорте электронов. Повышает содержание НАД и снижает уровень лактат-ацидоза, что указывает на улучшение функционирования митохондриальной дыхательной цепи.
Витамин В2 – активный структурный элемент протеиновой части респираторных флавопротеинов, содержащих в качестве коэнзима флавин – мононуклеотид или флавинадениндинуклеотид (ФАД).
Тиамин (витамин В1) липоевая кислота являются составной частью коферментов отдельных субъединиц, которые участвуют в обмене углеводов, аминокислот и функционировании цикла Кребса. Эти сложные мультиферментные комплексы катализируют окислительное декорбоксилирование пировиноградной и α-кетокислот, образуя при этом восстановленный НАДН2. В результате лечения увеличивается эффективность энергетического метаболизма в мышечной ткани, снижается проявления лактат-ацидоза.
Лимонная и янтарная кислоты используются в комплексной терапии митохондриальной дисфункции при дистрофии миокарда, активируют цикл Кребса.
Биотин – кофермент ряда карбоксилаз, в частности, пируват-карбоксилазы. Под действием лечения снижается содержание молочной кислоты в крови.
С целью коррекции энергетического обмена и оказания регулирующего влияния на физиологические функции организма следует назначать комплексы витаминов группы В.
Пантотеновая кислота (витамина В5) является одним из самых активных витаминов, участвующих в обменных процессах. Входя в состав коэнзима А, она служит ко-ферментом более 60 ферментов организма, выполняя большую роль в обмене белков, липидов, углеводов, микроэлементов и других биологически активных соединений. Оказывает благоприятное влияние на показатели гемодинамики. Назначение пантотеновой кислоты особенно целесообразно при нейровегетативной, гормональной дистрофии миокарда, у детей с ожирением, склонности к гиперлипидемии.
Кальция пангамат (витамин В15) улучшает липидный обмен, повышает усвоение кислорода тканями, устраняет явления гипоксии.
Специфическое лечение дистрофии определяется проведением курса терапии основного заболевания. Так, при аллергической или интоксикационной дистрофии миокарда, развивающихся на фоне экссудативно-катаральной аномалии конституции, показано назначение в возрастных дозировках антигистаминных препаратов. При эндокринопатических дистрофиях миокарда показано лечение гипер- или гипофункции щитовидной железы, сахарного диабета.
Санация очагов хронической инфекции является обязательным компонентом лечения дистрофии миокарда: лечение кариеса, аденоидитов, синуситов.
Наиболее важным лечебным мероприятием при интоксикационной (тонзиллогенной) миокардиодистрофии является проведение тонзиллэктомии.
Успешное завершение клинического этапа лечения дистрофии миокарда подтверждается рядом показателей: у больного должны исчезнуть жалобы, нормализоваться артериальное давление. Функциональное состояние сердечно-сосудистой системы обнаруживает положительную динамику и приближается к норме. Ответные реакции на функциональные пробы с дозированной физической нагрузкой адекватны требованиям тренирующего режима.
На санаторном этапе особое внимание должно уделяться восстановлению и расширению физической и психической активности ребенка в соответствии с его возрастными и индивидуальными особенностями. Осуществление этого этапа желательно проводить в специализированном реабилитационном отделении или местном санатории в привычных климатических условиях. Организация рационального лечебно-оздоровительного режима предполагает физиологически обоснованное чередование двигательной и умственной активности с отдыхом, сном, питанием, закаливанием, развлечениями.
Важное место в комплексном лечении занимает физическое воспитание, поскольку дозированная мышечная нагрузка обеспечивает повышение адаптационных возможностей сердечно-сосудистой системы. Физическое воспитание слагается из ежедневных занятий утренней гимнастикой и лечебной физкультурой, прогулок, игр, ходьбы на лыжах, катания на санках, гребли, туристических прогулок. Физическая нагрузка должна увеличиваться постепенно под контролем адаптационных возможностей органов кровообращения и приблизительно соответствовать школьной программе по физкультуре для детей, отнесенных к специальной медицинской группе. При проведении лечебной гимнастики также важно учитывать эмоциональное состояние детей.
Благотворное влияние на различные звенья кровообращения и на ее регуляторные механизмы оказывает бальнеологическое лечение: валериановые, жемчужные, хлоридно-натриево-углеводные, морские, кислородные, водобромные, хвойные ванны, лечебный циркулярный душ.
Весьма эффективны физиотерапевтические процедуры: электросон, воздушные ванны, массаж. Результатом завершения санаторного этапа должна быть нормализация функциональных показателей сердечно-сосудистой системы как в покое, так и при дозированных физических нагрузках.
Третий этап реабилитации детей и подростков с дистрофией миокарда – поликлинический (адаптационный) предусматривает полное восстановление здоровья ребенка с нормализацией морфологических и функциональных показателей, характерных для данного возраста, обеспечивающих возврат ребенка к обычным для него условиям жизни, учебы, занятий физкультурой и спортом. Он проходит для детей в обычных для них условиях и требует совместного действия медицинского, педагогического персонала, семьи. Реабилитационная система на этом этапе должна, прежде всего, включать правильный режим дня, определяющий продолжительность всех видов учебной и внеучебной деятельности, рациональное чередование труда и отдыха. Одним из важных моментов диспансеризации является санитарно-просветительный, воспитательный аспект, которому следует уделять должное внимание.
В течение 3-6 месяцев ребенку следует рекомендовать занятия физкультурой в специальной группе или на уроках основной группы выполнять лишь вводную и заключительную части урока с запрещением участия в соревнованиях. Полностью освобождать ребенка от физкультуры не следует. В дальнейшем, при условии благоприятной реакции сердечно-сосудистой системы на физическую нагрузку, он может быть переведен в основную группу.
Профилактика
При решении вопроса о проведении курсов профилактического лечения детям, страдающим дистрофией миокарда различной природы, необходим индивидуальный подход. По показаниям назначаются нейрометаболические, кардиотрофические препараты, седативная терапия. Но основное внимание должно быть уделено лечению фонового заболевания.
Вопрос оформления ребенка с дистрофией миокарда в детский дошкольный коллектив требует индивидуального решения. Впервые оформлять ребенка в детский коллектив желательно не ранее чем через 3-6 месяцев после исчезновения клинико-инструментальных признаков дистрофии миокарда.
Дети с дистрофией миокарда подлежат диспансерному наблюдению в течение 2 лет с регулярными осмотрами ребенка педиатром. При каждом осмотре ребенку подсчитывается ЧСС, измеряется артериальное давление, регистрируется ЭКГ. ЭхоКГ и другие лабораторные и инструментальные обследования проводятся по показаниям. Не реже 2 раз в год ребенка должен консультировать ЛОР врач, стоматолог, невропатолог и др.
Прогноз
Прогноз при дистрофии миокарда благоприятный, в тех случаях, когда изменения выявлены рано и лечение проводится правильно, что в значительной мере обусловлено хорошей регенераторной способностью кардиомиоцитов детского сердца.
Тем не менее, степень поражения сердца и клиническая картина зависят не только от характера и длительности воздействия основного этиологического фактора, но и от выраженности дистрофического процесса, его преимущественной локализации, соотношения восстановительных (компенсаторных) и повреждающих процессов в миокарде.
Список литературы
1. Леонтьева И.В. Лекции по кардиологии детского возраста. – М: ИД Медпрактика-М, 2005. – С. 76-137.
2. Леонтьева И.В., Лебедькова С.Е. Миокардиодистрофия у детей и подростков. – Москва: Медицина, 2010. – 75с.: 2 ил.
3. Мутафьян О.А. Кардиомиопатии у детей и подростков. – СПб: «Издательство Диалект», 2003. – 272 с.
4. Белоконь H.A. Кардиты у детей. М.: «Медицина», 1984. 211 с.
5. Белоконь H.A., Кубергер М.Б. Болезни сердца и сосудов у детей: руководство для врачей. М.: «Медицина», 1987.






