Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА ПРИ ТРАВМАХ И ПЕРЕЛОМАХ"
Автор: Поворознюк В.В., Григорьева Н.В., Быстрицкая М.А.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Кардиология, Неврология, Ревматология, Семейная медицина/Терапия
Просмотров: 9 933
Дата проведения: с 01.06.2015 по 01.06.2016
Травмы опорно-двигательного аппарата занимают одно из ведущих мест в структуре общей заболеваемости населения. По характеру повреждений около 50 % травм – это переломы, вывихи, растяжения капсульно-связочного аппарата, травмы мышц и сухожилий.
Боль одна из основных жалоб при травмах и наиболее частая мотивация обращения за медицинской помощью. Распространенность болевого синдрома у этой категории пациентов достигает 70 % (52-90 % по данным различных исследований) [Berben S. et al., 2011, Cordell W. et al., 2002; Berben S. et al., 2008]. Проблема совершенствования медицинской помощи больным с повреждениями опорно-двигательного аппарата с каждым годом приобретает всё большее значение, в связи с ростом числа пострадавших и увеличением уровня инвалидности от травм у лиц трудоспособного возраста и детей. Недостаточное купирование боли приводит к замедленному заживлении ран, снижению восстановления функциональной активности пораженного участка и пациента в целом. В последнее время появляется все больше доказательств, что недостаточное купирование боли в остром периоде травмы может привести к развитию хронической боли и инвалидности и, в результате этого, увеличению расходов в сфере здравоохранения [Carr D., Goudas L., 1999, Rivara F. et al., 2008; Macintyre P. et al., 2010].
В настоящее время известно, что на любую травму организм реагирует неспецифической воспалительной реакцией – реактивным воспалением, которая является адаптационно-компенсаторно-защитной и клинически проявляется болью, отеком и нарушением функции поврежденной области. Важнейшей задачей при лечении больного является быстрое и максимально полное купирование данных симптомов.
В настоящее время выделяют два типа боли – ноцицептивную и нейропатическую. Первая возникает в результате воздействия каких-либо экзо- или эндогенных повреждающих факторов на любую ткань, что ведет за собой возбуждение периферических болевых рецепторов, которые в свою очередь передают сигнал в ЦНС, где собственно и формируется чувство боли. Ноцицептивная боль – это чаще всего острая боль, со всеми присущими ей характеристиками. Однако длительно продолжающееся периферическое раздражение может привести к дисфункции центральных ноцицептивных и антиноцицептивных систем на спинальном и церебральном уровнях, что обусловливает необходимость максимально быстрого и эффективного ее устранения.
Восприятие ноцицепторами (или рецепторами других типов при сверхсильном раздражителе) повреждающего сигнала индуцирует синтез и высвобождение большого количества различных алгогенов или «гуморальных продуктов боли» – местных биохимических трансмиттеров болевого восприятия, в их числе ионы К, Н, серотонин, гистамин, ацетилхолин, простагландины, кинины, брадикинин, аденозин, возбуждающие аминокислоты, субстанция Р (пептиды), лейкотриены, а также продукты жизнедеятельности клеток белой крови (лимфокины, монокины, интерлейкины) и др. Кроме того, простагландины, синтезируемые в процессе воспаления, повышают чувствительность болевых окончаний к медиаторам болевой чувствительности. Эти ноцицептивные раздражения активируют болевую (ноцицептивную) систему – импульсы передаются по восходящей системе боли по спиноталамическому или спиноретикулоталамическому пути в ядра таламуса, гипоталамуса, лимбическую систему и к чувствительной зоне коры головного мозга, где формируется сложная системная ответная реакция. Она представлена нисходящей антиноцицептивной (антиболевой) системой, которую формируют кора, подкорковые структуры и нейротрансмиттеры нисходящей системы – моноамины, в том числе аминокислоты (глицин), катехоламины, серотонин, а также эндорфины, энкефалины, соматостатин, кальцитонин и др. Эти две системы – болевая и антиболевая – постоянно взаимодействуют в нашем организме, но ключевую роль в формировании боли играет головной мозг, который реагирует на острую боль включением антиноцицептивной системы.
Среди патогенных факторов, вызывающих боль, лидирующее положение занимают травма, разрыв или растяжение тканей. Примерами наиболее часто встречающейся ноцицептивной боли являются послеоперационная боль, боли при переломах и растяжениях, боль, ассоциированная со спортивной травмой. В большинстве случаев болевой раздражитель очевиден, а боль хорошо локализована и легко описывается больным. После прекращения действия повреждающего фактора и/или проведения короткого курса обезболивания традиционными анальгетиками ноцицептивная боль быстро купируется.
Простагландины, воздействуя на периферические ноцицепторы, вызывают их сенситизацию, снижение болевого порога, что ведет к развитию первичной гипералгезии в зоне повреждения.
Другим звеном патогенеза болевого синдрома является вторичная гипералгезия, развивающаяся в интактных тканях, как результат центральной сенситизации нейронов задних рогов спинного мозга. Этот процесс сопровождается выбросом провоспалительных субстанций, и прежде всего простагландина Е2. Возникает феномен «взвинчивания» активности болевых рецепторов нейронов задних рогов спинного мозга, распространяющийся по проводящим путям в высшие центры регуляции – ядра таламуса.
Стрессовые реакции, спровоцированные болью, усугубляют состояние пациентов. Увеличение уровня катехоламинов может привести к сужению артериол, ухудшению перфузии тканей и уменьшению в тканях парциального давления кислорода [Akza O. et al., 1999]. Другие реакции, вызванные болью, включают ускорение катаболической составляющей метаболизма с развитием гипергликемии, липолиза и распада мышц [Barr J. et al., 2013]. Преобладание катаболических процессов и гипоксия замедляют заживление ран и увеличивают риск возникновения раневой инфекции. Боль подавляет активность Т-киллеров [Beilin B. et al, 1996], снижает фагоцитарную активность нейтрофилов и приводит к уменьшению количества Т-клеток [Barr J. et al., 2013].
Острая боль также может быть фактором риска для развития интенсивной хронической, часто нейропатической боли [Puntillo K. еt al. 2003]. По результатам длительных наблюдений доказано, что у пациентов с некупированной острой болью более высокий риск развития хронических болевых синдромов (38 %) и выше частота симптомов посттравматического стрессового расстройства (27 %), а также хуже показатели качества жизни, связанного со здоровьем (21 %) [Schelling G. et al., 2008].
Боль – наиболее тягостное ощущение, которое во многом определяет тяжесть состояния больного и нарушение его социальной адаптации. Именно поэтому, с точки зрения больного, скорость и стойкость обезболивания относят к основным критериям оценки качества лечения.
На сегодняшний день к закрытым травмам относят ушибы, сдавления, растяжения и разрывы, вывихи, а также переломы. Ушиб – повреждение мягких тканей без нарушения целости кожи. Он, как правило, происходит при прямом воздействии (удар, падение), однако часто его диагностика в ранние сроки затруднена из-за отсутствия видимых изменений. Растяжения и разрывы связок наблюдаются при непрямом воздействии и происходят в результате внезапного и резкого движения в суставах, превосходящего пределы его подвижности. Связки практически не растягиваются, а возникают их микроразрывы, частичные или почти полные разрывы. При полном разрыве связок выявляется несуществующая в норме подвижность расположенного ниже сегмента. Вывихом называется нарушение правильного взаимоотношения сочленяющихся частей костей, которые образуют сустав, в результате чего одна из костей смещается. Переломы костей – полное или частичное нарушение целостности кости при нагрузке, превышающей прочность травмируемого участка скелета. Они могут возникать как вследствие травмы, так и в результате различных заболеваний, сопровождающихся изменениями в прочностных характеристиках костной ткани.
По данным некоторых исследований, среди пациентов с тяжелыми травмами опорно-двигательного аппарата (переломы длинных трубчатых, множественные переломы костей, политравма), более 70 % больных не получают достаточное обезболивание и продолжают испытывать умеренную или интенсивную боль, находясь в условиях медицинского учреждения. Причин недостаточной и неадекватной аналгезии у таких больных много, в том числе недооценка интенсивности боли, чрезмерная боязнь возникновения нестабильности гемодинамики и угнетения дыхания, необоснованный страх развития зависимости от наркотических аналгетиков. Обезболивание таких пациентов обеспечивается применением мультимодальной аналгезии, а именно применением локальной, региональной анестезии (при необходимости), введением ненаркотических анальгетиков и опиатов. Хотя применение ацетаминофена и нестероидных противовоспалительных препаратов (НПВП), как правило, недостаточно для купирования интенсивного болевого синдрома, введение этих средств в дополнение к опиатам позволяет уменьшить болевой синдром и снизить их дозу, и, следовательно, частоту возникновения ассоциированных с ними побочных эффектов.
На сегодняшний день основным недостатком лечения острой боли является неадекватная оценка болевого синдрома и недостаточный уровень обезболивания на догоспитальном этапе, что приводит к серьезным трудностям в контроле болевого синдрома в дальнейшем [Berben S. et al., 2012].
Достаточный уровень контроля болевого синдрома позволяет:
- Провести раннюю мобилизацию пациента.
- Снизить нейроэндокринные побочные эффекты травмы, в том числе несколько снизить риск возникновения сердечно-сосудистых осложнений.
- Снизить частоту возникновения тромбоза глубоких вен и тромбоэмболии легочной артерии.
- Уменьшить проявления дыхательных осложнений.
Напротив, недостаточное обезболивание ассоциировано с:
- Хроническим болевым синдромом в будущем.
- Посттравматическим стрессовым расстройством.
- Увеличением заболеваемости и смертности.
В настоящее время не существует унифицированных рекомендаций по обезболиванию пациентов с травмами. Продолжают дискутироваться вопросы относительно эффективности парацетамола и безопасности НПВП для купирования болевого синдрома. Несмотря на то, что опиаты, считают наиболее эффективными препаратами среди обезболивающих средств, высокая частота развития побочных эффектов, таких как угнетение респираторной и сердечно-сосудистой функций ограничивает их широкое использование в клинической практике.
Выбор тактики обезболивания зависит от тяжести состояния пациента, локализации травмы и интенсивности болевого синдрома (табл. 1).
Табл. 1. Выбор препарата для купирования боли в зависимости от ее длительности.
|
Острая боль |
Хроническая боль |
|
Необходимость быстрого эффекта |
Необходимость хорошей длительной переносимости |
|
Необходимость выраженного обезболивающего эффекта |
Необходимость выраженного противовоспалительного и анальгетического действия |
Принципы фармакотерапии боли представлены в табл. 2.
Табл . 2. Принципы фармакотерапии боли (World Health Organization, 1986; Vancouver Hospice Program, 1989).
|
Боль при правильном использовании анальгезирующих препаратов в большинстве случаев должна уменьшаться |
|
Необходимо избегать одновременного введения нескольких лекарственных средств (ЛС), принадлежащих к одной группе (например, НПВП) |
|
Необходимо помнить, что не все виды боли реагируют на наркотические болеутоляющие средства (например, боль, связанная со спазмом гладкой мускулатуры ЖКТ), а некоторые, например костно-суставные боли, могут требовать назначения сочетания наркотических и ненаркотических анальгетиков |
|
При отсутствии терапевтического эффекта после применения анальгетика в течение 12 ч следует рассмотреть целесообразность увеличения его дозы (избегая при этом введения дополнительных доз того же препарата, а также сокращения промежутков времени между отдельными приемами) или принять решение об использовании более сильных средств |
|
Не следует назначать больным, страдающим хроническими болями, препараты «по требованию», так как это связано с необходимостью применения значительно больших доз ЛС и имеет отрицательное психологическое действие |
|
Во время лечения болеутоляющими средствами следует одновременно уделять внимание терапии сопутствующих нежелательных симптомов (изжога, тошнота, др.) |
АНАЛЬГЕТИЧЕСКИЕ СРЕДСТВА В КУПИРОВАНИИ БОЛЕВОГО СИНДРОМА. Препараты, облегчающие боль, спровоцированную определенным причинным фактором, или устраняющие специфический болевой синдром (например, эрготамин при мигрени, карбамазепин при невралгии, нитроглицерин при стенокардии) не относят к классическим анальгетикам, также как и кортикостероиды, подавляющие воспалительную реакцию и обусловленную ею боль. Поэтому «истинные» анальгетики классифицируют как наркотические (действующие преимущественно на структуры центральной нервной системы, например, опиоиды) и ненаркотические (действующие главным образом на периферические структуры, например, аспирин). Существуют также и дополнительные средства, усиливающие действие анальгетиков. Они не являются сами по себе анальгетиками, хотя могут изменять отношение к боли, ее восприятие и нивелировать усугубляющие ее беспокойство, страх, депрессию. Такими ЛС могут быть психотропные, а также воздействующие на механизм болевых ощущений, например, устраняющие спазм гладкой или поперечно-полосатой мускулатуры.
На сегодняшний день общеизвестна классификация анальгетических средств (табл. 3): центрально действующие ЛС (опиаты) – средства, способные оказывать более сильное действие, чем другие, но и вызывать активную лекарственную зависимость (промедол, морфин, кодеин и др.) (табл. 4); периферически действующие ЛС (неопиаты), основным принципом действия которых является торможение синтеза простагландинов, что играет важную роль в локальных механизмах боли и воспаления, а также в процессах передачи боли (ибупрофен, диклофенак, кеторолак, кетопрофен и др.); вторичные анальгетики (адъюванты) – вещества, влияющие на нервные и/или психические процессы – моторно-мотивационные и когнитивные компоненты боли (финлепсин, диазепам и др.) (табл. 5) [Бобырев В.Н. и соавт., 2003; Викторов А.П., 2010].
Табл. 3. Классификация анальгетических лекарственных средств (ВОЗ, 1986)
|
Центрально действующие ЛС (опиаты) – способны оказывать более сильное действие, чем другие, но и способны вызывать активную лекарственную зависимость |
Анальгезирующее действие путем связывания с опиатными рецепторами. Антагонисты μ-, κ-, δ-рецепторов. Частичные антагонисты μ-, κ-, δ-рецепторов |
|
Периферически действующие ЛС (неопиаты) – основной принцип действия – торможение синтеза простагландинов |
Анальгезирующее действие путем торможения синтеза простагландинов. Вещества, терапевтический эффект которых зависит от дозы и степени анальгезирующего действия |
|
Вторичные анальгетики (адъюванты) – вещества, влияющие на нервные и/или психические процессы – моторно-мотивационные и когнитивные компоненты боли (болевое поведение) |
Не оказывают прямого анальгезирующего действия. Антиконвульсанты, анксиолитики, мышечные релаксанты, нейролептики, антидепрессанты, психостимуляторы |
Табл. 4. Лекарственные средства центрального действия.
|
Опиоидные (наркотические) анальгетики: а) антагонисты опиоидных рецепторов: морфин, промедол, просидол, фентанил, алфентанил, пиритрамид; b) агонисты-антагонисты и частичные агонисты опиоидных рецепторов: пентазоцин, бупренорфин, буторфанол, налбуфин, налорфин |
|
Неопиоидные препараты центрального действия с анальгетической активностью. Ингибиторы ЦОГ преимущественно в ЦНС – ненаркотические анальгетики, производные парааминофенола: парацетамол |
|
α2-Адреномиметики: клофелин, гуанфацин |
|
Блокаторы натриевых каналов мембран: карбамазепин, дифенин, ламотриджин, мексилетин |
|
Ингибиторы обратного нейронального захвата моноаминов (серотонина, норадреналина): амитриптилин, имизин, доксепин, циталопрам |
|
Антагонисты возбуждающих аминокислот: кетамин (в субнаркотических дозах), декстрометорфан, мемантин. |
|
Средства для наркоза: закись азота, трилен, метоксифлюран |
|
Местные анестетики: новокаин, лидокаин, ропивакаин, артикаин |
|
Блокаторы гистаминовых Н1-рецепторов: димедрол, пипольфен, астемизол |
|
ГАМКБ-миметики: баклофен, фенибут, натрия оксибутират |
|
Блокаторы кальциевых каналов: а) блокаторы каналов L-типа: верапамил, нимодипин; b) блокаторы каналов N-типа: SNХ-111 |
|
Вещества смешанного механизма действия (опиоидный и неопиоидный компоненты): трамадол, нефопам |
Табл. 5. Различные лекарственные средства, используемые в лечении болевых синдромов.
|
Антагонисты серотониновых рецепторов 5-НТ1: суматриптан, золмитриптан |
|
Блокаторы серотониновых рецепторов: метисергид, пизотифен |
|
Адренолитики: пропранолол, надолол, метопролол |
|
Препараты алкалоидов спорыньи: эрготамин, дигидроэрготамин, кафергон |
|
Спазмолитики миотропного действия: папаверин, но-шпа, нитроглицерин, аминофиллин |
|
Спазмолитики, влияющие на функцию медиаторных систем (М-холинолитики): атропин, метацин, пирензепин, платифиллин, букоспан |
|
Нейролептики: левомепромазин, хлорпромазин, дроперидол |
|
Транквилизаторы: диазепам, медазепам, феназепам, лоразепам |
|
Миорелаксанты: мидокалм, сирдалуд |
|
Витамины группы B: тиамин, пиридоксин |
|
Тиреокальцитонин |
|
Соматостатин |
|
Средства с анальгезирующим действием для местного применения: анестезин, димексид, финалгон, фастум-гель |
|
Природные растительные средства для местного использования (препараты прополиса, корень аира) |
Основные отличия в механизмах действия наркотических и ненаркотических анальгетиков представлено в табл. 6.
Табл. 6. Сравнительная характеристика наркотических и ненаркотических анальгетиков.
|
Характеристики |
Анальгетики |
|
|
наркотические |
Ненаркотические |
|
|
Механизм обезболивающего действия |
Угнетение проведения болевых импульсов в центральной нервной системе. |
Блокирование цикла арахидоновой кислоты и синтеза простагландинов, повышающих чувствительность рецепторов к медиаторам боли (гистамину, брадикинину) и механическим воздействиям |
|
Дополнительные свойства |
Вызывают эйфорию, обладают снотворным действием |
Обладают противовоспалительным и жаропонижающим действием |
|
Эффективность |
Эффективны при боли любого происхождения, особенно при висцеральной боли |
Наиболее эффективны при боли, связанной с воспалительным процессом и при соматической боли |
|
Противопоказания |
«Острый живот», дыхательная недостаточность (ХНЗЛ, бронхиальная астма), внутричерепная гипертензия |
Эрозивно-язвенные поражения желудочно-кишечного тракта, выраженные нарушения функции печени и почек, цитопении, индивидуальная непереносимость, беременность, сердечно-сосудистые заболевания |
|
Побочные эффекты* |
Угнетение дыхания, тошнота, рвота, запоры, задержка мочеиспускания, сухость во рту, брадикардия и гипотония, лекарственная зависимость, привыкание |
Гастротоксичность; ототоксичность (снижение слуха), гематотоксичность (лейкопения, агранулоцитоз, анемия), коагулопатия ((кровоточивость), нефротоксичность, инфаркты, инсульты, стоматиты, аллергические реакции и др. |
Несмотря на большой арсенал анальгетических препаратов различной направленности действия, проблема лечения боли после травм и переломов остается весьма актуальной как в нашей стране, так и за рубежом.
ИСПОЛЬЗОВАНИЕ НПВП ДЛЯ ЛЕЧЕНИЯ БОЛИ ВСЛЕДСТВИЕ ТРАВМ И ПЕРЕЛОМОВ. Наиболее часто в качестве анальгетиков, особенно в тех ситуациях, когда патогенез боли определяется повреждением или воспалением ткани, применяются НПВС. Главные их достоинства – хорошо доказанная эффективность, предсказуемость фармакологического действия, удобство применения и финансовая доступность. При травмах опорно-двигательного аппарата назначение их не просто желательно, но и абсолютно показано.
Нестероидные противовоспалительные препараты – наиболее часто назначаемые средства пациентам после травм и переломов. При остром болевом синдроме после перелома или в течение послеоперационного периода после фиксации костных отломков, НПВП играют важную роль благодаря своему анальгетическому и противовоспалительному эффекту, а также способности уменьшать дозу опиоидных анальгетиков.
Механизм их действия обусловлен угнетением превращения арахидоновой кислоты в простагландины путем ингибирования фермента циклооксигеназы (ЦОГ). Выделены два изофермента ЦОГ: ЦОГ-1 и ЦОГ-2. ЦОГ-1 существует в организме в норме, катализирует синтез простагландинов (ПГ), участвующих в многочисленных физиологических функциях, включая нормальное функционирование слизистой оболочки желудочно-кишечного тракта и агрегационные свойства тромбоксана 2 в тромбоцитах. ЦОГ-2 синтезируется только при повреждении тканей, индуцирует производство цитокинов и других медиаторов воспаления в ряде тканей, в том числе в эндотелиальных клетках и, считается, играет определенную роль в развитии боли, воспаления и лихорадки. Продукция ЦОГ-2 значительно увеличивается в условиях воспаления. ПГ, образованные под влиянием ЦОГ-2, принимают участие в развитии и прогрессировании острого и хронического воспаления. Таким образом, ПГE2, расширяя артериолы, увеличивает приток крови в область воспаления, а ПГF2a – сужает венулы и затрудняет отток крови, что способствует развитию экссудации. Кроме того, ПГ вызывают гипералгезию и потенцируют действие других медиаторов воспаления. НПВП, являясь ингибиторами циклооксигеназы, влияют на синтез простагландинов (PGG2 и потом PGH2) из арахидоновой кислоты. ПГH2 является предшественником биологически активных простагландинов и тромбоксана. ПГH2 конвертируется в различные простаноиды, такие как тромбоксан A2, простациклин (ПГI2), ПГD2, ПГE2 и ПГF2a.
Центральный механизм действия НПВП связан с угнетением синтеза простагландинов, которые образуются в центральной нервной системе и способствуют передаче болевого сигнала. НПВП снижают чувствительность болевых рецепторов, уменьшают отечность тканей в очаге воспаления, ослабляя механическое давление на ноцицепторы. Основные механизмы действия НПВП представлены в табл. 7.
Табл. 7. Основные механизмы действия НПВП.
|
МЕХАНИЗМ ПРОТИВОВОСПАЛИТЕЛЬНОГО ДЕЙСТВИЯ |
|
· угнетают образование из арахидоновой кислоты медиаторов боли, воспаления и лихорадки – простагландинов, в следствие снижения активности ЦОГ-2а (в здоровых тканях практически отсутствует и эксспресируется только при воспалении); · угнетают синтез и высвобождение медиаторов воспаления (серотонина, гистамина) из тучных клеток; · угнетают активность гиалуронидазы – фермента, расщепляющего гиалуроновую кислоту, являющуюся основным веществом соединительной ткани, ограничивая процесс экссудации; · ингибируют синтез коллагена фибробластами грануляционной ткани, подавляют пролиферативную фазу воспаления; · стабилизация лизосомальных мембран (что препятствует выходу лизосомальных ферментов и предупреждает повреждение клеточных структур); · торможение процессов образования макроэргических соединений в процессах окислительного фосфорилирования (снижение энергообеспечения воспалительного процесса и торможение хемотаксиса клеток в очаг воспаления); · торможение пролиферативной фазы воспаления за счёт ингибирования трансформации лимфоцитов |
|
МЕХАНИЗМ АНАЛЬГЕТИЧЕСКОГО ДЕЙСТВИЯ |
|
· периферический компонент является, в основном, следствием ведущего противовоспалительного действия; · центральный механизм связан с влиянием НПВП на таламичекие центры, торможение которых приводит к ослаблению проведения импульсов к коре головного мозга, а также препятствуют повышению концентрации простагландинов в спинномозговой жидкости, что тормозит развитие вторичной гиперальгезии; · не влияют на опиатную систему мозга, не вызывают психическую и физическую зависимость |
|
МЕХАНИЗМ ЖАРОПОНИЖАЮЩЕГО ДЕЙСТВИЯ |
|
· связан с ингибированием синтеза простагландинов в центре терморегуляции в гипоталамусе; · НПВП значительно усиливают теплоотдачу вследствие расширения сосудов кожи, слизистых оболочек, повышения функции потовых желез; · практически не влияют на теплопродукцию |
Для пациентов с легкой и умеренной болью рекомендуется применение ацетаминофена или НПВП с высоким профилем безопасности, таких как ЦОГ-2 селективные средства (нимесулид, мелоксикам), или НПВС с гастропротективным действием – амтолметин гуацил.
Для пациентов с интенсивным болевым синдромом рекомендованы наркотические анальгетики и НПВП. Препараты выбора – НПВП с высокой обезболивающей активностью. Конечно, профиль безопасности этих препаратов трудно сопоставить с традиционными или с ЦОГ-2 селективными НПВП, но, с другой стороны, при сравнении этих средств с препаратами с подобной обезболивающей способностью (опиоидные анальгетики), они явно имеют много преимуществ. Использование препаратов с высокой обезболивающей способностью коротким курсом не сопровождается высоким риском развития побочных реакций. Среди используемых сегодня НПВП наибольшей обезболивающей активностью обладает кеторолак.
В эксперименте на животных была определена обезболивающая активность наиболее используемых НПВП: кеторолак 30 мг > (кетопрофен 25 мг = ибупрофен 400 мг = флурбипрофен 50 мг) > (АСК 50 мг = напроксен 250 мг = парацетамол 650 мг = фенопрофен 200 мг = этодолак 200 мг = диклофенак 50 мг = мефенаменовая кислота 500 мг) > набуметон 1000 мг [Drugs of Choicefromthe Meddical Letter, 1995].
Особенности действия кеторолака. Кеторолака трометамин – производное арилуксусной кислоты, неселективный ингибитор ЦОГ. Используется в виде трометаминовой соли, что увеличивает его растворимость в воде и при этом трометаминовая соль легко расщепляется, высвобождая кеторолак.
Биодоступность перорального кеторолака составляет 80-100 % и аналогична таковой при внутримышечном введении, что обеспечивает быстрое наступление анальгезии [Беловол А.Н., Князькова И.И., 2012]. Максимальная концентрация препарата в плазме крови достигается через 5-50 минут в зависимости от способа введения, фармакокинетика имеет линейный характер. После приема внутрь 10 мг эффект развивается через 10-60 мин, после внутримышечного введения 30 мг – через 15-75 мин. Продолжительность действия кеторолака составляет до 10 часов. Кеторолак связывается с белками плазмы крови на 90-99 %, метаболизируется в печени, выводится через почки (90 %) и кишечник (6 %). Период полувыведения составляет 5 часов, а у пожилых людей приближается к 7 часам [Беловол А.Н., Князькова И.И., 2012].
Механизм действия кеторолака обусловлен блокированием ЦОГ и обеспечивается центральными и периферическими механизмами.
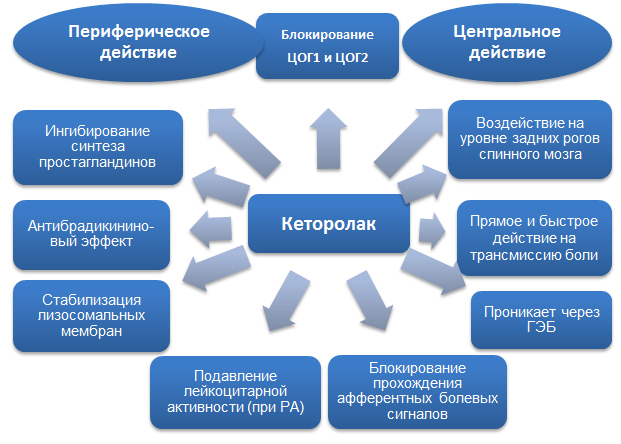
Рис.1. Механизм действия кеторолака.
Анальгетическая эффективность кеторолака была высоко оценена при применении в послеоперационном периоде, как в стационарных, так и в амбулаторных условиях. После больших абдоминальных, ортопедических или гинекологических оперативных вмешательств применение кеторолака обеспечивало эффективное уменьшение болевого синдрома от легкой до выраженной интенсивности у большинства пациентов подобно стандартным дозам морфина и приводило к уменьшению использования опиатов. Преимущество кеторолака перед наркотическими анальгетиками выражается в отсутствии влияния на функцию дыхания, седативного и психомоторного эффектов. Кеторолак также может использоваться для обезболивания у пациентов с почечной коликой, мигренью, головной болью, мышечной болью и др. Парентеральное введение кеторолака уменьшает боль у пациентов с онкологической патологией.
В Северной Америке, Великобритании и некоторых других европейских странах кеторолак является единственным парентеральным НПВП, использующимся для лечения острого болевого синдрома. Показано, что при введении 30 мг препарата он оказывает действие сравнимое с эффектом 10-12 мг морфина или 50 мг мепередина [Верткин А.Л. и др., 2006].
Основное направление использования кеторолака – это обезболивание при травмах и в послеоперационном периоде.
Побочные эффекты кеторолака обусловлены влиянием на ЦОГ и представлены специфическими эффектами класса НПВП. Большинство клинически значимых побочных эффектов связано с воздействием на ЖКТ, почечную и гематологическую функцию. Частота развития побочных эффектов при применении кеторолака составляет 2,7 %. Наиболее часто встречаются диспепсические симптомы. Тяжелые побочные симптомы (геморрагические осложнения, нарушение функции почек, острая анафилаксия) встречаются значительно реже [Верткин А.Л. и др., 2006]. Результаты большого ретроспективного постмаркетингового исследования с привлечением более 20000 пациентов показало, что общий относительный риск желудочно-кишечных кровотечений у кеторолака сравним с опиатами, но заметно возрастает при использовании высоких его доз в течение более 5 дней, особенно у пожилых людей. Признаки почечной недостаточности, которые могут возникнуть при применении высоких доз кеторолака, как правило, проходят самостоятельно после отмены препарата и не требуют дополнительных мер. Как и другие НПВП, кеторолак также может вызвать аллергические реакции или реакции гиперчувствительности. Применение кеторолака противопоказано при реакциях гиперчувствительности, гиповолемии, тяжелой почечной и печеночной недостаточности, пептических язвах, язвенной болезни желудка и двенадцатиперстной кишки, нарушениях гемостаза, беременности, родах, кормлении грудью и детям до 16 лет [Helin-Salmivaara A. et al., 2006].
Таким образом, кеторолак – сильный обезболивающий препарат с профилем переносимости подобным другим НПВП. При использовании его в соответствии с принципами действующих руководств, препарат является серьезной альтернативой опиатам.
Высокая анальгетическая активность и наличие различных форм препарата (инъекционная, таблетированная,) позволяет широко использовать кеторолак в практике травматолога: от обезболивания при ушибах и растяжениях в виде геля до аналгезии при больших оперативных вмешательствах, в том числе эндопротезировании крупных суставов. Об эффективности кеторолака может свидетельствовать тот факт, что Национальная футбольная лига (НФЛ) Северной Америки использует кеторолак в оральной или инъекционной форме для лечения повреждений опорно-двигательного аппарата и предотвращения послематчевой болезненности. В 2001 году было проведено исследование эффективности кеторолака в профессиональном спорте [Tokish, 2002] на основании данных его использования в командах НФЛ в течение сезона 2001. Результаты исследования показали, что 28 из 30 команд, которые были опрошены, использовали кеторолак. Введение кеторолака в день игры использовали 93 % опрошенных, 1-2 дня у 50-75 % игроков. Примечательно, что медицинский персонал НФЛ отмечал, что инъекционный кеторолак более мощный анальгетик, чем другие НПВС. В целом, в исследовании установлено, что использование кеторолака было безопасным и эффективным, результаты этого исследования привели к значительному расширению использования кеторолака среди спортсменов, в частности футболистов [ Matava M., 2012]. Основной задачей при острой травме остается необходимость прямого и быстрого поступления обезболивающего вещества в зону травмы. В условиях стадиона или гостиничного номера в случае спортивной травмы применение инъекционной формы препарата часто затруднительно. Быстрота наступления эффекта после перорального приема позволяет эффективно использовать таблетированную форму препарата в качестве системной аналгезии, кеторолак в аппликационной форме позволяет обеспечить поступление препарата непосредственно в травмированную зону. Дополнительное применение локальных форм препарата приводит к более значительному снижению интенсивности болевого синдрома, а также дает возможность сократить длительность приема таблетированных и инъекционных форм [Пастернак Д.В., 2014].
НПВП И КОНСОЛИДАЦИЯ ПЕРЕЛОМОВ. Процесс репаративной регенерации (консолидации) переломов является сложным и многоэтапным. Клеточные и молекулярные процессы консолидации можно разделить на следующие четыре стадии, которые частично перекрывают друг друга: (І) начальная воспалительная реакция, (ІІ) образование мягкой костной мозоли (фиброзного хряща), (ІІІ) формирование плотной костной мозоли, (IV) ремоделирование костной ткани [Корж Н.А., Горидова Л.Д, Романенко К.К., 2006; Корж Н.А., Дедух Н.В., Никольченко О.А., 2006].
Восстановление (репарация) костной ткани начинается с образования воспалительной гематомы, возникающей вследствие разрыва кровеносных капилляров в зоне перелома. Синтезируемые клетками цитокины стимулируют образование новых капилляров, внеклеточного матрикса, коллагена и миграцию в зону перелома мезенхимальных клеток, которые в последующем дифференцируются в остеобласты и хондробласты. На второй стадии синтезированные остеобластами и хондробластами протеины являются субстратом для формирование мягкой костной мозоли вокруг зоны репарации. На третьей стадии мозоль оссифицируется, образуя переплетающиеся мостики между фрагментами сломанной кости. Процесс репаративной регенерации перелома завершается стадией ремоделирования костной ткани, когда восстанавливаются исходная форма, структура и механическая прочность кости. Нарушения на любой из этих стадий могут привести к замедлению процессов консолидации или несращению фрагментов кости, которые чаще всего встречаются у пациентов, входящих в группу риска, в том числе у больных пожилого и старческого возраста.
Репаративная регенерация костной ткани – генетически запрограммированный процесс, однако, стадийно-временные характеристики ее течения зависят от множества факторов – как эндогенных, так и экзогенных. В настоящее время известно, что на темпы консолидации переломов могут влиять различные локальные и системные факторы, включая тип перелома, степень повреждения мягких тканей [Cruess R.L., Dumont J., 1975; Augat P., Margevicius K., Simon J. et al., 1998], недостаточная механическая плотность костной ткани [Claes L.E., Wilke H.J., Augat P. et al., 1995; Vigorita J.V., 1999; Yamaji T., Ando K., Wolf S. et al., 2001; Castellá F.B., Garcia F.B., Berry E.M. et al., 2004], точность репозиции отломков, возраст, несбалансированное питание, курение [Day S.M., DeHeer D.H., 2001; Pountos I., Georgouli T., Blokhuis T.J. et al., 2008], а также применение различных химиотерапевтических препаратов, кортикостероидов, некоторых антибиотиков [Pountos I., Georgouli T., Blokhuis T.J. et al., 2008; Pountos I., Georgouli T., Bird H. et al., 2011].
В последнее время большое внимание уделяется изучению влияния НПВП на консолидацию переломов, в связи с тем, что этот класс препаратов эффективно используется для лечения боли и воспаления при травмах и переломах [Wheeler P., Batt M.E., 2005; Patel D.S., Аdrian B.A., 2011; Pountos I., Georgouli Th., Calori G.M., Giannoudis P.V., 2012; Connizzo B.K., Yannascoli S.M., Tucker J.J. et al., 2013; Bailey Su., O’Connor J.P., 2013].
При анализе исследований по изучению влияния НПВП на остео- и хондрогенез, а также остеогенный потенциал мезенхимальных клеток [Pountos I., Georgouli Th., Calori G.M., Giannoudis P.V., 2012] продемонстрировано, что применение различные НПВП по-разному влияют на дифференцирование фибробластов, остеобластов и других клеток-предшественников в культуре мезенхимальных клеток человека. Неоднозначными остаются результаты экспериментальных исследований влияния НПВП на хондрогенез: одни авторы отрицают, другие подтверждают наличие эффекта (табл. 8). Однако нет данных относительно влияния ЦОГ-1 или ЦОГ-2 ингибиторов, позволяющих определить наличие влияния в связи с особенностями их селективности.
Табл. 8. Исследования по влиянию применению НПВП на клетки костного мозга и костной ткани ( In- Vitro).
|
Год / Исследование |
Используемая модель |
НПВП |
Результаты и выводы |
|
Chang et al., 2007 |
Человеческие мезенхимальные клетки и D1-клетки (мышиные) |
Индометацин (10, 100 μM), Целекоксиб (1, 10 μM) |
Ингибирование пролиферации при использовании обоих НПВП, но без значительного цитотоксического эффекта. Дополнительное введение ПГE-1, ПГE -2 и ПГF2a не нивелировало отрицательного эффекта |
|
Kellinsalmi et al., 2007 |
Человеческие мезенхимальные клетки |
Индометацин (1, 10, 100 μM), Парекоксиб (1, 10, 100 μM), (0,03, 0,3, 3 μM) |
Все изучаемые НПВП ингибиро-вали остеобластическую и остеокластическую дифференциацию. Отмечено значительное увеличение дифференциации адипоцитов, что указывает на усиление адипогенеза вместо остеогенеза |
|
Arpornmaeklong et al., 2008 |
Клеточная линия MC3T3-E1 свода черепа мыши |
Индометацин (0.1 μM), Целекоксиб (1,5, 3, 9 μM) |
Ингибирование роста клеток обоими НПВП. Индометацин оказывал более выраженный ингибирующий эффект, чем целекоксиб |
|
Abukawa et al., 2009 |
Костные клетки-предшественники |
Ибупрофен (0,1, 1, 3 ммоль/л) |
В концентрации 0,1 ммоль/л не оказывает какого-либо влияния на пролиферацию, уровень щелочной фосфатазы, минерализацию костного матрикса, тогда как при более высоких концентрациях отмечено его ингибирующее действие |
|
Chang et al., 2009 |
Человеческие oстеобласты |
Индометацин (0,1–1 μM), |
Ингибирование пролиферации всеми НПВП. Введение ПГE-1 , ПГE -2 и ПГF2a не нивелировало отрицательного эффекта |
|
Kolar et al., 2009 |
MG63 человеческие oстеобласты |
Целекоксиб (2, 10, 50 μM) |
Продемонстрирован пограничный эффект при концентрации 2 и 10 μM, доза 50 μM мкМ снижала потенциал клеток, секрецию остеопротегерина, стимулировала потребление кислорода и Glut-1-экспрессию |
|
Yoon et al., 2010 |
Человеческие клетки костного мозга |
Целекоксиб (10, 20, 40 μM ), Напроксен (100, 200, 300 μM) |
Отсутствие эффекта на содержание щелочной фосфатазы и кальция при отсутствии интерлейкина 1β. При его наличии эти показатели были достоверно выше при использовании самой высокой концентрации препаратов |
|
Guez et al., 2011 |
Человеческие клетки MG-63. Клетки остеосаркомы |
Индометацин (1–10 μM) Нимесулид (1–10 μM) Диклофенак (1–10 μM) |
Все НПВП оказывали тормозящее влияние на пролиферацию остеобластов. Достоверное влияние на ангиогенез при отсутствии влияния на синтез остеокальцина |
|
Müller et al., 2011 |
Клетки костного мозга лошади |
Флуниксин (10–1000 μM), Фенилбутазон (10–1000 μM), Meлоксикам (0,01–200 μM), Целекоксиб (0,01–200 μM) |
Низкие концентрации НПВП оказывали положительное влияние на пролиферацию клеток, тогда как высокие концентрации ее угнетали. Достоверное влияние на остеогенез при отсутствии такового на адипогенез и хондрогенез |
|
Pountos et al., 2011 |
Клетки костного мозга, костной ткани |
Диклофенак, Keторолак, Парекоксиб, Keтопрофен, Пироксикам, Meлоксикам, Лорноксикам (все от 0,001 до 100 μг/мл) |
Отсутствие влияния НПВП на пролиферацию клеток костного мозга при использовании средних концентраций НПВП. Отрицательный эффект НПВП при использовании высоких концентраций (более 100 μg/mL) |
Противоречивые результаты получены также и в экспериментальных исследованиях на животных (табл. 9).
Табл. 9. Экспериментальные исследования, в которых изучено влияние НПВП на консолидацию переломов.
|
ОТРИЦАТЕЛЬНОЕ ВЛИЯНИЕ НА КОНСОЛИДАЦИЮ ПЕРЕЛОМОВ |
|
Aспирин [Allen H.L., Wase A., Bear W.T., 1980] |
|
Целекоксиб [Bergenstock M., Min W., Simon A.M. et al., 2005; Simon A.M., O’Connor J.P., 2007] |
|
Диклофенак [Beck A., Krischak G., Sorg T. et al., 2003; Krischak G.D., Augat P., Sorg T. et al., 2007; Sen C., Erdem M., Gunes T. et al., 2007] |
|
Этодолак [Endo K., Sairyo K., Komatsubara S. et al., 2002; Endo K., Sairyo K., Komatsubara S. et al., 2005] |
|
Ибупрофен [Törnkvist H., Lindholm T.S., Netz P. et al., 1984; Obeid G., Zhang X., Wang X., Jeffcoat M., 1992; Altman R.D., Latta L.L., Keer R. et al., 1995; Leonelli S.M., Goldberg B.A., Safanda J. et al., 2006; O’Connor J.P., Capo J.T., Tan V. et al., 2009] |
|
Индометацин [Altman R.D., Latta L.L., Keer R. et al., 1995; Reikeraas O., Engebretsen L., 1998; Long J., Lewis S., Kuklo T. et al., 2002; Brown K.M., Saunders M.M., Kirsch T. et al., 2004] |
|
Keтопрофен [Martins MV, da Silva MA, Medici Filho E. et al., 2005] |
|
Keторолак [Ho M.L., Chang J.K., Wang G.J., 1998; Martin G.J.Jr., Boden S.D., Titus L., 1999; Gerstenfeld L.C., Thiede M., Siebert K. et al. 2003; Gerstenfeld L.C., Al-Ghawas M., Alkhiary Y.M. et al., 2007] |
|
Mелоксикам [Karachalios T., Boursinos L., Poultsides L. et al., 2007; Ribeiro F.V., César-Neto J.B., Nociti F.H.Jr. et al., 2006] |
|
Напроксен [Goodman S., Ma T., Trindade M. et al., 2002; Kaygusuz M.A., Turan C.C., Aydin N.E. et al., 2006] |
|
Парекоксиб [Gerstenfeld L.C., Thiede M., Siebert K. et al., 2003] |
|
Рофекоксиб [Goodman S., Ma T., Trindade M. et al., 2002; Leonelli S.M., Goldberg B.A., Safanda J. et al., 2006; O’Connor J.P., Capo J.T., Tan V. et al., 2009; Goodman S.B., Ma T., Mitsunaga L. et al., 2005; Murnaghan M., Li G., Marsh D.R., 2006] |
|
Теноксикам [Sen C., Erdem M., Gunes T. et al., 2007; Giordano V., Giordano M., Knackfuss I.G. et al., 2003] |
|
Вальдекоксиб [Gerstenfeld L.C., Al-Ghawas M., Alkhiary Y.M. et al., 2007] |
|
ОТСУТСТВИЕ ОТРИЦАТЕЛЬНОГО ЭФФЕКТА НА КОНСОЛИДАЦИЮ ПЕРЕЛОМОВ |
|
Целекоксиб [Long J., Lewis S., Kuklo T. et al., 2002; Mullis B., Copeland S., Weinhold P. et al., 2002; Brown K.M., Saunders M.M., Kirsch T. et al., 2004; Mullis B.H., Copland S.T., Weinhold P.S. et al., 2006] |
|
Диклофенак [Tiseo B.C., Namur G.N., de Paula E.J. et al., 2006] |
|
Эторикоксиб [Fracon R.N., Teófilo J.M., Moris L.C., Lamano T., 2010] |
|
Ибупрофен [Törnkvist H., Lindholm T.S., 1980; Huo M.H., Troiano N.W., Pelker R.R., Gundberg C.M., Friedlaender G.E., 1991; Mullis B.H., Copland S.T., Weinhold P.S. et al., 2006] |
|
Индометацин [Elves M.W., Bayley I., Roylance P.J., 1982;; Sudmann E., Tveita T., Hald Jr.J., 1982; Boiskin I., Epstein S., Ismail F. et al., 1988; Mbugua S.W., Skoglund L.A., Løkken P., 1989; Keller J., Kjaersgaard-Andersen P., Bayer-Kristensen I., Melsen F., 1990; Persson P.E., Sisask G., Nilsson O., 2005; Mullis B.H., Copland S.T., Weinhold P.S. et al., 2006] |
|
Keтопрофен [Urrutia J., Mardones R., Quezada F., 2007; van der Heide H.J., Hannink G., Buma P., Schreurs B.W., 2008] |
|
Keторолак [Mullis B.H., Copland S.T., Weinhold P.S. et al., 2006; Fracon R.N., Teófilo J.M., Moris L.C., Lamano T., 2010] |
|
Meлоксикам [van der Heide H.J., Hannink G., Buma P., Schreurs B.W., 2008] |
|
Нимесулид [Teófilo J.M., Giovanini G.S., Fracon R.N., Lamano T., 2011] |
|
Рофекоксиб [Mullis B.H., Copland S.T., Weinhold P.S. et al., 2006; Tiseo B.C., Namur G.N., de Paula E.J. et al., 2006; Hak D.J., Schulz K.S., Khoie B., Hazelwood S.J., 2011] |
|
ОТСУТСТВИЕ ОТРИЦАТЕЛЬНОГО ЭФФЕКТА ПРИ КРАТКОВРЕМЕННОМ НАЗНАЧЕНИИ |
|
Диклофенак [Krischak G.D., Augat P., Sorg T. et al., 2007; Utvåg S.E., Fuskevåg O.M., Shegarfi H., Reikerås O., 2010] |
|
Keтопрофен [Nyangoga H., Aguado E., Goyenvalle E., 2010] |
|
Keторолак [Reikeraas O., Engebretsen L., 1998] |
|
Парекоксиб [Utvåg S.E., Fuskevåg O.M., Shegarfi H., Reikerås O., 2010] |
|
Рофекоксиб [Karachalios T., Boursinos L., Poultsides L. et al., 2007; Goodman S.B., Ma T., Mitsunaga L. et al., 2005] |
|
Вальдекоксиб [Utvåg S.E., Fuskevåg O.M., Shegarfi H., Reikerås O., 2010] |
К сожалению, на сегодняшний день существует немного ретроспективных и еще меньше проспективных рандомизированных клинических исследований по изучению консолидации переломов при приеме НПВП и у пациентов после оперативных вмешательств на позвоночнике (табл. 10). В двойном слепом рандомизированном исследовании Adolphson и соавт. (табл. 11) продемонстрировали отсутствие влияния пироксикама на консолидацию переломов Коллиса у 42 постменопаузальных женщин. В другом подобном исследовании Davis и Ackroyd не выявили отрицательного влияния ибупрофена на темпы консолидации перелома Коллиса. В исследовании у пациентов с цементным эндопротезированием тазобедренного сустава применение индометацина не оказывало какого-либо эффекта на состояние эндопротеза. Также в рандомизированном исследовании Sculean и соавт. не установлено какого-либо влияния рофекоксиба при заживлении внутрикостного перидонтального дефекта. В отличие от вышесказанного в ретроспективных исследованиях пациенты, принимающие НПВП после переломов, имели более высокий риск нарушений консолидации перелома по сравнению с контрольной группой. Bhattacharyya и соавт. подтвердили увеличение в 3,7 раза нарушений консолидации перелома в течение 90 дней после его возникновения у пациентов, принимающих НПВП, и в 1,6 раза при приеме опиоидных анальгетиков.
Табл. 10. Влияние НПВП на прогноз при проведении спондилодеза.
|
Исследование / год |
Дизайн |
НПВП |
Выводы и рекомендации |
|
Vitale et al., 2003 |
Ретроспектива анализ данных 208 детей, перенесших коррегирующие операции при сколиозе |
Keторолак |
Нет достоверного увеличения частоты осложнений |
|
Park et al., 2005 |
Ретроспективный анализ данных 88 пациентов, перенесших заднелатеральный спондилодез |
Keторолак |
Частота неполного сращения или несращения была выше у пациентов, получающих кеторолак |
|
Pradhan et al., 2008 |
Ретроспективный анализ данных 405 пациентов перенесших один, два или трехуровневый заднелатеральный спондилодез |
Keторолак |
Использование кеторолака для вспомогательного обезболивания в течение 48 часов после операции не оказывает существенного влияния эффективность спондилодеза |
|
Sucato et al., 2008 |
Ретроспективный анализ данных 319 пациентов, перенесших коррегирующие операции при сколиозе |
Keторолак |
Кеторолак не увеличивал частоту развития пвевдоартрозов при его использовании в качестве дополнения для послеопера-ционного обезболивания |
|
Lumawig et al., 2009 |
Ретроспективный анализ данных 273 пациентов, перенесших один или двухуровнеый заднепоясничный спондилодез |
Диклофенак |
Диклофенак натрия показал дозозависимое отрицательное влияние при проведении спондилодеза, особенно при использовании его в ближайшем послеоперационном периоде |
|
Horn et al., 2010 |
Ретроспективный анализ данных 46 детей , перенесших спондилодез при сколиозе |
Keторолак |
Нет клинических или рентгенологических признаков прогрессирования сколиоза и несращения |
Табл. 11. Влияние НПВП на консолидацию переломов у человека.
|
Исследование / год |
Дизайн |
НПВП |
Выводы и рекомендации |
|
Davis и Ackroyd, 1988 |
Проспективное двойное слепое исследование 100 пациентов с переломом Коллиса |
Флурипрофен 150 мг/д |
Нет какого-либо эффекта |
|
Adolphson et al., 1993 |
Рандомизированное двойное слепое исследование 42 постменопаузальных женщин с переломом Коллиса |
Пироксикам |
Нет снижения скорости зажив-ления переломов. Пациенты, получавшие пироксикам, имели значительно меньшую выражен-ность болевого синдрома. Нет различий в скорости восстановления функций |
|
Butcher и Marsh, 1996 |
Ретроспективный анализ данных 94 пациентов с переломами костей голени |
Не указано |
Увеличение длительности сроков заживления перелома на 7,6 нед. (P = 0,0003) (16,7 нед. и 24,3 нед.) |
|
Wurnig et al., 1999 |
Проспективное исследование с учас-тием 80 пациентов, получавших индоме-тацин для профилак-тики при тотальном цементном эндопротезировании по сравнению с 82 пациентов контроля |
Индометацин (100 мг/д ) |
Нет отрицательного эффекта при цементном эндопротезировании |
|
Giannoudis et al., 2000 |
Ретроспективный анализ данных 377 пациентов с переломами, леченных остеосинтезом |
Ибупрофен и диклофенак |
Увеличенный риск несращения у пациентов, принимавших НПВП |
|
Bhandari et al., 2003 |
Ретроспективный анализ данных 192 больных с переломом костей голени |
Не указано |
Относительный риск несращения 2,02 (P=0,04) для пациентов, принимавших НПВП |
|
Burd et al., 2003 |
Ретроспективный анализ данных 282 пациентов с переломами вертлужной впадины |
Индометацин |
Пациенты, получавшие индометацин, имели больший риск развития несращения |
|
Sculean et al., 2003 |
Рендомизированное слепое исследование с участием 20 пациентов с глубоким внутрикостным дефектом |
Рофекоксиб (25 мг/д 14 дней) |
Нет влияня на консолидацию при внутрикостном периодонтальном дефекте |
|
Bhattacharyya et al., 2005 |
Ретроспективный анализ данных 9995 пациентов с переломом плечевой кости, лечившихся консервативно |
Не указано |
Прием неселективных НПВП в период 61–90 день после перелома был ассоциирован с большей частотой несращения переломов |
|
Meunier et al., 2009 |
Рандомизированное исследование с участием 50 пациентов, перенесших тотальное эндопротезирование коленного сустава |
Целекоксиб (200 мг/д) |
Нет различий в стабильности эндопротеза, выраженности боли, объеме движений и субъективном статусе через 2 года после операции |
Таким образом, учитывая данные экспериментальных и клинических исследований существует необходимость проведения больших рандомизированных исследований по влиянию НПВП у пациентов с переломами. В настоящее время не существует каких-либо клинических и/или научных доказательств для отмены использования НПВП у больных с переломами. Большинство доступных доказательств базируются на результатах исследований, проведенных на животных и эти результаты следует интерпретировать с осторожностью в связи с существующими отличиями в физиологических механизмах консолидации переломов у человека и животных. В связи с этим существует необходимость проведения дальнейших исследований для определения механизмов влияния НПВП на клетки костной ткани, а также проведение рандомизированных проспективных клинических исследований. Использование НПВП с выраженным обезбаливающим эффектом (кеторолак) короткими курсами, очевидно, будет снижать риск несращения и замедленного сращения у пациентов с переломами.
ОПТИМАЛЬНО Е ИСПОЛЬЗОВАНИЕ АНАЛЬГЕТИЧЕСКИХ СРЕДСТВ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ. Преимущества адекватного обезболивания хорошо известны. Тем не менее, купирование послеоперационного болевого синдрома остается сложной проблемой, частота недостаточного снижения послеоперационной боли остается тревожно высокой, 7 из 10 пациентов ощущают интенсивную боль в послеоперационном периоде [Breivik H. еt al. 2008, White P.et al., 2010]. Неадекватное снижения болевого синдрома может быть связано с недостаточным или неправильным применением имеющихся анальгетиков, в частности, из-за значительного количество новых препаратов и противоречивой информация о них.
Продолжается традиционное использование опиатов, вместо мультимодальных опиатосодержащих схем [White P. et al., 2010, Gerbershagen H. еt al., 2013], хотя в некоторых исследованиях продемонстрирован рост распространенности побочных эффектов, связанных с опиатами [Frasco P. еt al, 2005, Vila H.Jr., 2005].
Объединенная комиссия[1] объявила боль “Пятым жизненно важным параметром” наряду с температурой тела, частотой пульса, частотой дыхания и артериальным давлением. Объединенная комиссия также подчеркивает необходимость достижения целевого уровня снижения болевого синдрома (4 балла и ниже по 10-ти бальной визуально-аналоговой шкале) [White P., Kehlet H., 2007]. К сожалению, не во всех случаях болевой синдром может быть ликвидирован, но достижение целевой точки терапии возможно. Снижение боли ниже 4-х баллов за счет применения высоких доз опиатов может быть небезопасным для пациента.
Одним из важных этапов в разработке оптимального подхода к лечению болевого синдрома является понимание степени боли при различных хирургических процедурах, особенно с точки зрения применения привычных методов обезболивания. Было проведено исследования интенсивности болевых синдромов после широкого спектра хирургических вмешательств под руководством Gerbershagen H. Удивительно, но результаты исследования показали, что некоторые «малые» хирургические процедуры, которые, как правило, осуществляются в амбулаторных условиях или требуют краткосрочного пребывания в стационаре (например, лапароскопическая аппендэктомия, лапароскопическая холецистэктомия, удаление миндалин, или геморроидэктомия) были связаны с высокой интенсивностью боли, в то время как пациенты, перенесшие некоторые из «больших» хирургических вмешательств отмечали более низкие показатели боли [Gerbershagen H. еt al., 2013]. Интенсивность боли, регистрируемая в послеоперационном периоде, зависит как от вида оперативного вмешательства, так и от методов обезболивания. Таким образом, наиболее вероятной причиной таких результатов исследования является заблуждение, что пациенты, подвергающиеся хирургическим процедурам с репутацией более болезненных, нуждаются в серьезном адекватном обезболивании, а в случае «малых» оперативных вмешательств нет необходимости в комплексной аналгезии.
Как указывают авторы исследования «После многих лапароскопических операций пациенты часто жалуются на сильную боль, но не получают опиаты вообще или только в малых дозах…». Кроме того, данные этого исследования подтверждают мнение, что болевые ответы пациента различны, и не существует прямой зависимости между степенью повреждения тканей и интенсивностью болевого синдрома. Поэтому, массивность обезболивающей терапии должна зависеть не только от вида оперативного вмешательства, но и от жалоб пациента на боль. Дозы и кратность введения препаратов должны быть связаны с бальной оценкой болевого синдрома. Важно отметить, что цель любого лечения болевого синдрома – улучшение клинического исхода операции и ранняя мобилизация больного, а не достижение конкретной оценки боли.
Среди НПВП, используемых в послеоперационном периоде, наибольшее применение находят препараты, имеющие форму для парентерального введения ( кеторолак, диклофенак, кетопрофен, лорноксикам).
Для применения в послеоперационном периоде НПВП должен обладать следующими свойствами [Ферранте М., 1998]:
– достаточно снижать интенсивность боли;
– обратимо ингибировать циклооксигеназу;
– вызывать быстрое наступление эффекта;
– иметь короткий период полувыведения;
– не вызывать осложнений в месте инъекции при внутримышечном введении.
Из НПВП наиболее изученным в клинических исследованиях, посвященным обезболиванию после операционных вмешательств является кеторолак. Так, в эксперименте установлено, что аналгетическая активность кеторолака превышает активность ацетилсалициловой кислоты в 350 раз, напроксена – в 50, индометацина – в 6, противовоспалительная активность кеторолака превышает активность фенилбутазона в 36 раз, индометацина – примерно в 2 раза и напроксена – в 3 раза [Зубеев П.С., Кудыкин М.Н., 2013].
По данным метаанализа, опубликованного в 2012 году, показано, что разовое периоперационное (пре- или интраоперационное) введение 60 мг кеторолака приводит к снижению интенсивности болевого синдрома в раннем послеоперационном периоде (0-24 часа), как в состоянии покоя, так и при движении. Кроме того, достоверно снижется употребление опиатов у этих пациентов, а также значительно снижается частота послеоперационной тошноты и рвоты [De Oliveira G.S. et al., 2012].
При введении в послеоперационном периоде кеторолак характеризуется быстрым, сравнимым с эффектом морфина, началом действия и большей продолжительностью купирования болевого синдрома [Gwirfz К.Н. et al., 1995]. Проведенное исследование сравнительной эффективности различных анальгетиков показало, что применение кеторолака (30 мг) у послеоперационных больных снижало потребность в дополнительном назначении наркотических анальгетиков больше, чем использование диклофенака или кетопрофена [Kostamovaara P. et al., 1998].
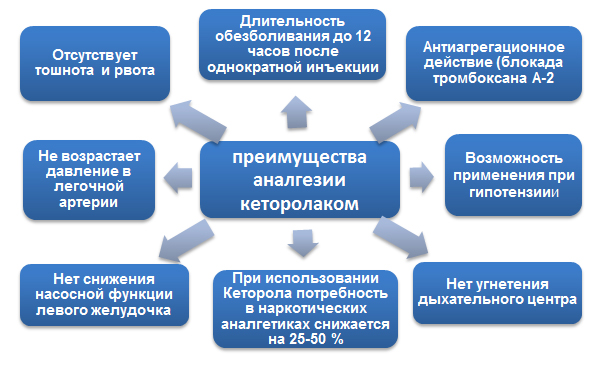
Рис. 2. Преимущества анальгезии кеторолаком (на основании исследований кеторола) по сравнению с наркотическими анальгетиками (морфин, промедол) и нейролептаналгезией (фентанил, дроперидол).
Эффективность кеторолака доказана в снижении болевого синдрома и уменьшении побочных эффектов, связанных с приемом морфина, а также в снижении дозы морфина при использовании контролируемой пациентом анестезии у пациентов с «большими» ортопедическими оперативными вмешательствами.
Одним из факторов, ограничивающих применение НПВП при оперативных вмешательствах, является риск увеличения кровопотери. В 4-х исследованиях, изучавших применение НПВП при эндопротезировании тазобедренного сустава с включением 515 пациентов [An, 1991; Коннелли, 1991; Robinson, 1993; Slappendel, 2002], установлен показана больший объем кровопотери во время операции в сравнении с таковым при использовании других анестетиков на дооперационном этапе и только применение кеторолака не приводило к увеличению кровопотери, что показано в отдельном исследовании (введение кеторолака в дооперационном периоде внутримышечно не было связано со значительным увеличением интра- или послеоперационного кровотечения по сравнению с использованием опиоидных анальгетиков [Weale, 1995]) .
В послеоперационном периоде доказана высокая эффективность неселективных НПВП и кеторолака, в частности, по сравнению с плацебо (кеторолак продемонстрировал превосходство в сравнении с плацебо по 10-ти бальной визуально-аналоговой шкале: внутривенно 60 мг [Fletcher, 1995] и 30 мг внутримышечно [Фогарти 1995]. При сравнении различных НПВП кеторолак показал такую же эффективность в снижении болевого синдрома и уменьшении дополнительного приема наркотических средств, как диклофенак и кетопрофен [Kostamovaara K., 1998]. Один из алгоритмов обезболивания при проведении эндопротезирования тазобедренного сустава в послеоперационном периоде (из материалов PROSPECT WORKING GROUP) представлен на рис. 3.
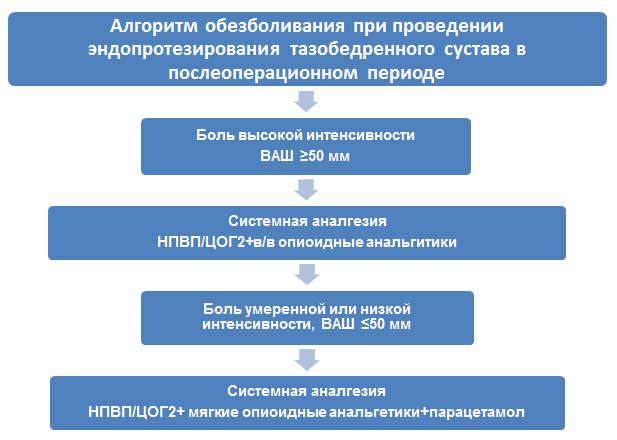
Рис. 3. Алгоритм приведен из материалов PROSPECT WORKING GROUP ( http :// www . postoppain . org / frameset . htm ).
Также доказана эффективность кеторолака при применении в послеоперационном периоде после эндопротезирования коленного сустава [Rasmussen R., 2002 ]. Существует также ряд исследований доказывающих, что профиль безопасности кеторолака при применении в составе мультимодальной анестезии не отличается от профиля диклофенака и кетопрофена и значительно превышает профиль опиоидных анальгетиков. Ни один другой представитель НПВП не имеет такой доказательной базы при применении в составе мультимодальной анестезии.
Таким образом, на сегодняшний день проблема адекватного обезболивания при травмах и переломах является особенно актуальной. Принципиальным моментом, который следует учитывать при выборе НПВС, считается скорость достижения клинического эффекта, что имеет особое значение при купировании острых болевых синдромов. Известно, что НПВС с хорошей биодоступностью, максимально быстро создающие высокую пиковую концентрацию в крови, являются наиболее эффективными средствами для ургентного обезболивания. В связи с этим использование различных форм кеторолака эффективно для купирования острого болевого синдрома, не оказывает отрицательного влияния на темпы консолидации переломов, а комбинированное использование с опиатами в составе мультимодальной анестезии имеет хорошую доказательную базу.