Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Новые возможности в достижении контроля бронхиальной астмы"
Автор: Юдина Л.В. доцент кафедры фтизиатрии и пульмонологии Национальной академии последипломного образования им. П.Л.Шупика, г. Киев, Украина.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Пульмонология, Семейная медицина/Терапия
Просмотров: 2 658
Дата проведения:
 Бронхиальная астма (БА) по определению GINA 2014 – это гетерогенное заболевание, обычно характеризующееся хроническим воспалением дыхательных путей. Определяется наличием в анамнезе респираторных симптомовтаких как: одышка, затрудненное дыхание, чувство сдавления в груди, кашель, которые варьируют во времени и по своей интенсивности и связаны с вариабельным ограничением экспираторного потока.Симптомы БА могут проходить спонтанно, либо под действием медикаментов, могут отсутствовать на протяжении недель или месяцев. Обычно астма ассоциирована с гиперреактивностью дыхательных путей.
Бронхиальная астма (БА) по определению GINA 2014 – это гетерогенное заболевание, обычно характеризующееся хроническим воспалением дыхательных путей. Определяется наличием в анамнезе респираторных симптомовтаких как: одышка, затрудненное дыхание, чувство сдавления в груди, кашель, которые варьируют во времени и по своей интенсивности и связаны с вариабельным ограничением экспираторного потока.Симптомы БА могут проходить спонтанно, либо под действием медикаментов, могут отсутствовать на протяжении недель или месяцев. Обычно астма ассоциирована с гиперреактивностью дыхательных путей.
Бронхиальная астма является причиной смерти до 250 тысяч человек в год и приводит к потере до 15 млн. пациенто-лет с поправкой на инвалидность во всем мире. Социально-экономическая значимость бронхиальной астмы возрастает в последнее время, и в ряде стран это заболевания стало основной причиной временной нетрудоспособности.
Особенностью течения бронхиальной астмы является то, что даже несмотря на наличие достаточно распространенных и доступных методов оценки контроля бронхиальной астмы, а также эффективных базисных препаратов, более 50% пациентов не достигают контроля над заболеванием, и этот показатель не имеет тенденции к уменьшению. Базисная терапия бронхиальной астмы включает в себя глюкокортикостероиды, которые, как правило, назначаются ингаляционно и бронхолитические препараты длительного действия. До последнего времени в качестве препаратов длительного действия применялись только β2-агонисты (ДДБА). Комбинация (ИГКС + ДДБА) рекомендована для пациентов, не достигающих контроля на фоне монотерапии ингаляционными глюкокортикостероидами (ИГКС). При отсутствии контроля БА таким больным могут быть назначены антагонисты лейкотриеновых рецепторов, моноклональные антитела к иммуноглобулину (Ig) класса Е, (омализумаб), системные глюкокортикостероиды. Использование рекомендованных препаратов позволило увеличить процент пациентов, достигших хорошего контроля до 49 % [1, 2]. Однако в последние годы тенденция, результатом которой было увеличение доли больных с хорошим контролем над БА, практически исчерпала себя. Например, в пяти странах Европы с 2006 по 2010 г. не было отмечено значимого улучшения контроля над заболеванием [3,4]. В эпидемиологических исследованиях установлено, чтоу 51–59% больных БА не удается контролировать течение заболевания. Во многом это зависит от таких параметров, как:
 – выбор лекарственного средства с учетом тяжести БА;
– выбор лекарственного средства с учетом тяжести БА;
– выбор средства ингаляционной доставки с учетом размера ингалятора, простоты его применения, стоимости, отсутствия раздражающего действия, неприятного вкуса и запаха, которые могут оказать влияние на комплайенс и эффективность терапии;
– особенностей анатомии и физиологии дыхательных путей, которые зависят от возраста и клинического состояния больного;
– особенностей когнитивного статуса пациента;
– резистентность к ИГКС и генетический полиморфизм β2-адренорецепторов [5–8].
Таким образом,дальнейший прогресс в фармакотерапии БА был невозможен без новых терапевтических решений, позволяющих устранить влияние этих факторов.
В исследованиях последних лет было выявлено, что у больных с неконтролируемой БА использование тиотропия позволяет увеличить показатели спирометрии и снизить риск обострений заболевания [9].Поэтому при отсутствии контроля пациентам с БА GINA рекомендует в качестве бронхолитика длительного действия использовать не только ДДБА, но и добавлять холинолитик длительного действия (ХДД) тиотропиум бромид.
Назначение этого препарата имеет под собой физиологическое обоснование. Известно, что парасимпатическая нервная система составляет важную часть нейрогенного механизма, контролирующего тонус гладких мышц. Стимуляция парасимпатических нервов приводит к бронхоконстрикции, бронхиальной вазодилатации и гиперсекреции слизистых желез. Все эти эффекты осуществляются через мускариновые рецепторы [10]. В настоящее время известно пять типов мускариновых рецепторов (М1–М5), однако только М1-, М2- и М3-рецепторы существуют в дыхательных путях человека. М3-рецептор бронхиальных гладкомышечных клеток играет особую роль в патофизиологии БА – индуцирует бронхоконстрикцию и секрецию слизи [11,12]. Эффективность М-холинолитиков именно у наиболее тяжелых больных БА можно объяснить с двух позиций (4). Известно, что частые ингаляции β2-агонистов приводят к снижению чувствительности (десенситизация) и сокращению числа функционально активных β2-адренорецепторов (down-регуляция) в тканях дыхательных путей [15]. Таким образом, эффективность β2-агонистов при лечении тяжелой БА может быстро истощаться, в то время как бронхолитическое действие М-холинолитиков остается стабильным [16]. Уменьшение количества активных β2-адренорецепторов отмечается как у больных БА, так и при ХОБЛ, причем постоянный прием ДДБА приводит к более значительному снижению чувствительности рецепторов [17].
М2-холинорецепторы расположены на пресинаптических мембранах. Стимуляция М2-холинорецепторов приводит к значительному снижению выделения ацетилхолина. Таким образом, М2-холинорецепторы защищают дыхательные пути от чрезмерного влияния парасимпатической системы на мышцы бронхов [23]. В то же время целый ряд патологических состояний у больных БА может приводить к стойкой утрате М2-холинорецепторов. Так, количество M2-холинорецепторов сокращается под воздействием протеинов, которые выделяют эозинофилы. Влияние активных форм кислорода, нейраминидазы вирусов и ряд других факторов также приводят к дефициту М2-холинорецепторов и усилению парасимпатического влияния на мускулатуру бронхов [24].Наконец, количество M2-холинорецепторов сокращается в ночные часы, под воздействием циркадных ритмов, что может иметь значение для больных с ночной БА [25]. Еще в конце1980-х годов было показано, что у больных БАвлияние ингаляционных холинолитиков на объем форсированного выдоха за 1-ю секунду (ОФВ1)наиболее выражено в ночные часы (рис. 1) [26].
Пресинаптический М2-рецептор обеспечивает отрицательную обратную связь, уменьшая дальнейшее высвобождение ацетилхолина [13]. Повышенным высвобождением ацетилхолина из холинергических нервных окончаний и нарушенной экспрессией мускариновых рецепторов (повышенной экспрессией М1- и М3-рецепторов или снижением экспрессии М2) можно объяснить чрезмерный бронхоспазм у больных БА [14].
Холинергические механизмы играют и определенную роль в формировании позднего аллергического ответа у больных БА. У больных тяжелой БА на фоне гиперинфляции роль этих механизмов может быть особенно велика. Парасимпатическая иннервация может иметь важное значениеи у пациентов преклонного возраста, у курящих, при ночной БА, у детей первых лет жизни, у которых, как известно, имеется функциональное преобладание М-холинорецепторов в дыхательных путях. Вместе с тем различные фенотипы БА: с тяжелым течением, у пожилых, ночная БА, БА нафоне ожирения и БА у курящих – следует рассматривать как клинические формы заболевания, при которых обычно не удается обеспечить контроль над симптомами из-за недостаточного ответа на ГКС [18, 19]. Поэтому изучение терапевтического потенциала М-холинолитиков у таких больных представляется особенно актуальным.
Среди больных тяжелой БА существует ещеодна группа с плохим ответом на стандартную терапию. Это больные с генетическим полиморфизмом b2-адренорецепторов. Мутации, приводящиек замене одной из аминокислот в структуре рецептора, обусловливают более тяжелое течение заболевания, снижают терапевтический ответ и ускоряют процессы десенситизации рецепторов при назначении β2-агонистов [8, 20, 21].
Таким образом, повышение парасимпатического тонуса при БА обусловлено несколькими механизмами: избыточной афферентной стимуляцией в результате воспаления в слизистой оболочке нижних дыхательных путей, нарушенной экспрессией мускариновых рецепторов, увеличенным высвобождением ацетилхолина из парасимпатических нервных окончаний и снижением уровня нейромодуляторов, уменьшающих парасимпатический тонус. Дисфункция холинергической нервной системы, проявляющаяся в избыточных холинергических стимулах, вносит свою лепту в формирование патофизиологии БА. Поэтому можно ожидать положительные эффекты от антихолинергических препаратов для лечения БА. У таких пациентов применение М-холинолитиков (тиотропиум бромид) может внести дополнительный вклад в достижение контроля над БА.Тиотропиум бромид является четвертичным аммониевым основанием, производным ипратропия. Он относится ко второму поколению антихолинергических препаратов и является М – холиноблокатором длительного действия. Тиотропия бромид выпускается в виде порошка, который применяется с помощью доставочного устройства ХандиХалер и раствора для ингаляций, который назначается с помощью ингалятора Респимат. Преимуществами данного устройства являются:
- Ингалятор Респимат, обеспечивая выделение препарата на протяжении 1,5 сек, создает медленное облако аэрозоля, которое существует в 7–10 раз дольше, чем облако, создаваемое ДАИ;
- Используется водный раствор (отсутствует пропеллент/носитель)
- Создается высокая и стабильная легочная депозиция, не зависящая от степени обструкции и силы вдоха. В результате ингалятор Респимат способен в несколько раз по сравнению с ДАИ увеличить депозицию препарата в нижних дыхательных путях.
- Ингалятор прост в использовании, существенно снижает последствия ошибок, связанных с недостаточной координацией вдоха больным;
- Это многодозовое устройство, имеется счетчик доз, пустое устройство блокируется.
- Достигается хорошийкомплайенс пациентов.
- Отсутствует риск микробного загрязнения
Таким образом, Респимат Спирива® сочетает в себе лучшие фармакологические, фармацевтические качества для эффективного лечения БА!
По сравнению с другими антихолинергическими средствами тиотропия бромид проявляет высокую специфическую селективность и сродство с мускариновыми рецепторами, блокируя все их виды. Тиотропиум бромид диссоциирует с М1- и М3-рецепторами в 100 раз медленнее, чем ипратропиум бромид, и, напротив, очень быстро с М2-рецепторами. Этот факт определяет уникальную кинетическую селективность лекарственного средства в отношении М3- и М1-рецепторов и минимальное взаимодействие с М2-рецепторами. Медленная же диссоциация тиотропиума с М3-рецепторами гладкомышечных клеток и слизеобразующих элементов дыхательных путей объясняет значительную продолжительность действия препарата, дающую возможность его однократного применения в сутки. Результатом ингибирования М3-рецепторов в дыхательных путях является расслабление гладкой мускулатуры. Тиотропиум бромид имеет еще ряд особенностей. Так, например, тиотропиум не стимулирует выброс ацетилхолина (АЦХ).
Первые исследования эффективности тиотропия бромида у больных БА продемонстрировали, что он обладает быстро развивающимся и длительно сохраняющимся бронхолитическим действием и уменьшает бронхиальную гиперреактивность [31]. В исследовании S.P. Peters и соавт. [31] показано, что тиотропия бромид может стать альтернативой повышению (удвоению) дозы ИГКС у больных БА, неадекватно контролируемой низкими дозами ИГКС. В этом слепом исследовании, включавшем 210 взрослых больных БА, не контролируемой монотерапией 160 мкг беклометазона дипропионата (БДП), эффективность добавления к БДП (160 мкг/сут) тиотропия бромида (18 мкг/сут) сравнивали с удвоением дозы БДП (320 мкг/сут) и с добавлением к БДП (160 мкг/сут) салметерола (100 мкг/сут).
Первичной оценкой эффективности была утренняя пиковая скорость выдоха (ПСВ). Как видно из рис. 1, тиотропия бромид, добавленный к ИГКС, значительно улучшал утреннюю и вечернюю ПСВ по сравнению с удвоением дозы ИГКС. Аналогичный эффект был достигнут и в результате добавления сальметерола. Тиотропия бромид и сальметерол значимо повлияли и на увеличение объема форсированного выдоха за первую секунду (ОФВ1), оба препарата уменьшили симптомы БА и улучшили качество жизни больных по сравнению с удвоением БДП. Оказалось, что после назначения сальметерола контроль над БА улучшился у 16% больных. Хороший ответ на терапию тиотропиум наблюдался у 23% пациентов и одинаково хороший ответ и на сальметерол, и на тиотропий – еще у 29%. Это исследование показало возможность достижения контроля БА не только с помощью ДДБА, но и за счет добавления к ИГКС длительно действующего антихолинергического препарата тиотропия бромида.
Рисунок 1. Добавление тиотропиума к базисной терапии БА.
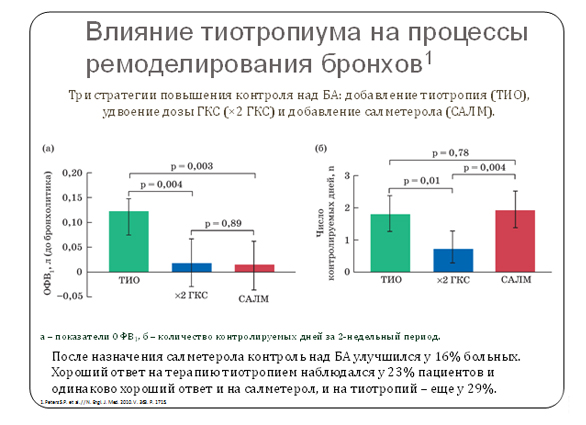
Исследование было с перекрестным дизайном, поэтому эффект разных стратегий можно было оценить у каждого пациента. На основании проведенного анализа было сделано несколько важных выводов.
Во-первых, большое число больных отвечали только на сальметерол или только на тиотропия бромид, что позволяет предположить разные механизмы формирования бронхиальной обструкции и симптомов у этих пациентов. Данный факт подтверждается результатами исследования, проведенного у пациентов с тяжелой БА, не контролируемой ИГКС + ДДБА [31]. Добавление к ИГКС + ДДБА тиотропия бромида привело к увеличению функции легких и снижению частоты тяжелых обострений БА.
Во-вторых, результаты анализа предикторов показали, что пациенты с доминированием тонуса парасимпатической нервной системы (определяли по частоте сердечных сокращений: склонностькбрадикардии), а также более молодые пациенты (< 42 лет) имели лучший ответ на тиотропия бромид по некоторым показателям (дни контролируемой БА).
Результаты этого исследования позволяют в будущем разработать персонализированные подходы для оптимизации контроля над БА. Тиотропиуму будет отведено важное место, так как у 52% больных после назначения тиотропия доля дней с хорошим контролем над БА увеличилась более чем на 10%.С2012 г. тиотропиум активно внедряется в клинические рекомендации по лечению БА.
Бронходилатирующий эффект зависит от дозы и сохраняется не менее 24 ч. Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием. Проведенные исследования продемонстрировали минимальную системную абсорбцию тиотропиума, что определяет высокую безопасность и незначительные нежелательные эффекты препарата при его длительном назначении. Тиотропиум бромид назначается 1 раз в сутки. После ингаляции однократной дозы среднее время наступления бронхолитического эффекта составляет 30 минут, среднее время достижения максимального эффекта – три часа и пик терапевтической эффективности достигается через одну неделю терапии [22–24, 27]. Подсчитано, что тиотропия бромид в стабильной концентрации будет занимать менее 5% мускариновых рецепторов. Этим можно объяснить относительно низкую частоту системных побочных реакций [25]. При этом нет свидетельств аккумуляции препарата при повторных назначениях.
Могут ли антихолинергические средства претендовать на роль препаратов, влияющих на процессы воспаления у больных БА, или их роль ограничивается бронхолитическим действием? В исследованиях на биологических моделях БА было выявлено, что тиотропия бромид способен предотвращать развитие гиперплазии бокаловидных клеток, а также фиброза, связанного с перибронхиальным отложением коллагена. Кроме того, тиотропий уменьшал число клеток воспаления, уровень воспалительных цитокинов и предотвращал развитие гипертрофии мышц бронхов [36]. Эти результаты заставляют пересмотреть представление о тиотропиуме как препарате, действие которого ограничивается бронхолитическим эффектом. По-видимому, тиотропий способен оказывать влияние практически на все важнейшие компоненты в процессе ремоделирования бронхов у больных БА (рис. 2) [29].Он уменьшает ремоделирование слизистой оболочки бронхов, включая ее утолщение, гипертрофию слизистых желез и гиперреактивность гладких мышц.
Рисунок 2. Влияние тиотропиума на процессы ремоделирования бронхов.
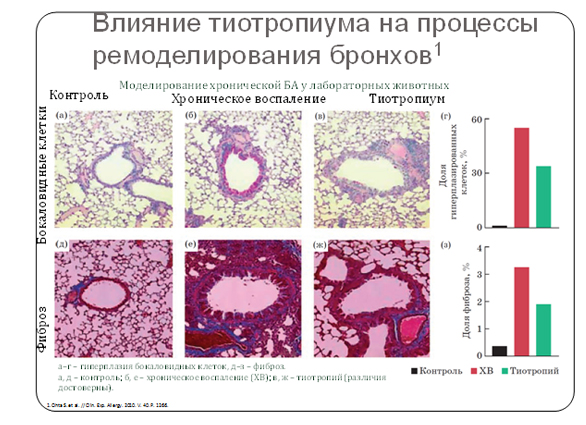
Таким образом, тиотропиум имеет противовоспалительную активность, которая может положительно влиять натечение хронических воспалительных заболеваний дыхательных путей. Также препарат подавляет воспаление, вызванное табачным дымом и опосредованное АЦХ, положительно влияет на свойства бронхиальной мокроты за счет ингибирования метаплазии бокаловидных клеток, уменьшения избыточного производства слизи как в исследованиях invivo, так и в опытах на животных. Под влиянием тиотропия усиливается очищение от слизи (мукоцилиарный клиренс) у пациентов с легкой и умеренной ХОБЛ.Препарат обладает противокашлевым действием (снижает чувствительность к капсаицину у пациентов с вирусной инфекцией).
Применение тиотропия для лечения больных бронхиальной астмой перспективно, т.к. (32):
- холинергическая активность – ключевая причина обратимой обструкции дыхательных путей при БА;
- у больных БА, по-видимому, в результате возрастания холинергической активности, исходно повышен тонус гладких мышц дыхательных путей;
- холинергическая активность, вероятно, играет важнейшую роль в ремоделировании гладких мышц дыхательных путей;
- лечение антихолинергическими препаратами снижает базальный тонус гладких мышц дыхательных путей;
- холинергические рецепторы в подслизистых клетках легких регулируют секрецию слизи;
- антагонисты холинорецепторов, возможно, оказывают противовоспалительное действие;
- в настоящее время является единственным бронхолитическим препаратом с 24-часовым действием с уровнем доказательности А.
БА на 21%(р< 0,03), а среднее время до первого обостренияв группе тиотропия (282 дня) оказалось существенно больше, чем в группе плацебо (226 дней).
Таким образом, у больных с неконтролируемой БА назначение тиотропия позволяет значимо улучшить показатели спирометрии, увеличить долю бессимптомных дней и почти на ¼ сократить число обострений. В исследовании M. Yoshidaetal. тиотропий был особенно эффективен при сочетании БА с эмфиземой легких и хроническим бронхитом [34]. Это важное наблюдение, так как известно, что у больных с эмфиземой ответ на комбинированные препараты снижается [35].
Результаты процитированных исследований позволили зарегистрировать новое показание для назначения тиотропия: в качестве дополнительной поддерживающей терапии у пациентов с БА, симптомы которой сохраняются на фоне терапии ИГКС (в том числе в комбинации с ДДБА). Для пациентов, получающих комбинированную терапию ИГКС + ДДБА, особенно важно отметить тот факт, что добавление тиотропия к терапии неконтролируемой БА более эффективно, чем удвоение дозы ИГКС. Также тиотропиум рекомендован пациентам с БА для уменьшения симптомов, улучшения качества жизни и снижения частоты обострений.
Литература.
- Rabe K.F. etal. // Eur. Respir. J. 2000. V. 16. P. 802.
- Partridge M.R. etal. // BMC Pulm. Med. 2006. V. 6. P. 13.
- Demoly P. etal. // Eur. Respir. Rev. 2012. V. 21. № 123.P. 66.
- Архипов В.В. и др. // Пульмонология. 2011. № 6. С. 87.
- Milgrom H. etal. // J. AllergyClin. Immunol. 1996. V. 98.P. 1051.
- Rootmensen G.N. etal. // J. AerosolMed. Pulm. Drug Deliv.2010. V. 23. № 5. P. 323.
- Humbert M. etal. // Allergy. 2007. V. 62. № 2. P. 95.
- Israel E. etal. // Lancet. 2004. V. 364. P. 1505.
- Adams K.S., Lowe D.K. // Ann. Pharmacother. 2013. V. 47.№ 1. P. 117.
- Disse B., Speck G.A., Rominger K.L. et al. Tiotropium (Spiriva) mechanistical considerations and clinical profile in obstructive lung disease. Life Sci 1999; 64: 457–464.
- Barnes P.J. The pharmacological properties of tiotropium. Chest 2000; 117 (2 Suppl.): 63–68.
- Disse B., Reichi R., Speck G. et al. A novel long–acting anticholinergic bronchodilator. Life Sci 1993; 52: 537–544.
- Haddad E.B., Mak J.C., Barnes P.J. et al. Characterization of [3H]Ba 679 BR, a slowly dissociating muscarinic antagonist, in human lung: Radioligand binding and autoradiographicmaping. MolPharmacol 1994; 45: 899–907.
- Nisar M., Earis J.E., Pearson M.G. et al. Acute bronchodilator trials in chronic obstructive pulmonary disease. AmRevRespirDis 1992; 146: 555–559.
- Shelley R. etal. // Ann. Intern. Med. 2004. V. 140. P. 802.
- Donohue J.F. etal. // Chest. 2002. V. 122. P. 47.
- Giannini В. etal. // Chest. 2001. V. 119. P. 1671.
- Chalmers G.W. etal. // Thorax. 2002. V. 57. P. 226.
- Wenzel S.E. // Nat. Med. 2012. V. 18. P. 716.
- Taylor D.R. etal. // Thorax. 2000. V. 55. P. 762
- // Am. J. Respir. Crit. CareMed. 2006. V. 173.P. 519.
- Casaburi R., Serby W., Menjoge S.S. etal. Thespirometricefficacyofoncedailydosingwithtiotropiuminstable COPD. Am J RespirCritCareMed 1999; 159: A524 (Abst.).
- Donohue J.F., vanNoord J.A., Babeman E.D. etal. A 6–month, placebo–controlled comparinglungfunctionandhealthstatuschangesin COPD patientstreatedwithtiotropiumorsalmeterol. Chest 2002; 122: 47–55.
- Tashkin D., Kesten S. Long–termtreatmentbenefitswithtiotropiumin COPD patientswithandwithout short–termbronchodilatorresponses. Chest 2003;123: 1441–1449.
- Busasco V., Hodder R., Miravitlles M. etal. Healthoutcomesfollowingtreatmentforsixmonthswithoncedailytiotropiumcomparedwithtwicedailysalmeterolinpatientswith COPD. Thorax, 2003; 58: 399–404.
- Globalstrategyforthediagnosis, management, andpreventionofchronicobstructivepulmonarydisease. Executivesummary. Updated 2003 (www.goldcopd.com)
- Anzueto A., Menjoge S.S., Kesten S. Changesin FEV1 overtimein 1–year clinicaltrialsoftiotropiumin COPD. ProceedingsoftheAnnualMeetingoftheAmericanThoracicSociety (ATS), SanFrancisco, USA, 21–25 May 2001.
- В.В.Архипов Новые перспективы в повышении контроля над бронхиальной астмой. От науки к практике. Практческаяпульмонологияю 2014, 1: 67 – 72.
- Ohta S. et al. // Clin. Exp. 2010. V. 40. P. 1266.
- Kerstjens H. et al. // N. Engl. J. Med. 2012. 367. P. 1198.
- Peters S.P. et al. // N. Engl. J. Med. 2010. 363. P. 1715.
- PrPrice D., Fromer L., Kaplan A., van der Molen T., Román-Rodríguez M. Is there a rationale and role for long-acting anticholinergic bronchodilators in asthma? NPJ Primary Care Respiratory Medicine 2014; 24: 14023.esentation Title
- Kerstjens H. etal. // N. Engl. J. Med. 2012. V. 367. P. 1198.
- Yoshida M. etal. // Pulm. Pharmacol. Ther. 2013. V. 26. № 2.P. 159.
- Lee J.-H. etal. // Respir. Med. 2010. V. 104. P. 542.







