Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "СИМПТОМЫ НИЖНИХ МОЧЕВЫХ ПУТЕЙ У МУЖЧИН"
Автор: Гаджиева З.К.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Урология
Просмотров: 6 384
Дата проведения: с 27.05.2015 по 27.05.2016
Введение
 Любые формы нарушений мочеиспускания резко снижают качество жизни, создают психологические проблемы, что может привести к разрушению семейных, рабочих связей, к социальной изоляции. Эта проблема является весьма важной и одной из наиболее трудных в диагностике. Психологически эта проблема часто сопровождается депрессивными расстройствами.
Любые формы нарушений мочеиспускания резко снижают качество жизни, создают психологические проблемы, что может привести к разрушению семейных, рабочих связей, к социальной изоляции. Эта проблема является весьма важной и одной из наиболее трудных в диагностике. Психологически эта проблема часто сопровождается депрессивными расстройствами.
Наличие нарушений функции нижних мочевых путей предрасполагает к появлению у пациентов других проблем со здоровьем, вносит свой вклад в развитие депрессии и социальную изоляцию, служит причиной существенного сокращения активности пациента.
Особое значение расстройства мочеиспускания приобретают у пациентов старших возрастных групп. Патогенез дисфункций мочевого пузыря сложен, так как они затрагивают не только мочевой пузырь, но и многие другие органы и системы, в первую очередь почки.
Особенности физиологии
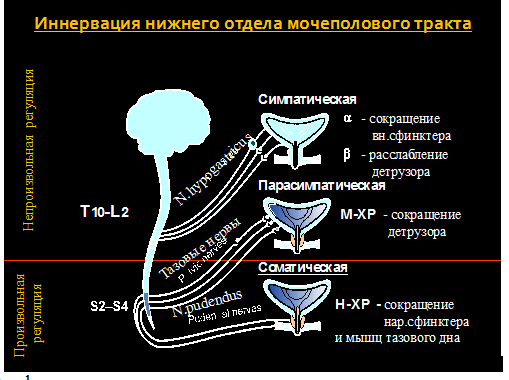
Мочеиспускание является сложным, рефлекторным актом, который обеспечивается синхронным сокращением детрузора и расслаблением сфинктеров мочевого пузыря. Согласно классической физиологической концепции, функция мочевого пузыря обеспечивается антагонистическим взаимодействием симпатического и парасимпатического отделов нервной системы. Симпатический отдел ответствен за расслабление детрузора и сокращение внутреннего уретрального сфинктера, парасимпатический – за сокращение детрузора и расслабление наружного сфинктера. Иными словами, симпатический отдел нервной системы составляет систему удержания мочи, а парасимпатический отдел – систему опорожнения. Активация той или иной системы определяет состояние нижних мочевых путей. В физиологических условиях доминирует система удержания мочи, преимущественно регулируемая симпатическим отделом нервной системы. Нормальное мочеиспускание возможно только при условии анатомической и функциональной сохранности мочевого пузыря и его сфинктеров, а также нервных структур, регулирующих акт мочеиспускания.
 При растяжении стенки мочевого пузыря в фазу его наполнения афферентные импульсы от рецепторов, расположенных в его стенке, по тазовому нерву поступают в крестцовый отдел спинного мозга. Далее они направляются в центры мочеиспускания, расположенные в области моста и коры головного мозга. Из корковых структур головного мозга эфферентные импульсы поступают в спинной мозг и далее по ветви срамного нерва передаются на мышцы наружного сфинктера уретры и тазового дна, вызывая их сокращение. При этом афферентные импульсы от рецепторов, расположенных в стенке мочевого пузыря, по подчревному нерву достигают симпатических центров, расположенных в спинном мозге на уровне Т12-L2 сегментов. Эти афферентные импульсы, в свою очередь, обусловливают возникновение эфферентных импульсов, распространяющихся по подчревному нерву, что сопровождается увеличением давления в области шейки мочевого пузыря. С подчревного нерва эфферентные импульсы передаются на тазовый нерв и вызывают подавление постганглионарного проведения нервных импульсов по парасимпатическим волокнам, что проявляется расслаблением детрузора.
При растяжении стенки мочевого пузыря в фазу его наполнения афферентные импульсы от рецепторов, расположенных в его стенке, по тазовому нерву поступают в крестцовый отдел спинного мозга. Далее они направляются в центры мочеиспускания, расположенные в области моста и коры головного мозга. Из корковых структур головного мозга эфферентные импульсы поступают в спинной мозг и далее по ветви срамного нерва передаются на мышцы наружного сфинктера уретры и тазового дна, вызывая их сокращение. При этом афферентные импульсы от рецепторов, расположенных в стенке мочевого пузыря, по подчревному нерву достигают симпатических центров, расположенных в спинном мозге на уровне Т12-L2 сегментов. Эти афферентные импульсы, в свою очередь, обусловливают возникновение эфферентных импульсов, распространяющихся по подчревному нерву, что сопровождается увеличением давления в области шейки мочевого пузыря. С подчревного нерва эфферентные импульсы передаются на тазовый нерв и вызывают подавление постганглионарного проведения нервных импульсов по парасимпатическим волокнам, что проявляется расслаблением детрузора.
Периферическая иннервация нижних мочевых путей осуществляется вегетативным (симпатическим и парасимпатическим) и соматическим отделами нервной системы. Мочевой пузырь получает двойную иннервацию. Рецепторы в области окончаний симпатических нервов мочевого пузыря и мочеиспускательного канала в зависимости от физиологических эффектов, возникающих при их стимуляции, разделяются на альфа- и бета-адренорецепторы. Адренергические ингибиторные нейроны в основном отходят от n. hypogastricus, в то время как возбуждающие нервы, как полагают, отходят от тазового нерва и относятся к холинергическому типу.
Альфа-адренорецепторы сконцентрированы в основании мочевого пузыря, его шейке и проксимальной части мочеиспускательного канала. Бета-адренорецепторы расположены в основном в области тела и дна мочевого пузыря. Стимуляция этого типа рецепторов вызывает торможение активности детрузора и его физиологическую адаптацию к поступающему объему мочи. Стимуляция альфа-адренорецепторов приводит к сокращению гладкомышечных волокон указанных отделов мочевых путей и увеличению уретрального сопротивления.
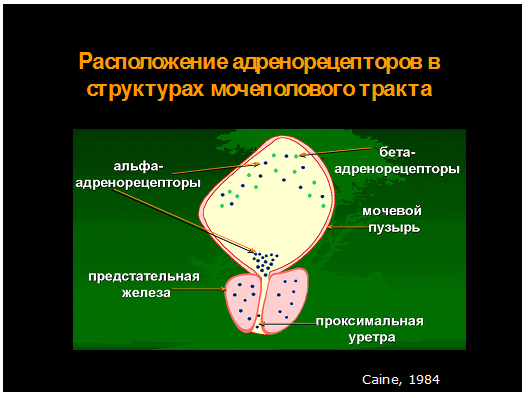
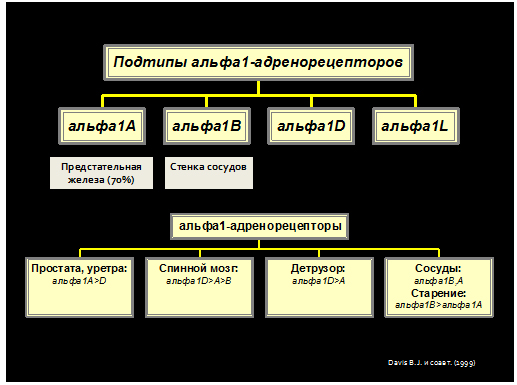
В свете новых данных альфа-адренорецепторы подразделяются на несколько подтипов. Считается, что симпатическая иннервация помогает поддерживать в покое тонус уретры главным образом через альфа-1-адренорецепторы. Альфа-1-адренорецепторы представлены альфа1А, альфа1В, альфа1D и альфа1L подтипами. По результатам некоторых работ в женской уретре указанные подтипы альфа-адренорецепторов (А:В:D) встречаются в проксимальной части уретры в следующих соотношениях – 90:0:10. По результатам же работы других авторов, альфа1 D рецепторов в детрузоре больше, чем альфа1А.
Рецепторы системы парасимпатических (холинэргических) нервов равномерно расположены в мышечной стенке мочевого пузыря и почти не встречаются в области его основания и уретры. Стимуляция этих рецепторов вызывает сокращение детрузора. В фазу наполнения (симпатическая фаза) норадреналин стимулирует бета-адренорецепторы и тем самым вызывает дилатацию детрузора и сокращение замыкательного аппарата шейки мочевого пузыря. В фазу опорожнения (парасимпатическая фаза) под влиянием ацетилхолиновой стимуляции холинэргических рецепторов и в связи с торможением симпатической иннервации происходит сокращение детрузора и расслабление замыкательного аппарата.
В настоящее время известно пять молекулярных подтипов мускариновых М-холинорецепторов, и ткани могут содержать разное количество разных подтипов. Например, гладкая мускулатура мочевого пузыря человека содержит смешанные популяции М2 и М3 подтипов.

Согласно современным представлениям в нижнем мочевом тракте обнаружено много рецепторов для различных трансмиттеров, включающих такие как оксид азота и субстанция Р. Различные ко-трансмиттеры и нейромодуляторы имеют стимулирующий эффект на гладкую мускулатуру мочевого пузыря, такие как АТФ, субстанция Р, GABA, NPY и другие. Возможное наличие различных нейротрансмиттеров и модуляторов в нижнем мочевом тракте много дискутировалось в течение последних двадцати лет.
В гладкой мускулатуре мочевого пузыря и спонтанная, и провоцированная сократительная активность связаны с деполяризацией мембран и проникновением кальция в гладкомышечные клетки через кальциевые каналы L-типа. Подавление выхода Са может ингибировать спонтанные и провоцированные сокращения мочевого пузыря.
Любой тип дисфункции мочеиспускания определяется аномальными изменениями одного или более факторов, обеспечивающих нормальное осуществление мочеиспускания в обеих фазах цикла. За исключением анатомической обструкции, нарушения, связанные с каким-либо из указанных факторов, могут иметь нейрогенное или ненейрогенное происхождение.
Абсолютная или относительная неспособность к опорожнению мочевого пузыря может быть результатом снижения его контрактильности и/или увеличения сопротивления току мочи вследствие инфравезикальной обструкции. Абсолютная или относительная неспособность к адекватному сокращению мочевого пузыря может быть также следствием временного или постоянного изменения любого из нейромышечных механизмов, обеспечивающих начало и поддержание его нормального сокращения. Истинная арефлексия детрузора часто имеет неврогенную природу, однако задержка рефлекса мочеиспускания у неврологически здоровых мышц может возникать за счет рефлекторного механизма, вторичного по отношению к болевым стимулам, особенно в тазовой и промежностной областях.
Особенности терминологии
Эффективный объем мочевого пузыря – количество мочи в мл, выделенное за одно мочеиспускание.
Остаточная моча – моча, остающаяся в мочевом пузыре после мочеиспускания.
Поллакиурия – один из наиболее часто встречающихся симптомов расстройств акта мочеиспускания, который предусматривает учащение мочеиспускания (более 8 раз в сутки), уменьшение одномоментно выделенной мочи. Поллакиурия подразделяется на истинную и ложную. Помимо перечисленных признаков истинная поллакиурия характеризуется еще и полным (без остаточной мочи) опорожнением мочевого пузыря. Степень ее выраженности может варьировать от незначительной, когда данное патологическое состояние диагностируется только по результатам регистрации ритма мочеиспусканий, до предельно максимальной. Для объективной оценки режима мочеиспускания в дневнике мочеиспусканий пациент в течение нескольких дней записывает время возникновения позывов на мочеиспускание, закончившихся или нет актом мочеиспускания, характер данных позывов (обычный или неотложный), количество выделенной мочи при каждом мочеиспускании, наличие эпизодов утечки мочи с указанием характера обстоятельств, при которых эта утечка произошла, количество потребляемой жидкости. Данные дневников позволяют оценить ритм мочеиспусканий и предположить у конкретного пациента симптоматику гиперактивного мочевого пузыря. Помимо сведений о режиме мочеиспусканий пациенты указывают количество позывов, не приведших к мочеиспусканию по каким-либо причинам.
1. При обращении больного с ведущей жалобой на учащенное мочеиспускание следует всегда дифференцировать истинную поллакиурию от ложной, при которой два остальных признака истинной поллакиурии (уменьшение эффективного объема и полное опорожнение мочевого пузыря) отсутствуют. Ложная поллакиурия наблюдается при: избыточной продукции мочи и (по крайней мере изначально) нормальном функциональном состоянии мочевого пузыря;
2. при большом количестве остаточной мочи.
Полиурия может быть вызвана приемом большого количества жидкости, мочегонными препаратами, быть следствием сахарного или несахарного диабета, хронической почечной недостаточности и пр. Поллакиурия при большом количестве остаточной мочи является следствием тяжелой эвакуаторной недостаточности (декомпенсация) мочевого пузыря различного генеза, проявляющейся его неполным опорожнением.
Ночная поллакиурия (ноктурия) – прерывание сна несколько раз за ночь для опорожнения мочевого пузыря при обычном для пациента питьевом режиме. Известно, что у взрослых число мочеиспусканий в среднем 4–6 за время бодрствования, эффективный объем каждого из них колеблется от 100 до 400 мл (в среднем 200–300 мл).
При редких мочеиспусканиях их число за сутки существенно меньше нижней границы возрастной нормы (меньше 5 раз). Этот симптом сопровождает многие заболевания пузырного и внепузырного происхождения.
Встречаются случаи, когда редкие мочеиспускания обусловлены олигурией – уменьшением суточного количества мочи на 20–30% от выпитого или никтурией – большим выделением мочи во вторую половину суток – с 18 вечера до 6 утра. Поэтому при редких мочеиспусканиях следует обращать внимание на диурез.
В клинической практике чувствительную иннервацию мочевого пузыря оценивают по позыву – ощущению его наполнения. В норме позыв возникает в ответ на растяжение детрузора мочой, постепенно усиливается и на определенное время может быть подавлен волевым усилием. Об ослаблении позыва говорят тогда, когда от момента его появления до опорожнения мочевого пузыря проходит длительный (свыше 1–3 час.) период времени, в течение которого происходит существенное переполнение и перерастяжение мочевого пузыря. О полном отсутствии позыва на мочеиспускание говорят тогда, когда пациент не испытывает никаких ощущений при максимальном наполнении и даже переполнении мочевого пузыря.
Императивный (ургентный) позыв – периодически возникающее непреодолимое внезапное желание опорожнить мочевой пузырь с резким уменьшением промежутка времени от появления позыва до обязательного, иногда неконтролируемого, опорожнения мочевого пузыря.
Под недержанием мочи понимают состояние, характеризующееся выделением (истечением) мочи, которое может быть продемонстрировано и представляет социально-гигиеническую проблему.
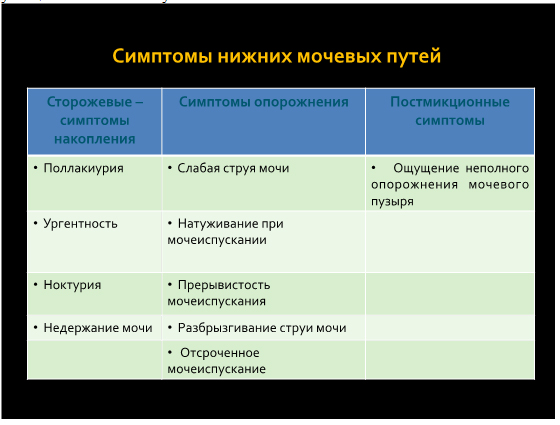
Еще одним проявлением расстройств мочеиспускания является затрудненное мочеиспускание, которое характеризуется снижением скорости выделения мочи и увеличением длительности акта мочеиспускания. Нарушение опорожнения мочевого пузыря может проявляться слабой струей потока мочи, разбрызгиванием или расщеплением струи мочи, прерывистой струей, необходимостью натуживаться при мочеиспускании, терминальным подкапыванием (дриблингом), ощущением неполного опорожнения мочевого пузыря, дриблингом после мочеиспускания.
Еще одними из частых симптомов расстройств мочеиспускания являются так называемые болевые симптомы. Варианты ощущений включают боль, дискомфорт и ощущение давления. Боль является основным симптомом и может возникать во время наполнения и опорожнения мочевого пузыря, ощущаться после мочеиспускания и быть постоянной. Термины “странгурия”, “спазм мочевого пузыря” и “дизурия” имеют неопределенное значение, которое трудно уточнить, поэтому их не следует применять в отношении нарушения функции нижних мочевых путей без специального пояснения. Дословно “дизурия” означает нарушение мочеиспускания, и в некоторых европейских странах корректно используется, однако часто его применяют для обозначения чувства жжения в результате инфекции мочевых путей. Характеристика боли должна включать тип, частоту возникновения, продолжительность, факторы, способствующие возникновению и облегчению боли, и ее локализацию, как определено ниже:
Болевой синдром мочевого пузыря – жалоба на боль в надлобковой области, связанной с наполнением мочевого пузыря, которая сопровождается другими симптомами, такими как учащенное мочеиспускание в дневное и ночное время при доказанном отсутствии инфекции или других очевидных причин этому.
Уретральный болевой синдром – состояние, характеризующееся повторяющейся эпизодической болью в уретре, обычно во время мочеиспускания, сопровождающейся учащенным дневным мочеиспусканием и ноктурией при доказанном отсутствии инфекции или других очевидных причин этому.
Синдром тазовой боли – состояние, сопровождающееся постоянной или повторяющейся эпизодической болью в области таза в сочетании с симптомами нарушения функции нижних мочевых путей, кишечника, гинекологической сферы или сексуальной функции. При этом доказано отсутствие инфекции или других очевидных причин этому.
Ургентность – жалоба на внезапный непреодолимый позыв на мочеиспускание, который трудно сдержать.
Гиперактивная функция детрузора (overactive detrusor function) – характеризуется непроизвольными сокращениями детрузора во время фазы наполнения мочевого пузыря, которые могут быть как спонтанными, так и спровоцированными (при быстром наполнении, изменении положения тела, кашле, ходьбе, прыжках и пр.), в то время как пациент пытается подавить эти сокращения.
Гиперактивность детрузора – состояние, при котором происходит непроизвольное или стимулированное сокращение детрузора в фазе наполнения мочевого пузыря, при котором пациент старается предотвратить подтекание мочи. Состояние диагностируется только при проведении уродинамического исследования и характеризуется внезапными колебаниями детрузорного давления более чем на 15 см вод. ст.
Нейрогенная гиперактивность детрузора – избыточная активность детрузора, связанная с неврологическими нарушениям: травмой спинного мозга, патологией позвоночника, болезнью Паркинсона, Альцгеймера, рассеянным склерозом. Термин правомочен лишь в тех случаях, когда доказана неврологическая патология в сочетании с гиперактивностью детрузора, подтвержденная уродинамическим исследованием. Было предложено заменить термин “гиперактивность детрузора” (ГД) на термин “гиперактивность мочевого пузыря” (ГМП)/. В настоящее время это предложение активно обсуждается. Возможно будет принято решение об использовании термина “гиперактивность мочевого пузыря” (overactive bladder) в тех случаях, когда диагноз ставят на основании симптомов заболевания, и использовать термин “гиперактивность детрузора” в тех случаях, когда диагноз ставят на основании данных уродинамического исследования.
Одно из последних определений ГМП, одобренное ICS, отличается от приведенного выше (Abrams P., Cardozo L., 2002): гиперактивный мочевой пузырь – симптомокомплекс, характеризующийся ургентными позывами с ургентным недержанием мочи или без него, наличием учащенного мочеиспускания.
Гиперактивный мочевой пузырь (ГМП) , обусловленное им императивное (ургентное) недержание мочи и стрессовое недержание мочи являются наиболее распространенными расстройствами мочеиспускания. Так как природа этих заболеваний различна, для успешной терапии необходимо провести дифференциальную диагностику, которая в большинстве случаев, основывается на результатах комплексного обследования.
Эпидемиология.
Гиперактивный мочевой пузырь – тяжелое расстройство мочеиспускания, которым страдают не менее 17% населения старше 40 лет, из них 56% женщины и 44% мужчины (Balmer P., Abrams P., 2000). Существуют различия, обусловленные полом, возрастом, этнической принадлежностью. Как правило, распространенность ГМП недооценивается, так как подавляющее большинство исследований включает пациентов только с одним из симптомов императивного недержания мочи (Abrams P., Wein A., 2000).
С возрастом частота симптомов возрастает до 30% у лиц старше 65 лет и до 40% – после 70 лет. В европейских странах почти 22 миллиона человек страдают этим тяжелым заболеванием, но лишь 27% из них получают лечение, что свидетельствует о недостаточной оценке проблемы как пациентами, так и медицинскими работниками (Milsom I., Abrams P., Cardozo L., 2001). По данным Wein A.J. (2003), гиперактивный мочевой пузырь встречается у 52–80% мужчин с инфравезикальной обструкцией вследствие гиперплазии простаты, а у 38% мужчин он продолжает иметь место и после хирургического устранения обструкции. Распространенность учащенного мочеиспускания и ургентных позывов одинакова среди мужчин и женщин, а ургентное недержание мочи чаще встречается у женщин старших возрастных групп.
Патогенез.
Этиология и патогенез ургентных расстройств мочеиспускания, обусловленных гиперактивностью мочевого пузыря, до настоящего времени не ясны. Существует несколько теорий развития данного заболевания.
Нервная дегенерация является общим признаком развития ГМП. Возможно детрузорная гиперактивность обусловлена возрастными изменениями не только в мочевых путях, но и в центральной нервной системе.
При гипертрофии детрузора, возникшей в результате обструкции, увеличиваются метаболические потребности в сочетании с уменьшением притока крови, что приводит к аноксии и гибели нейронов (Levin R.H. et al., 1999). Более того, имеются данные о том, что плотность холинергических нервных волокон в детрузоре на 60% меньше в группе больных с ДГПЖ и ИВО по сравнению с группой больных того же возраста и отсутствием ИВО Авторы считают, что значительное снижение плотности нервных волокон в ответ на ИВО вследствие ДГПЖ может привести к нарушению нейромышечного контроля мочевого пузыря.
Физиологическое старение организма ассоциируется с ухудшением кровоснабжения. Это позволяет предположить, что гипоксия может лежать в основе повреждения интрамуральных нейронов и приводить к изменению функции гладкой мускулатуры мочевого пузыря у пациентов с гиперактивностью детрузора. Ишемия обусловливает апоптоз гладкомышечных клеток и, кроме того, нарушение нервной проводимости. Нервная ткань более чувствительна к ишемии, чем гладкая мускулатура, и некоторые из этих повреждений практически необратимы. P. Abrams (1985) считает, что гиперактивность детрузора у больных с ДГПЖ является не результатом ИВО, а следствием возрастных изменений в стенке мочевого пузыря.
Несмотря на противоречивость данных, следует признать, что как возраст, так и ИВО могут привести к постсинаптической денервации мочевого пузыря. Это обстоятельство еще раз подчеркивает важную роль нервной системы в контроле за накопительной функцией мочевого пузыря.
Роль наследственных факторов изучается, а ряд современных исследований свидетельствует о возможности генетических изменений при наличии ГАМП (Foldspang A., Homsen S., 1994; Hushkat Y, Bukovsky I., 1996; Eiberg H., Shaumburg H.L., 2001).
Клиническая картина. Методы обследования пациентов с симптомами ГМП.
Для клинического проявления гиперактивности детрузора характерны безотлагательные (ургентные, императивные) позывы на мочеиспускание, поллакиурия, ноктурия и неудержание мочи при позыве (или ургентное недержание мочи). Возникая в любой период времени и зачастую в неудобном месте, указанные симптомы приносят значительное беспокойство больным.
Комплексное обследование больных с подозрением на гиперактивный мочевой пузырь включает:
– беседу с больным
Ключевые вопросы:
1. Сколько раз в течение суток Вы мочитесь?
2. Сколько раз Вы мочитесь в течение дня?
3. Сколько раз Вы просыпаетесь в течение ночи, чтобы помочиться?
4. Как часто Вы испытываете внезапные и резкие позывы к мочеиспусканию?
5. Если Вам не удается вовремя добраться до туалета, сколько мочи Вы теряете?
6. Бывает ли у Вас недержание мочи, когда Вы смеетесь, кашляете, чихаете, бегаете или прыгаете?
– осмотр;
– оценку клинических симптомов заболевания;
– анализы мочи и крови;
– УЗИ почек, мочевого пузыря с определением остаточной мочи;
– при необходимости цистоскопию;
– урофлоуметрию;
– при необходимости и возможности – комбинированное уродинамическое исследование.
Клинические проявления ГМП
– дневная поллакиурия (более 6 раз в дневное время);
– ночная поллакиурия (более 1–2 раз за ночь);
– ургентные (императивные, неотложные, безотлагательные) позывы на мочеиспускание (urgency);
– ургентное (императивное, неотложное) недержание мочи, неудержание мочи (urge incontinence).

Ургентное недержание мочи (неудержание мочи) – потеря мочи, сопровождающаяся сильным (императивным) позывом к мочеиспусканию. Неудержание мочи не является обязательным условием для постановки диагноза ГМП, так как у половины пациентов отмечаются только “сенсорные” симптомы: частые дневные и ночные мочеиспускания, императивные позывы. Этот вариант симптомокомплекса получил название “сухого” гиперактивного мочевого пузыря. В случае присоединения императивного недержания мочи принято говорить о “влажном” или “мокром” гиперактивном мочевом пузыре (Wandaelle J.O.,2001, Abrams P., Cardozo L., 2002, Steers W.D.,2002).

Необходимым является ведение дневников мочеиспусканий в течение 3-х суток, в которых пациент записывает время пробуждения и отхода ко сну, время и объем каждого мочеиспускания, наличие ургентных позывов и эпизодов недержания мочи с указанием спровоцировавшего его фактора, количество потребляемой жидкости в течение каждых суток.
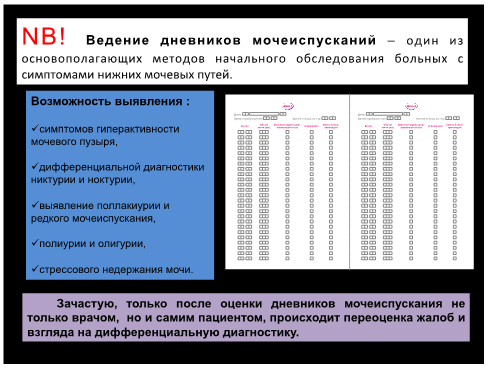
Для определения степени ургентности и контроля в дальнейшем назначенной терапии пациенту предлагается оценка по шкале восприятия ургентности:
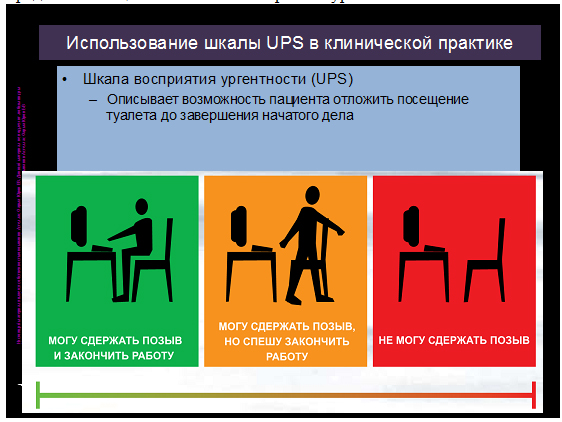
Необходимо отметить, что до настоящего времни не существует определенных лабораторных показателей, указывающих на гиперактивность детрузора. Однако двукратное исследование осадка мочи является обязательным условием обследования больных с подозрением на гиперактивность детрузора. В отношении таких больных анализ осадка мочи является не диагностическим, а скрининг-тестом, который позволяет определить группу пациентов, у которых учащенное, ургентное мочеиспускание является следствием воспалительных заболеваний нижних мочевых путей. Как правило, анализы мочи у пациентов, страдающих истинной гиперактивностью мочевого пузыря, без патологических изменений.
Важное значение в лабораторном обследовании больных с учащенным и ургентным мочеиспусканием имеет исследование уровня глюкозы в крови. Повышение уровня глюкозы свидетельствует о сахарном диабете, который, сопровождаясь полиурией, приводит к учащенному дневному и ночному мочеиспусканию. Однако сахарный диабет, приводящий к нарушению трофики и развитию полинейропатии, создает предпосылки к развитию гиперактивности детрузора.
Необходимо назначить дополнительные обследования, если у пациента имеет место быть:
• гематурия при отсутствии инфекционных заболеваний по результатам анализов мочи;
• признаки затрудненного мочеиспускания без явных признаков инфравезикальной обструкции, в том числе у молодых пациентов (задержка начала мочеиспускания, ослабление струи мочи, наличие остаточной мочи);
• явные признаки неврологических расстройств или нарушение обмена веществ;
• нет положительной динамики после 2–3 месяцев лечения.
Необходимо подчеркнуть особое значение уродинамических исследований в диагностике нарушений функции нижних мочевых путей.
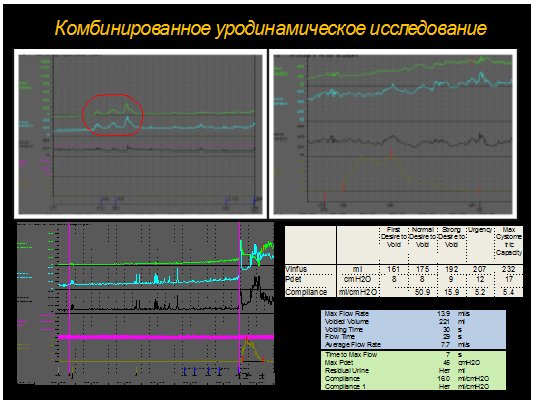
Цистоскопия является существенной частью обследования больных с признаками гиперактивности детрузора. Как уже указывалось ранее, она может быть полезной в диагностике ранее не подозревавшихся воспалительных, неопластических и пренеопластических поражений, а также в выявлении изменений мочевого пузыря, указывающих либо на неврологическое заболевание, либо на инфравезикальную обструкцию.
Методы лечения ГМП:
– медикаментозное лечение;
– немедикаментозное лечение:
• тренировка мышц тазового дна;
• упражнения для тазовых мышц с использованием метода БОС;
• электрическая стимуляция;
• хирургическое лечение.
1. Тренировка мочевого пузыря заключается в соблюдении больным заранее установленного и согласованного с врачом плана мочеиспусканий, т.е. пациент должен мочиться через определенные промежутки времени. Программа тренировки мочевого пузыря направлена на прогрессивное повышение интервала между мочеиспусканиями. Эффективность такого вида лечения в среднем от 12 до 90%.
2. Упражнения для тазовых мышц с применением метода биологической обратной связи (БОС). Основой для клинического использования упражнений для тазовых мышц у больных ГМП является наличие анально-детрузорного и уретрально-детрузорного рефлексов (рефлекторное торможение сократительной активности детрузора при произвольных сокращениях наружных анального и уретрального сфинктеров). Рекомендуется 30–50 сокращений в день длительностью от 1 до 15–20 секунд. Задачей метода БОС является приобретение умения сокращать специфические мышечные группы и обеспечение обратной связи с пациентом.
Недостатки поведенческой терапии
Существует мало данных о продолжительности положительной динамики, а также о том, как долго пациенты способны придерживаться условий лечения. Лечение по методу поведенческих реакций ограничивается тем, что оно зависит от активного участия в нем пациента, желающего лечиться, то есть ценность данного метода может быть ограничена среди лиц, имеющих психические дефекты, а также среди тех, кто имеет меньшую мотивацию к лечению.
3. Электрическая стимуляция:
• уретрального и анального сфинктеров;
• мышц тазового дна;
• волокон n.pudendus, n. tibialis;
• корешков сакрального отдела спинного мозга.
Стимуляция афферентных нервных волокон способствует увеличению емкости мочевого пузыря, так как снижает его чувствительность. Эффективность данной терапии в среднем 75–83%. Длительность лечения – не менее 3 месяцев. Побочные реакции (редко) – болевые ощущения и дискомфорт в области воздействия.
4. Хирургическое лечение (крайне редко):
• сближение сидалищно-пещеристых мышц;
• сакральная и пудендальная невротомия;
• разрушающие спиртовые блокады;
• цистолизис;
• длительное растяжение или охлаждение мочевого пузыря (эндовезикально);
• блокада крестцовых и половых нервов лидокаином;
• отведение мочи через надлобковый свищ или пиелостому;
• миэктомия;
• кишечная пластика.
Согласно общепринятым рекомендациям методом выбора является фармакотерапия, затем следует поведенческая терапия, физиотерапия и остальные виды лечения.
Фармакотерапия является одним из самых распространенных методов лечения ГМП. Медикаментозная терапия применяется в качестве первичного метода для всех пациентов с ГМП. Метод вызывает интерес прежде всего благодаря своей доступности, возможности длительного применения и индивидуального подбора дозы и режима терапии.
Преимущества медикаментозной терапии
Преимущество медикаментозной терапии заключается в том, что она не требует от пациента значительных усилий, таким образом, она привлекательна для многих пациентов. Фармакотерапия дает эффект быстро, причем не требует поведенческих навыков, занимает у врача меньше времени, а у пациента требует меньше степени участия.
Требования к препаратам для фармакологической коррекции: селективность действия на мочевой пузырь, хорошая переносимость, возможность длительной терапии, эффективное воздействие на основные симптомы.
Опыт последних 20 лет определил возможность применения нескольких групп препаратов, воздействующих на периферические мишени.
К медикаментозным препаратам для лечения ГМП относят :
– антихолинергические препараты (препараты первого выбора);
– бета-адреномиметики;
– аналоги вазопрессина;
– антидепрессанты;
– альфа-адреноблокаторы;
– ботулинический токсин А.
В настоящий момент наиболее часто в лечении ГМП применяются препараты, воздействующие на мускариновые рецепторы мочевого пузыря, которые являются препаратами первого выбора при данной патологии. Большинство из этих препаратов вызывают неизбежные нежелательные явления, что обусловливает необходимость поддержания клиницистом баланса между преимуществами и недостатками препаратов. Антимускариновое действие обычно вызывает сухость во рту, запоры, трудности аккомодации, сонливость. Препараты не должны назначаться пациентам с выраженно нарушенным оттоком мочи из мочевого пузыря (обструктивной уропатией), обструкцией кишечника, язвенным колитом, глаукомой или миастенией. На фоне приема этих препаратов у пациентов развивается замедленная реакция, и им надо проявлять осторожность при вождении автомобилей или при работе с опасными механизмами (Nilvebrant L., 2000).
Одним из самых известных антихолинергических препаратов является атропин, который имеет выраженное системное действие. И хотя некоторые пилотные исследования показали достоверную эффективность и безопасность его внутрипузырного применения при гиперрефлексии, самым распространенным методом введения сейчас является электрофорез (Ekstrom, 1992; Glickman, 1995). Отсутствие селективности действия препарата, вне всякого сомнения, становится негативным фактором, так как определяет низкую эффективность его терапевтических доз в отношении симптомов гиперактивности. Препарат в настоящий момент представляет больше исторический интерес и практически не применяется в лечении гиперактивности детрузора.
Ранее, так называемым “золотым стандартом” в лечении ГМП являлся оксибутинина хлорид , обладающий антимускариновым, антиспазматическим и местным анестезирующим действием, хотя не все из вышеперечисленных свойств наблюдаются при терапевтических дозах (Nilvebrant, 2000). Необходим индивидуальный подбор дозы, и пациентов предупреждают, что это займет определенный период времени, в течение которого необходимо посещать врача. Оптимальной считается доза, дающая нужный эффект при минимальных побочных эффектах. Дозы для приема внутрь составляют от 2,5 мг однократно до 5 мг четыре раза в день. Оптимальной считается доза, дающая нужный эффект при минимальных побочных эффектах. Стандартная стартовая доза для взрослых составляет 5 мг два или три раза в день. У пожилых рациональная стартовая доза составляет 2,5 мг два раза или три раза в день. Доза должна поддерживаться в течение 7 дней до корректировки – либо уменьшения, либо увеличения, в зависимости от выраженности клинического эффекта.
При использовании оксибутинина в обычной дозе 5 мг 3 раза в день побочные эффекты, обусловленные холинолитической активностью (сухость во рту, сонливость, тахикардия, торможение перистальтики), возникают более чем у половины больных и вынуждают их прекратить прием препарата. С целью уменьшения выраженности побочных эффектов дозу оксибутинина снижают до 2,5 мг 3 раза в день. Несмотря на достаточную эффективность, оксибутинин обладает рядом особенностей, заставляющих врачей отказываться от его применения. Это прежде всего отсутствие селективности в отношении мочевого пузыря, что обусловливает плохую переносимость, необходимость титрования дозы, а также наличие побочных эффектов со стороны центральной нервной системы и расстройства когнитивной функции.
Толтеродин – это первый препарат, целенаправленно разработанный для лечения пациентов с гиперактивностью мочевого пузыря, проявляющейся учащенными ургентными позывами на мочеиспускание, ургентным недержанием мочи. Это препарат, обладающий антимускариновым действием, оказывающий на мочевой пузырь такое же влияние, как и оксибутинин, но обладающий незначительным влиянием на мускариновые рецепторы слюнных желез. Рекомендуемая доза составляет 2 мг 2 раза в день (или 4 мг однократно при применении капсул пролонгированного действия), за исключением пациентов с нарушением функции печени и почек, для которых рекомендуемая доза составляет 1 мг 2 раза в день.
Еще один из препаратов, часто применяемых для лечения ГМП, – М-холиноблокатор солифенацин , специфический конкурентный ингибитор мускариновых рецепторов. Селективность солифенацина по отношению к мочевому пузырю значительно выше в сравнении с толтеродином и оксибутинином, что обусловливает возможность его длительного применения` при минимальном количестве побочных эффектов.
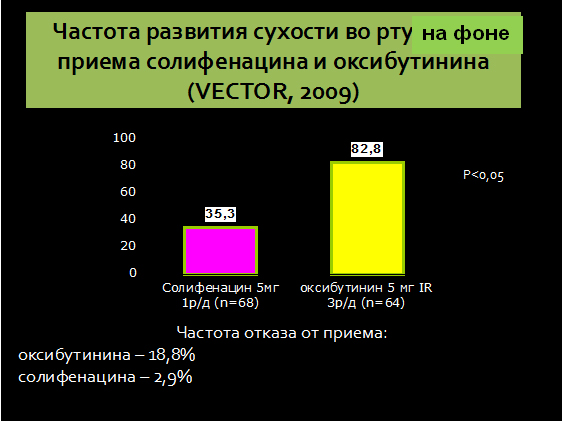
Эффективность препарата в дозах 5 и 10 мг была изучена и доказана в большом количестве клинических исследований у больных с синдромом ГМП: было отмечено статистически значимое снижение количества мочеиспусканий (включая ночные), эпизодов ургентности, увеличение среднего объема мочеиспусканий. Эффект проявляется уже в течение первой недели лечения, достигая максимальной величины через 4 нед. Эффективность препарата сохраняется при длительном применении (по меньшей мере, 12 мес). Высокая селективность в отношении мочевого пузыря в сочетании с удобством приема (1 раз/сут) и высокой безопасностью – важные свойства солифенацина, существенно повышающие приверженность к лечению со стороны пациентов. Также важным аспектом выбора М-холиноблокатора для данной категории больных служит его влияние на когнитивные функции. С учетом этого препаратами выбора можно считать солифенацин и троспия хлорид.
Более селективными в отношении мочевого пузыря являются солифенацин и толтеродин. Однако самой высокой селективностью обладает солифенцин [Ohtake A, Ukai M, Hatanka T, Kobayashi S, Ikeda K, Sato S, Miyata K, Sasamata M. In vitro and in vivo tissue selectivity profile of solifenacin succinate (YM905) for urinary bladder over salivary gland in rats. Eur J Pharmacol. 2004 May 25;492(2-3):243-50.].
Таблица. Селективность различных М-холиноблокаторов по отношению к мочевому пузырю [ Ohtake A. et al, 2004]
|
Препарат |
ID 30 (95% доверительный интервал) |
Селективность по отношению к мочевому пузырю |
|
|
повышение внутрипузырного давления |
секреция слюны |
||
|
Солифенацин |
0,023 (0,010–0,039) |
0,15 (0,1–0,24) |
6,5 |
|
Толтеродин |
0,010 (0,008–0,014) |
0,024 (0,016–0,047) |
2,4 |
|
Оксибутинин |
0,027 (0,015–0,045) |
0,030 (0,024–0,038) |
1,1 |
Хорошая переносимость солифенацина (везикара) является значимым фактором, определяющим выбор в его пользу у пациентов старшего возраста, страдающих ургентными (императивными) расстройствами мочеиспускания, так как больные данной возрастной группы, как правило, отягощены сопутствующими заболеваниями, что ограничивает прием препаратов с большим количеством побочных эффектов.
Антимускриновые препараты являются эффективными и хорошо переносимыми в лечении ГМП. Исследования показали, что гибкая стратегия дозирования может быть эффективной в улучшении симптомов ГМП с минимальным воздействием на переносимость. Так, в работе L. Cardozo и соавт. с использованием двух доз солифенацина (5 и 10 мг) установлено, что лучшие результаты могут быть достигнуты путем увеличения дозы солифенацина от 5 до 10 мг у пациентов с более тяжелыми симптомами.
Выполненные научные работы дают возможность сделать следующие выводы и определить стартовой дозировкой препарата – 10 мг/сут однократно:
- солифенацин 10 мг эффективно устраняет все симптомы ГМП [Chu F et al, 2009];
- солифенацин 5/10 мг снижает ургентность на 89% [Haab, F; Cardozo, L; Chapple,C; Ridder A.M. 2005];
- солифенацин 5/10 мг эффективнее толтеродина в снижении ургентности и ургентного недержания мочи [Chapple C.R., Martinez-Garcia R., Selvaggi L., Toozs-Hobson P., Warnack W., Drogendijk T., Wright D.M., Bolodeoku J. 2005];
- увеличение дозы солифенацина до 10 мг позволяет добиться лучших результатов в лечении больных ГМП [Linda Cardozo, Gerard Amarenco, Dmitry Pushkar, Jura Mikulas, Ted Drogendijk, Mark Wright, Gerhard Compion on behalf of the SUNRISE Study Group. 2013];
- прием 10 мг солифенацина сопровождается эффективностью, благоприятным профилем безопасности и переносимости [Linda Cardozo, Gerard Amarenco, Dmitry Pushkar, Jura Mikulas, Ted Drogendijk, Mark Wright, Gerhard Compion 2013];
- солифенацин 10 мг не оказывает значимого влияния на когнитивную функцию у пожилых пациентов в отличие от оксибутинина [Keith A., 2009];
- солифенацин 10 мг, благодаря оптимальному балансу эффективности и безопасности, обеспечивает большую по сравнению с другими М-холинолитиками приверженность к лечению [A.Wagg, G.Compion, A.Fahey, E.Siddiqui. 2012]
Еще один М-холиноблокатор, используемый в лечении ГМП, – троспия хлорид (. Это парасимпатолитик с периферическим, атропиноподобным действием, а также ганглионарным миотропным действием, подобным таковому у папаверина. Препарат является конкурентным антагонистом ацетилхолина на рецепторах постсинаптических мембран. При этом блокируется мускариновое действие ацетилхолина и ингибируется ответ, вызванный постганглионарной парасимпатической активацией блуждающего нерва. Троспия хлорид снижает тонус гладкой мускулатуры мочевого пузыря, оказывает расслабляющее действие на гладкую мускулатуру детрузора как за счет антихолинергического эффекта, так и вследствие прямого миотропного антиспастического влияния. Дозу подбирают (титруют) индивидуально: от 30 до 90 мг/сут. Концентрация троспия хлорида при однократном приеме от 20 до 60 мг пропорциональна принятой дозе.
• альфа-адреноблокаторы – снижают тонус внутреннего сфинктера, оказывают благотворное действие на функцию детрузора непосредственно и через сосудистый компонент, расширяя кровеносные сосуды и улучшая кровообращение в стенке мочевого пузыря.
Наиболее известными альфа-адреноблокаторами, применяющимися в урологической практике, являются тамсулозин, теразозин, доксазозин, альфузозин, силодозин .
Особенными характеристиками среди всех альфа-адреноблокаторов обладает тамсулозин (Омник, Омник Окас) – специфический блокатор альфа1-адренорецепторов, находящихся в гладкой мускулатуре предстательной железы, шейки мочевого пузыря и простатической части уретры. Существуют и другие точки приложения тамсулозина, которые пока еще остаются на гипотетическом уровне. Возможно, улучшение наполнения мочевого пузыря происходит в результате блокады альфа1D-адренорецепторов детрузора и/или спинного мозга, что приводит к уменьшению гиперактивности детрузора и, таким образом, улучшает функционирование мочевого пузыря в фазе наполнения. Кроме того, возможно, тамсулозин блокирует пресинаптические альфа1-адренорецепторы в холинеогических нервных окончаниях в мочевом пузыре и/или на уровне периферических ганглиев, что приводит к уменьшению высвобождения ацетилхолина в синаптическую щель и подавлению непроизвольных сокращений детрузора. Антагонист альфа1-адренорецепторов тамсулозин является высокоселективным препаратом, который действует преимущественно на альфа1А-адренорецепторы и в меньшей степени на альфа1D-адренорецепторы и практически не действиует на альфа1В-подтип рецепторов. Способность тамсулозина воздействовать на альфа1А-подтип адренорецепторов в 20 раз превосходит его способность взаимодействовать с альфа1В-подтипом адренорецепторов, которые расположены в гладких мышцах сосудов. Большинство других альфа1-адреноблокаторов, напротив, не являются селективными к подтипам. Очевидно, блокирующее действие на альфа1А-адренорецепторы предстательной железы и альфа1D-адренорецепторы мочевого пузыря (и/или иннервирующих его структур, по предварительным результатам исследований с матричной РНК, которые требуют дальнейшего подтверждения) способствуют уменьшению выраженности как симптомов наполнения, так и симптомов опорожнения. Существуют данные, что альфа1В-адренорецепторы, которые находятся в кровеносных сосудах, вызывают сокращение гладкомышечной ткани в них и участвуют в регуляции артериального давления, что особенно важно учитывать при лечении пациентов пожилого возраста. Поэтому подтип-неселективные альфа1-адреноблокаторы не только уменьшают выраженность симптомов нижних мочевых путей, но и блокируют альфа1В-адренорецепторы сосудов, что вызывает вазодилатацию и снижение артериального давления.

Именно поэтому терапию подтип-неселективными альфа-адреноблокаторами необходимо начинать с маленькой дозы, постепенно титруя ее до достижения полной терапевтической дозы, которая будет эффективна. Благодаря своей высокой селективности, тамсулозин не вызывает клинически значимого снижения системного артериального давления как у пациентов с артериальной гипертензией, так и у пациентов с нормальным исходным давлением.
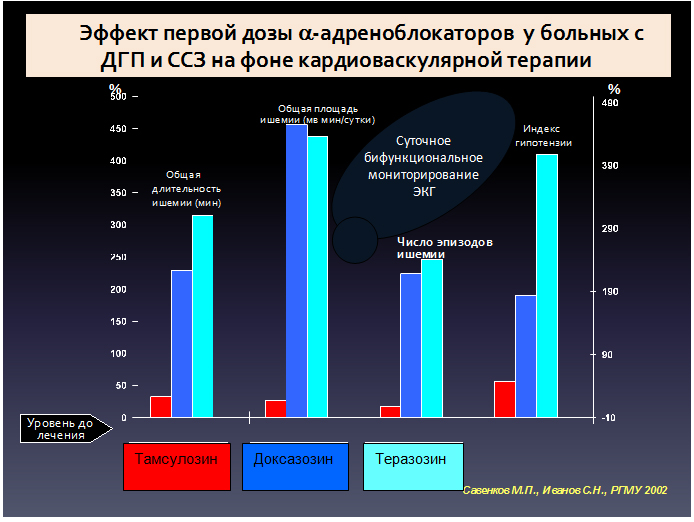
Таким образом, препарат обладает улучшенным профилем безопасности в отношении побочных эффектов со стороны сердечно-сосудистой системы. Учитывая указанную положительную особенность тамсулозина, в случае необходимости назначения альфа1-адреноблокатора этот препарат возможно назначать даже больным со склонностью к гипотонии. Тамсулозин почти полностью всасывается в кишечнике и обладает почти 100% биодоступностью. Дозировка данного препарата не требует титрования и индивидуального подбора, как для остальных альфа1-адреноблокаторов, и может быть полной терапевтической с самого начала лечения, составляя 0,4 мг (1 капсула) 1 раз в сутки после завтрака. Это позволяет обеспечить более быстрое начало действия и уменьшение выраженности симптомов по сравнению с неселективными альфа1-адреноблокаторами, дозу которых нужно постепенно увеличивать. Частота развития нарушения эякуляции при назначении антагонистов альфа1-адренорецепторов мала.
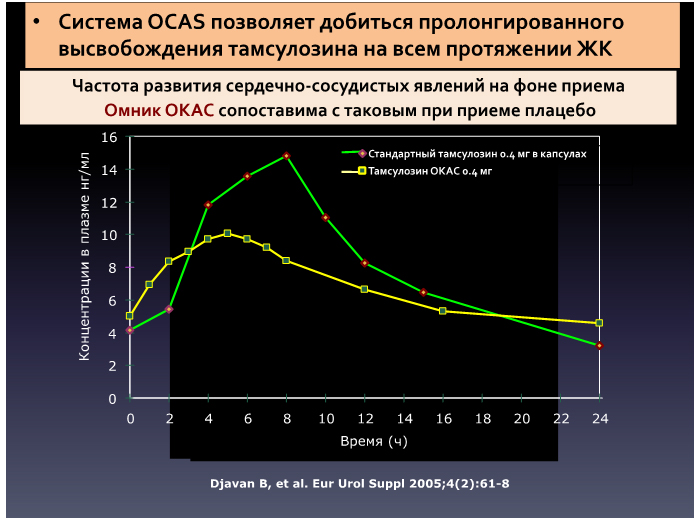
Разработанная форма тамсулозина Окас позволяет избежать пика выброса препарата и обеспечивает минимальное влияние на сердечно-сосудистую систему, сопоставимую с плацебо.
Несмотря на то что селективность силодозина по данным исследований превосходит селективность тамсулозина, разница в эффективности этих препаратов статистически не значима. Кроме того, более высокая селективность силодозина проявляется в частом побочном эффекте – ретроградной эякуляции.

– антидепрессанты
Амитриптилин тормозит обратный захват норадреналина, серотонина и дофамина. Помимо этого, он оказывает центральное и периферическое антихолинергическое действие и обладает тормозящим эффектом на центральную нервную систему, что выражается в седативных свойствах. До появления антихолинергических препаратов амитриптилин достаточно широко использовали при лечении гиперактивности детрузора. Трициклические антидепрессанты способствуют повышению емкости мочевого пузыря, снижению сократительной способности детрузора и повышению уретрального сопротивления. Применение трициклических антидепрессантов показало высокую эффективность при лечении энуреза как у детей, так и у взрослых. Однако побочные эффекты, такие как слабость, тремор, ортстатическая гипотензия, аритмия, замедление или исчезновение оргазма, осложняют назначение этих препаратов. Амитриптилин обладает кардиотоксическим действием, особенно при длительном применении, что необходимо учитывать при лечении функционального расстройства нижних мочевых путей, а также может вызывать ортостатическую гипотензию и желудочковую аритмию. Данный факт ограничивает применение препарата.
Еще одним антидепрессантом, иногда используемым при лечении ГМП, служит тразодон – производное триазолопиридина, по химической структуре не относящееся к трициклическим, тетрациклическим или другим группам антидепрессантов. Препарат имеет широкий спектр действия: анксиолитическое, тимолептическое, миорелаксирующее и седативное. Тразодон незначительно влияет на обратный захват дофамина и норадреналина, в основном действуя на обратный захват серотонина. По степени эффективности этот препарат сопоставим с трициклическими антидепрессантами, значительно превосходя их в плане безопасности и меньшей выраженности побочного действия. Возможно, тразодон наиболее эффективен при ноктурии. Его назначают по 60 мг 1 раз/сут (возможно увеличение дозы до 120 мг/сут в 2 приема).
– β3-адреномиметики (мирабегрон)
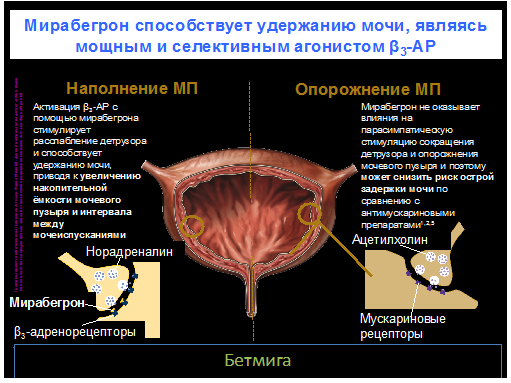
– аналоги вазопрессина
Другая группа лекарственных средств для коррекции императивных (ургентных) нарушений – аналоги вазопрессина [адиуретрин, десмопрессин (минирин)]. Это синтетические аналоги вазопрессина с выраженным антидиуретическим действием. По сравнению с вазопрессином обладают менее выраженным действием на гладкую мускулатуру сосудов и внутренних органов. Применение аналогов вазопрессина способствует уменьшению мочеотделения, их можно использовать при лечении первичного ночного недержания мочи. При назначении необходим особый контроль над пациентами, нужна осторожность при нарушениях функций почек, сердечно-сосудистых заболеваниях, малой емкости мочевого пузыря.
Ввиду сложности иннервации и множественности уровней замыкания рефлекса на мочеиспускания подбор соответствующих характеру поражения средств крайне сложен. Эти препараты используются как по отдельности, так и в различных сочетаниях, однако индивидуальный подбор их чрезвычайно сложен. Проводить его лучше при уродинамическом контроле за состоянием нижних мочевых путей. По мнению Kiesswetter H. с соавторами (1983) адекватное уродинамическое исследование является основой для выбора рациональной медикаментозной терапии нарушений мочеиспускания.
В лечении симптомов нижних мочевых путей у мужчин с признаками инфравезикальной обструкции используют следующие группы препаратов:
– альфа-адреноблокаторы (рассматривались ранее);
– ингибиторы 5альфа-редуктазы;
– ингибиторы фосфодиэстеразы 5-го типа;
– М-холиноблокаторы (рассматривались ранее);
– аналоги вазопрессина (рассматривались ранее);
– комбинация групп препаратов.

Лечение ингибитором 5 альфа-редуктазы должно быть длительным (не менее 1 года) с пересчетом ПСА через 6 месяцев.
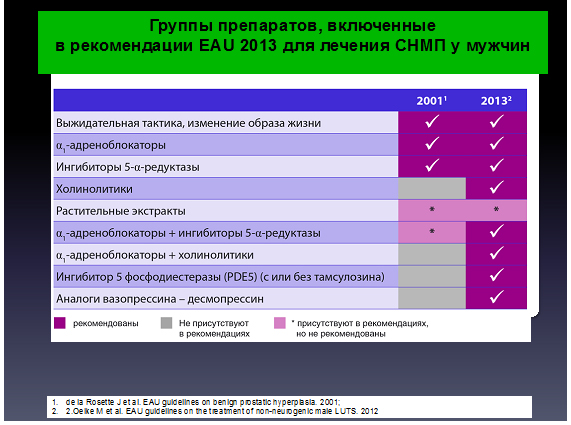
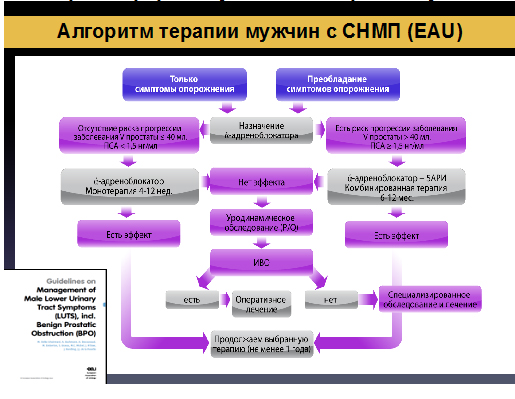
Согласно рекомендациям Европейской ассоциации Урологов (EAU) терапия нарушений мочеиспускания у мужчин представлена следующим образом:
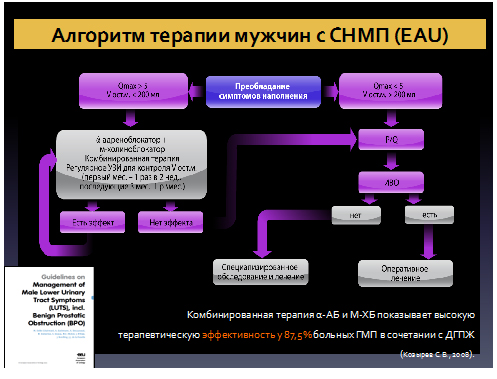
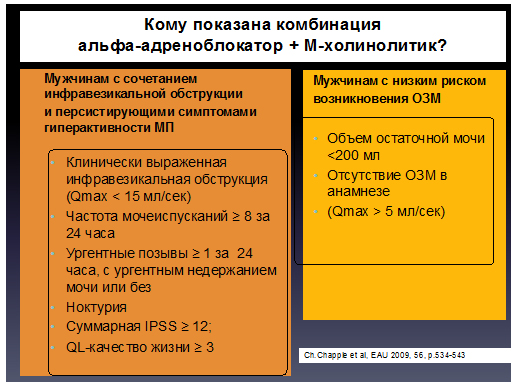
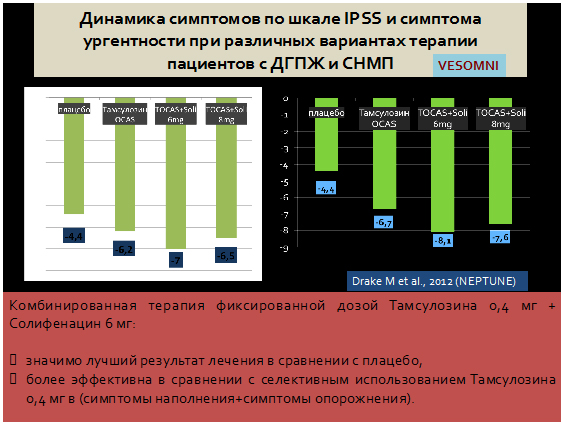
Сочетанное использование α-АБ и М-ХБ в лечении больных ГМП в сочетании с ДГПЖ является более эффективным, так как оно направлено одновременно на саму детрузорную гиперактивность, а также на динамический компонент ИВО, которая в свою очередь, может быть и причиной, и фактором поддержания ГМП.
В связи с положительным влиянием комбинированного применения М-холиноблокатора и альфа-адреноблокатора на симптомы нижних мочевых путей у мужчин был разработан новый препарат , в котором представлен тамсулозин в дозировке 0,4 мг и солифенацин в дозировке 6 мг. Преапарат в скором будущем будет зарегистрирован в стране. (уже зарегистрирован)