Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "СОДЕРЖАНИЕ В КРОВИ ИНСУЛИНА И ЛЕПТИНА ПРИ НМФ У ДЕВОЧЕК"
Автор: Начетова Т.А.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Акушерство и гинекология
Просмотров: 4 467
Дата проведения: с 08.10.2015 по 08.10.2016
В последние годы установлено, что гормональный статус женского организма тесно связан с состоянием обменных процессов и энергетических систем, к ключевым регуляторам которых относят инсулин и лептин. Приводятся данные о том, что у женщин с гормональнозависимыми нарушениями функции половой системы часто выявляется инсулинорезистентность и сдвиги в липидном спектре крови атерогенного характера.
О важной роли инсулина в поддержании функции женской половой системы известно давно. В литературе широко обсуждаются проблемы влияния инсулина на количество рецепторов к ЛГ в яичниках, синтез половых гормонов, формирование фолликулярных кист и пр. В последнее время появились данные о том, что гонадотропную функцию инсулин осуществляет в комплексе с инсулиноподобными факторами роста (ИФР). Возможные механизмы стимуляции инсулином/ИФР стероидогенеза в яичнике могут быть разделены на неспецифические и специфические. Неспецифические механизмы заключаются в классическом действии инсулина на метаболизм глюкозы, аминокислот и синтез ДНК. В результате повышается жизнеспособность клетки и, следовательно, усиливается синтез гормонов .Специфические механизмы включают прямое действие инсулина/ ИФР на стероидогенные ферменты, синергизм между инсулином и ЛГ/ФСГ, и влияние на количество рецепторов к ЛГ.
Изучение влияния инсулина на яичник позволило установить, что инсулин может стимулировать быстрое увеличение количества тека-клеток у человека и крысы. Кроме того, у женщин с СПКЯ, циркулирующие уровни инсулина коррелировали с яичниковым объемом. После того как инсулин связывается с рецептором, происходит активизация тирозинкиназы и запуск каскада внутриклеточного фосфорилирования белка и производство иноцитогликанов, что в свою очередь может привести к модуляции инсулином ферментов стероидогенеза.
Возрастающая концентрация андрогенов в яичнике под действием инсулина/ИФР вызывает атрезию фолликулов, что приводит к постепенной элиминации эстроген- и прогестерон-продуцирующих клеток гранулезы, которые прогрессивно замещаются андроген-продуцирующей тканью (тека-клетки, строма). Этим объясняется тот факт, что стимуляция яичникового стероидогенеза инсулином проявляется преимущественно в виде гиперандрогении. Было высказано предположение, что инсулин/ИФР могут стимулировать как ЛГ-зависимую активность цитохрома Р450с17a в яичниках и АКТГ-зависимую активность Р450с17a в надпочечниках, что, по-видимому, объясняет частое сочетание яичниковой и надпочечниковой форм гиперандрогении у пациенток с СПКЯ.
В норме инсулин, соединяясь со своими рецепторами на поверхности клеток мышечной, жировой и печеночной ткани, регулирует процессы захвата глюкозы, аминокислот, синтез гликогена, ДНК, белка, жирных кислот, транспорт ионов, а также подавление липолиза, глюконеогенеза и апоптоза. Однако в ряде случаев биологический ответ периферических тканей организма на воздействие эндогенного или экзогенного инсулина оказывается нарушенным и возникает инсулинорезистентность (ИР). При этом, однако, яичники и надпочечники могут сохранять чувствительность к инсулину, вследствие чего инсулин и инсулиноподобный фактор роста-1 (ИФР-1) продолжают оказывать стимулирующее воздействие на их функцию, что приводит к увеличению синтеза половых стероидов.
Патогенетические механизмы ИР до конца не известны, многофакторны и у подавляющего большинства пациенток с СПКЯ обусловлены не дефектом инсулинового рецептора, а нарушениями на рецепторном и пострецепторном уровне трансдукции инсулинового сигнала в клетку.
Причиной ИР могут быть факторы, повреждающие клетки-мишени (стресс, гипертермия, сепсис, голодание, уремия, цирроз). ИР обнаруживается при синдроме Кушинга, акромегалии, феохромоцитоме, тиреотоксикозе, инсуломе, наличии антител к инсулиновым рецепторам, ожирении и сахарном диабете. ИР также может наблюдаться и при физиологических состояниях – в подростковом возрасте и при беременности.
ИР усиливается в начале пубертата и нормализуется к его окончанию. Пик ИР приходится на собственно пубертатный период. По данным A. Moran с соавт. (1999), от 3 до 8 % здоровых девочек в возрасте 13–15 имеют ИР.
Наиболее изучен механизм развития гиперинсулинизма и ИР при питании с большим количеством жира. Полагают, что избыток жира в пище может прямо вести к его избытку в крови и по закономерностям глюкозожирнокислотного цикла может переключать метаболизм основных клеток-мишеней на преимущетвенное потребление и окисление жирных кислот. В этом случае тормозится инсулинзависимый транспорт глюкозы, возникает инсулинорезистентность, для компенсации которой развивается гиперинсулинизм.
Для выявления ИР широко используют такие показатели, как FGIR (fasting glucose/insulin ratio) и QUICKI (quintative insulin sensitivity chec index, рассчитывается по формуле 1/log уровня инсулина log уровня глюкозы) [van Hooff M.H.A. et al., 2000]. По данным исследований последних лет, в подростковом возрасте достаточно информативным и простым является индекс HOMA (homeostasis model assesment), который вычисляется по формуле: уровень Ин х уровень глюкозы)/22,5 [Porte D., 2006]. К настоящему времени доказано, что индекс НОМА у здорового человека в любом возрасте не должен превышать 3,5 у.е.
Результаты обследования здоровых девочек 13-17 лет с регулярным менструальным циклом представлены в таблице 1.
Таблица 1. Особенности показателей состояния углеводного обмена у девочек-подростков в зависимости от индекса массы тела (ИМТ)
|
Девочки-подростки с регулярным менструальным циклом |
Инсулин М±m, |
НОМА М±m, |
Гипер-инсули-немия |
Инсули-норе-зистент-ность |
|
частота, % |
частота, % |
|||
|
ИМТ в норме |
12,03±0,85 |
2,17±0,23 |
10,3 |
13,1 |
|
ИМТ повышен |
21,22±1,83 |
4,38±0,41 |
37,5 |
64,8% |
|
ИМТ снижен |
12,28±1,53 |
2,79±0,38 |
12,5 |
12,5 |
Гиперинсулинемия у девочек-подростков с нарушениями менструальной функции (НМФ) регистрируется у 10-26 при дефиците массы тела (в том числе у 10% – при гипоменструальном синдроме, при 26% – при пубертатных маточных кровотечениях), у 7-37% – у больных с нормальными значениями ИМТ (в том числе у 7% пациенток с вторичной аменореей, наступившей в результате потери массы тела, у 37% – у больных с пубертатными маточными кровотечениями, у 12% – у девочек с гипоменструальным синдромом), у 44-46% больных с избыточной массой тела и ожирением независимо от типа НМФ. ИР выявляется в среднем у 37,6 % девочек с НМФ. Причем ее наличие регистрируется не только при ожирении, но даже у каждой четвертой пациентки с нормальной массой тела и ее дефицитом (рис. 1).

Рисунок 1. Частота инсулинорезистентности среди девочек-подростков с нарушениями менструальной функции
Следует помнить, что длительно существующая гиперинсулинемия в конечном итоге может привести к истощению функциональных возможностей ß-клеток поджелудочной железы и возникновению инсулинзависимого сахарного диабета.
Представляет интерес возможность прогнозирования наличия инсулинорезистентности у девочек-подростков с пубертатными маточными кровотечениями (ПМК) [Дынник А.А, 2012] с использованием специальной таблицы. Проводится последовательное сложение прогностических коэффициентов ПК, при сумме более 13 баллов диагностируется инсулинорезистентность (табл. 2).
Таблица 2. Прогностическая таблица для выявления инсулинорезистентности
|
Признак |
Градация |
ПК |
|
Кровотечение |
Возникло впервые |
1,32 |
|
Рецидивирующее |
-3,46 |
|
|
Половое развитие |
В норме |
-0,52 |
|
Опережает |
4,63 |
|
|
Менструальный возраст, годы |
<1 |
3,46 |
|
1−2 |
-1,39 |
|
|
≥2 |
-2,17 |
|
|
Первое нарушение цикла |
С менархе |
0,97 |
|
Через 1 год после менархе |
-1,13 |
|
|
Через 2 года после менархе |
5,30 |
|
|
Через 3 года после менархе |
-4,40 |
|
|
Через 4 года и больше после менархе |
-6,16 |
|
|
Появление первого кровотечения |
С менархе |
2,07 |
|
Через 1 год после менархе |
-0,88 |
|
|
Через 2 года после менархе |
1,96 |
|
|
Через 3 года после менархе |
-1,39 |
|
|
Через 4 года и больше после менархе |
-1,81 |
|
|
Менархе |
Раннее |
10,65 |
|
Позднее |
-6,16 |
|
|
Масса тела |
Избыточная |
1,40 |
|
Нормальная |
0,01 |
|
|
Дефицит |
-5,79 |
|
|
Течение родов у матери девочки |
Нормальное |
0,16 |
|
Патологическое |
2,06 |
|
|
Объем талии/объем бедер >0,75 |
Есть |
2,51 |
|
Нет |
-1,74 |
|
|
ОТ >90 |
Есть |
8,18 |
|
Нет |
-0,98 |
|
|
Размеры матки при УЗИ органов малого таза |
Увеличены |
2,45 |
|
Нормальные |
-2,51 |
|
|
Уменьшены |
-1,31 |
|
|
Наличие внутриматочного М-Эхо |
Есть |
1,38 |
|
Нет |
-2,93 |
|
|
Экстрагени-тальная патология |
1 заболевание |
0,10 |
|
2 заболевания |
-0,99 |
|
|
3 заболевания |
3,80 |
Зависимость гормональных показателей (индекс свободного тестостерона, индекс свободного эстрадиола) от величины индекса НОМА обнаружены у девочек-подростков с вторичной аменореей. Имеются данные о более высоком уровне триглицеридов у девочек-подростков с НМФ с ИР, чем при нормальных значениях индекса НОМА.
В литературе широко представлены исследования, подтверждающие ингибирующий эффект инсулина на производство в печени глобулина, связывающего половые гормоны (ГСПГ). Установлено, что у больных с НМФ с ИР сниженные значения ГСПГ были в два раза чаще, а повышенные – почти в 3,5 раза реже, чем у девочек с нормальными значениями индекса НОМА (рис. 2).
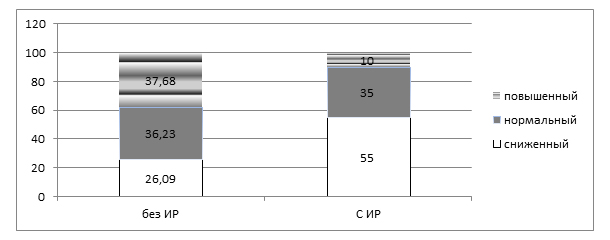
Рисунок 2. Удельный вес больных с различными уровнями ГСПГ
Можно предположить, что у части девочек с небольшими задержками менструаций инсулинорезистентность играет компенсаторную роль, приводя к снижению уровня ГСПГ, а, следовательно, повышая содержание в крови свободных фракций половых гормонов.
Как уже упоминалось ранее, еще в 50-е годы прошлого столетия было установлено, что сроки и темпы полового развития девочки самым тесным образом связаны с массой тела. К настоящему времени доказано, что вступление в пубертат обусловлено не столько непосредственно с массой тела, сколько с повышением в крови уровня лептина – гормона белой жировой ткани при достижении определенной массы жировой ткани. Этот гормон не только ответствен за чувство насыщения, но и служит сигналом о достаточном количестве энергии, необходимой для процесса полового созревания, обеспечения регулярности менструаций и способности к репродукции [М.Р. Межлумян, 2008]. Лептин оказывает как прямое, так и опосредованное влияние на синтез половых гормонов яичниками и регулирует овариальный фолликулогенез через контроль секреции гонадотропинов. Уровень лептина в крови повышается параллельно с увеличением процента жировой ткани в общей массе тела. Лептин в период полового созревания стимулирует продукцию ЛГ-РГ, ЛГ и ФСГ, стимулирует и нормализует (совместно с инсулином и ИФР-1) процессы фолликулогенеза в яичниках и продукцию эстрогенов как путем непосредственного влияния на клетки гранулезы фолликулов, так и через центральные механизмы этого процесса. Однако у подростков с ожирением и повышенным уровнем лептина в крови перечисленные пути влияния лептина на функцию яичников не реализуются в связи с возникновением при ожирении лептинорезистнетности.
При определении содержания в крови лептина у 219 девушек-подростков с НМФ установлено, что его средние значения при всех клинических вариантах патологии не отличаются от контрольных. Однако концентрация этого гормона в крови закономерно связана с массой тела – значительно повышена при ожирении и избыточной массе и снижена при ее дефиците у девочек с олигоменореей (ОМ) и вторичной аменореей (ВА), а при ПМК и ВА обнаруживается достоверное снижение его уровня и при нормальном ИМТ (рис. 3).

* – Рu<0,05 по сравнению с контролем
Рисунок 3. Уровень лептина в крови девочек-подростков с НМФ
Анализ индивидуальных показателей уровня лептина выявил их значительную неоднородность. Повышение средних значений концентрации лептина в крови при избыточной массе тела обусловлено довольно часто наблюдающейся гиперлептинемией (53,9 %). У абсолютного большинства девочек с дефицитом массы тела (81,9 %) содержание лептина в крови снижено (уровень лептина 9,4 нг/мл и ниже). Лишь у больных с нормальным ИМТ частота разных уровней лептина зависит от клинического варианта НМФ. Гиполептинемия на фоне нормального ИМТ регистрируется более чем у половины больных с ПМК, достоверно реже, но также довольно часто при ОМ и ВА (рис. 4). Согласно рассчитанной величине отношения шансов, вероятность возникновения НМФ при нормальной массе тела увеличивается в 3,22 раза при снижении уровня Л ниже 9,50 нг/мл, а при дефиците массы тела – в 12 раз.

Рисунок 4. Частота гиполептинемии у девочек с НМФ на фоне нормального ИМТ
Полученные результаты можно расценить как недостаток энергетических возможностей организма, необходимых для поддержания ритмичности и продолжительности менструаций в подростковом возрасте. Очевидно, дефицит энергетических ресурсов относится к важным звеньям патогенеза ПМК у половины девочек с нормальным ИМТ. Это же может быть и причиной нарушений ритмичности менструаций.
Известно, что содержание лептина в сыворотке крови отражает количество энергии, запасенной в организме, и прямо пропорционально количеству жировой ткани, что демонстрирует наличие тесных прямых корреляционных связей между уровнем лептина и ИМТ как у здоровых лиц, так и у девочек-подростков с НМФ.
Однако в ряде исследований было показано, что уровень лептина зависит и от изменений в калорийности пищи. Chan J.L. было показано, что у лиц с нормальными значениями ИМТ при 72-часовом голодании уровень лептина может снижаться от 10 до 40% от исходного показателя без изменения процента жировой ткани в организме. Согласно данным Левенец С.А., Андреевой В.О., подавляющее число больных с ОМ и ВА, возникших после регулярного менструального цикла, с нормальными показателями ИМТ ограничивали себя в еде, что и может объяснять высокую частоту снижения у них уровня лептина. Следует отметить, что это может приводить к снижению показателя Л/ИМТ, что является неблагоприятным фактором в отношении восстановления менструального цикла таких пациенток.
Несмотря на высокий уровень лептина у девочек с избыточной массой тела и ожирением, он не оказывает своего специфического влияния на организм в связи со сформировавшейся лептинорезистенстностью. Индекс Лептин/ИМТ у здоровых девочек колеблется в пределах 0,7-0,9, при избыточной массе тела и ожирении он, как правило, превышает единицу.
Таким образом, определение уровня лептина, инсулина и величины индекса НОМА у девочек-подростков с НМФ позволяют уточнить ряд звеньев патогенетических механизмов формирования патологии.
Список литературы
1. Марчук Н.Ю. Диагностика гиперинсулинемии у девочек-подростков с синдромом поликистозных яичников / Н.Ю. Марчук, А.А. Сергиенко // Здоровье женщины. – 2005. – № 4 (24). – С. 100-102.
2. Мкртумян А.М. Взаимосвязь между гормонами яичников, массой жировой ткани и инсулинорезистентностью / А.М. Мкртумян // Пробл. репродукции. – 2005.- № 5.- С. 55-59.
3. Роль инсулинорезистентности в патогенезе гиперандрогении у женщин с нарушением репродуктивной функции / Е.К. Комаров [и др.] // Проблемы репродукции. – 2005.- № 5.- С. 25-30.
4. Шестакова В.М. Инсулинорезистентность: патофизиология, клинические проявления, подходы к лечению / В.М. Шестакова, О.Ю. Брескина // Эндокринология.- 2002.- Т. 4, № 10.- С. 1-4.
5. Инсулинорезистентность при нарушениях менструальной функции в подростковом возрасте / С.А. Левенец [и др.] // Охрана репродуктивного здоровья – будущее России. – Белгород, 2010. – С. 147–150.
6. Левенец С.А. Содержание лептина и инсулина в крови девочек-подростков с нарушениями менструальной функции на фоне разной массы тела / С.А. Левенец, Т.А. Начетова // Нейроэндокринологоия – 2010: тез. докл. VIII Всероссийской конф. – СПб., 2010. – С. 88–89.
7. Гоженко А.И. Роль лептина в физиологии и патологии репродуктивной системы / А.И. Гоженко // Патология. – 2005. – Т. 2, № 2. – С. 12-16.
8. Пат. 2363002, RU, МПК G01N33/74. Способ прогнозирования восстановления менструальной функции у пациенток с нервной анорексией / В.О. Андреева; заявитель и патентообладатель Федеральное государственное учреждение Ростовский НИИ акушерства и педиатрии Федерального агентства по новым медицинским технологиям. – № 2008121776/15; заяв. 30.05.08; опубл. 27.07.09
9. Body fat mass, leptin and puberty / W. Kiess [et al.] // J. Pediatr. Endocrinol. Metab.- 2000.- N 13.- P. 717-722.
10. Hyperinsulinemia and human chorionic gonadotropin synergistically promote the growth of ovarian follicular cysts in rats / L. Poretsky, J. Clemons, K. Bogovich et al. // Metabolism. – 1992. – N 8. – P. 903-910.
11. Hyperinsulinemia in polycystic ovary syndrome: relationship to clinical and hormonal factors / A. Vidal-Puig, [et al.] // Clin. Investig.- 1994. – N 11. – P. 853-857.
12. Insulin resistance during puberty: results from clamp studies in 357 children / A. Moran [et al.] // Diabetes.- 1999. – N 10.- P. 2039-2044.
13. Insulin, androgen, and gonadotropin concentrations, body mass index, and waist to hip ratio in the first years after menarche in girls with regular menstrual cycles, irregular menstrual cycles, or oligomenorrhea / van Hooff M.H.A. [et al.] // The journal of clinical endocrinology and metabolism. – 2000. – Vol. 85, N 4. – P. 1394-1400.
14. Lee J.H. Leptin resistance in associated with extreme obesyty and aggregates in families / International journal of obesity and related metabolic disorders / J.H. Lee // J. Inter. Assoc. study obesity. – 2001. – Vol. 25, N 10. – P. 1471-1473
15. Macut D. Leptin and human reproduction / D. Macut, D. Micic // Med. Pregl.- 1998.- Vol. 51, N 9-10.- P. 410-414.
16. Mantzoros C. S. Role of leptin in reproduction / C. S. Mantzoros // Ann. N. Y. Acad. Sci.- 2000.- Vol. 900.- P. 174-183.
17. The impact of insulin secretion on the ovarian response to exogenous gonadotropins in polycystic ovary / A.M. Fulghesu [et al.] // J. Clin. Endocrinol. Metab. -1997. – N 2.- P. 644-648.
18. The Insulin-Related ovarian regulatory system in healh and disease / L. Poretsky [et al.] // Endocrine Reviews.- 1999.- N 4.- P. 535-582.







