Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "Эффективность комбинированного применения сублингвальной и вагинальной форм микронизированного прогестерона в терапии угрозы преждевременных родов"
Автор: О.В. Голяновский, А.М. Рубинштейн, М.А. Бачинская
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Акушерство и гинекология, Семейная медицина/Терапия
Просмотров: 2 847
Дата проведения:
В статье представлены современные данные об особенностях этиологии и патогенеза, клиники и терапии угрозы преждевременных родов. Приведены результаты клинического исследования эффективности комбинированной терапии сублингвальной и вагинальной формами микронизированного прогестерона угрозы преждевременных родов в сроке 22-30 недель.
 Ключевые слова: угроза преждевременных родов, сублингвальная форма микронизированного прогестерона, вагинальная форма микронизированного прогестерона, масляный прогестерон.
Ключевые слова: угроза преждевременных родов, сублингвальная форма микронизированного прогестерона, вагинальная форма микронизированного прогестерона, масляный прогестерон.
Преждевременные роды – одна из самых острых проблем современного акушерства. Несмотря на все наработки мировой и отечественной медицинской общественности, частота этой патологии не снижается и составляет 6–12 % в развитых странах. Ежегодно в мире рождается 12–15 млн недоношенных детей, а частота анте-, интра- и перинатальной смертности среди недоношенных новорожденных в 15–30 раз превышает этот показатель для детей, рожденных в срок. Примерно 50 % недоношенных новорожденных остаются глубокими инвалидами (проявления респираторного дистресс-синдрома, внутрижелу-дочковых кровоизлияний, тяжелой ретинопатии и др.) [10, 11].
Преждевременными считают роды со спонтанным началом, прогрессированием родовой деятельности и рождением плода массой более 500,0 г в сроках беременности от 22 недель до 36 недель + 6 суток [4]. В процессе преждевременных родов выделяют 2 этапа: угроза преждевременных родов и собственно начавшиеся преждевременные роды. Уделяя внимание предупреждению и терапии преждевременных родов, акушеры-гинекологи, прежде всего, стараются вовремя профилактировать и лечить угрозу преждевременных родов.
Преждевременные роды рассматривают как «большой акушерский синдром», в реализации которого принимает участие ряд факторов: инфекционно-воспалительный процесс, плацентарная дисфункция, истмико-цервикальная недостаточность, тромбофилии, иммунные реакции, экстрагенитальная патология, нейроэндокринные нарушения, большинство из которых сопровождаются прогестероновой недостаточностью. Многофакторность этой патологии определенным образом объясняет отсутствие единого высокоэффективного алгоритма профилактики и лечения преждевременных родов [5].
На сегодняшний день план лечения беременных с угрозой преждевременных родов включает следующие пункты [4, 7]:
- Токолитическая и спазмолитическая терапия.
- Профилактика респираторного дистресс-синдрома плода.
- Гормонотерапия препаратами прогестерона.
- Метаболическая и дезагрегантная терапия.
- Фоновая терапия в зависимости от соматической патологии беременной.
Согласно последним данным, прогестерон подавляет экспрессию генов, отвечающих за сократительную активность миометрия, и активирует гены, участвующие в синтезе оксида азота – мощного эндогенного миорелаксанта. Кроме того, прогестерон препятствует преждевременному сокращению шейки матки и блокирует образование в миометрии межклеточных контактов, необходимых для обеспечения полноценных скоординированных сокращений. Прогестерону присуще мощное нейропротективное действие, которое проявляется системной противовоспалительной активностью; он является антагонистом простагландина F2α.
Токолитическое свойство в основном присуще природным метаболитам натурального прогестерона (5b-прегнанолону, 5b-прегнандиолу, 5b-прегнандиону), которые образуются при взаимодействии прогестерона с ферментом 5b-редуктазой и создают максимально сильный и полный токолитический эффект. Взаимодействие с ферментами возможно только при полной идентичности эндогенного прогестерона, поэтому синтетические аналоги прогестерона не имеют таких свойств [3, 6].
Однако, микронизированный прогестерон (МП), синтезированный из растительного сырья – экзогенный аналог гормона желтого тела, полностью идентичен натуральному и имеет все его свойства. В процессе микронизации небольшие кристаллы синтезированного прогестерона добавляют к длинным цепям жирных кислот, что улучшает абсорбцию и биодоступность прогестерона за счет увеличения площади поверхности и контакта со слизистыми оболочками.
Фармакокинетика и фармакодинамика прогестерона, а значит и изученные эффекты зависят от способа введения препарата. При внутримышечном пути введения наблюдаются сверхфизиологические плазменные концентрации прогестерона. Пероральное применение обнаруживает быстрое повышение плазменных концентраций с последующим постепенным их снижением. Кроме того, при этих способах введения имеет место эффект первого прохождения гормона через печень с образованием нескольких биологически активных метаболитов. При вагинальном введении достигают стабильных плазменных концентраций и постоянных концентраций в тканях – так называемый эффект первого прохождения через матку с направленным воздействием на эндометрий, кроме того, наблюдают минимальный риск возникновения системных эффектов. Сублингвальная форма дает возможность достичь самого быстрого эффекта, отсутствует первичный метаболизм гормона в печени, а значит не теряется его концентрация и, таким образом, эта форма введения имеет наименее длительный период полувыведения [1, 3]. Хотя следует отметить, что фундаментальных исследований применения сублингвальной формы МП в случае угрозы преждевременных родов не проводили.
На сегодняшний день, по нашим данным, оптимальной является следующая комбинация различных форм введения прогестерона: лечение в острый период целесообразно начинать с сублингвальной формы, а после регресса клинической симптоматики и достижения подходящей для данного срока беременности концентрации гормона в плазме крови, при отсутствии проявлений кольпита, следует перевести пациентку на применение вагинальной формы.
В рекомендациях Европейского общества акушеров-гинекологов за 2011 г. в случае высокого риска преждевременных родов рекомендовано назначение вагинальной формы прогестерона с начала II и в течение III триместра беременности. Society for Maternal-Fetal Medicine в своих рекомендациях за 2012 г. также рекомендует применение вагинального прогестерона с момента установления диагноза угрозы преждевременных родов и до 36-й недели гестации при длине шейки матки ≤20 мм (даже у бессимптомных женщин без преждевременных родов в анамнезе).
В ходе исследования R. Romero и соавт. (2012) установлено, что на фоне применения вагинального МП риск преждевременных родов в сроке до 33 недель снизился на 42 %, кроме того, достоверно снизились показатели частоты заболеваемости/смертности новорожденных, развития респираторного дистресс-синдрома, потребности в искусственной вентиляции легких и др. [9]. Подобные результаты получили в своих исследованиях специалисты Американской ассоциации акушеров-гинекологов – применение натурального прогестерона вагинально уменьшает частоту респираторного дистресс-синдрома новорожденных на 52–61 % [12]. Интересными также являются итоги многоцентрового международного исследования PREGNANT, которые свидетельствуют о том, что использование МП снижает частоту преждевременных родов и респираторного дистресс-синдрома новорожденных [13].
Однако, несмотря на доказанную в ряде клинических исследований высокую эффективность терапии препаратами прогестерона угрозы преждевременных родов, вопросы о назначении препаратов МП, о наиболее оптимальной форме введения препарата и продолжительности лечения остаются дискутабельным.
Цель исследования: изучить эффективность применения сублингвальной и вагинальной форм МП в виде таблеток в комплексной терапии угрозы преждевременных родов.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании принимали участие 60 беременных с угрозой преждевременных родов в сроке беременности 22–30 недель, которые были госпитализированы и получили терапию на клинических базах кафедры акушерства и гинекологии № 1 НМАПО имени П.Л. Шупика.
Отбор пациенток для исследования проводили по следующим критериям:
- УЗ-признаки:
- повышение тонуса миометрия;
- длина шейки матки менее 20 мм;
- отсутствие предварительно диагностированной истмико-цервикальной недостаточности (ИЦН).
- Клинические признаки:
- боль ноющего, давящего, схваткообразного характера внизу живота, в пояснице;
- мажущие кровянистые выделения из половых путей;
- повышенный тонус матки.
- Снижение уровня прогестерона в плазме крови.
- Отсутствие сопутствующих акушерско-гинекологических (рубец на матке, порок развития матки, предварительно диагностированная ИЦН) и экстрагенитальных патологий.
Все пациентки были разделены на 2 группы:
I группа – 30 беременных, которые в течение первых суток получали магнезиальную токолитическую терапию: MgSO4 25 % 20 мл + Sol. NaCl 0,9 % 200 мл; гормональную терапию – сублингвальная форма МП 100 мг ч/з 6 ч, трижды, вместе с третьим приемом сублингвальной формы беременные вводили вагинальную форму МП – 100 мг; системную противовоспалительную терапию – ректальные свечи с диклофенаком 50 мг два раза в сутки. На вторые сутки беременные получали магнезиальную токолитическую терапию: MgSO4 25 % 20 мл + Sol. NaCl 0,9 % 200 мл; гормональную терапию – вагинальную форму МП – 150 мг два раза в сутки; системную противовоспалительную терапию – ректальные свечи с диклофенаком 50 мг два раза в сутки. На третьи сутки беременные получали гормональную терапию – вагинальную форму МП – 150 мг два раза в сутки; комбинированный препарат магния лактата дигидрата (470 мг) и пиридоксина гидрохлорида (5 мг) по 2 таблетки три раза в сутки; системную противовоспалительную терапию – ректальные свечи с диклофенаком 50 мг два раза в сутки. На 4–7-е сутки беременные получали гормональную терапию – вагинальную форму МП – 100 мг два раза в сутки; комбинированный препарат магния лактата дигидрата (470 мг) и пиридоксина гидрохлорида (5 мг) по 2 таблетки три раза в сутки; системную противовоспалительную терапию – ректальные свечи с диклофенаком 50 мг при наличии болевых ощущений.
II группа – 30 беременных, которые в течение первых двух суток получали магнезиальную токолитическую терапию: MgSO4 25 % 20 мл + Sol. NaCl 0,9 % 200 мл; гормональную терапию – 2,5 % раствор масляного прогестерона 2 мл с внутримышечным путем введения один раз в сутки; системную противовоспалительную терапию – ректальные свечи с диклофенаком 50 мг три раза в сутки. На третьи сутки беременные получали гормональную терапию – 2,5 % раствор масляного прогестерона 2 мл с внутримышечным путем введения один раз в сутки; комбинированный препарат магния лактата дигидрата (470 мг) и пиридоксина гидрохлорида (5 мг) по 2 таблетки три раза в сутки; системную противовоспалительную терапию – ректальные свечи с диклофенаком 50 мг два раза в сутки. На 4–7-е сутки беременные получали гормональную терапию – 2,5 % раствор масляного прогестерона 1 мл с внутримышечным путем введения один раз в сутки; комбинированный препарат магния лактата дигидрата (470 мг) и пиридоксина гидрохлорида (5 мг) по 2 таблетки три раза в сутки; системную противовоспалительную терапию – ректальные свечи с диклофенаком 50 мг при наличии болевых ощущений.
Все пациентки обеих групп получили профилактику РДС плода 24 мг дексаметазона внутримышечно (6 мг ч/з 12 ч 4 раза).
Отмену гормональных препаратов прогестерона проводили с 8-го дня постепенно под контролем УЗИ в соответствии с клиническим состоянием беременной. В случае выявления укорочения шейки матки до 20 мм и более мы рекомендовали беременным продолжить применение вагинальной формы МП (50-100 мг два раза в сутки) до 34 недели беременности с дальнейшим постепенным снижением дозы и отменой препарата.
В ходе исследования изучали следующие параметры:
- Особенности гинекологического и акушерского анамнезов.
- Жалобы.
III. Лабораторные показатели:
1) общий анализ крови с лейкоцитарной формулой;
2) общий анализ мочи;
3) уровень прогестерона в плазме крови;
4) уровни электролитов Mg++ и Ca++ в сыворотке крови;
5) АЛТ, АСТ, ЛФ, общий билирубин, непрямой билирубин, общий белок, альбумины;
6) коагулограмма: количество тромбоцитов, АЧТВ, фибриноген, фибрин, тромбиновое время;
7) вагинальный мазок на микрофлору.
- УЗ-показатели:
1) длина шейки матки;
2) состояние внутреннего зева (диаметр, мм);
3) тонус миометрия.
Особенности течения родов и послеродового периода:
1) способ родоразрешения;
2) срок родоразрешения;
3) осложнения в родах;
4) оценка новорожденного на 1-й и 5-й минуте по шкале Апгар;
5) осложнения со стороны новорожденного.
Статистическая обработка полученных результатов проводилась на персональном компьютере с помощью офисных программ «Microsoft Excel» с использованием основных статистических методов расчета. Достоверность разности средних значений определяли с исчислением t-критерия Стьюдента, сравнение выборок, содержащих качественные признаки, проводили по коэффициенту Фишера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Группы женщин были репрезентативными по возрасту, месту жительства, социальному статусу, по состоянию соматического здоровья и паритету (табл. 1).
Таблица 1. Характеристика групп исследования
|
Характеристика |
I группа, n1 = 30 |
II группа, n2 = 30 |
|
Возраст, лет |
29,5 ± 9,5 |
29 ± 7,5 |
|
Жители города, % |
60,0 |
56,7 |
|
Жители села, % |
40,0 |
43,3 |
|
Работающие, % |
36,7 |
33,3 |
|
Домохозяйки, % |
63,3 |
66,7 |
|
Курящие, % |
3,3 |
6,7 |
|
Первородящие, % |
43,3 |
50,0 |
|
Повторнородящие, % |
56,7 |
50,0 |
|
Преждевременные роды в анамнезе, % |
26,7 |
20,0 |
Достоверной разности частоты преждевременных родов в анамнезе в обеих группах исследования не наблюдали.
Во время госпитализации практически все беременные в обеих группах исследования жаловались на ноющие и/или схваткообразные боли внизу живота и/или в пояснице. В I группе мажущие кровянистые выделения из половых путей наблюдали 33,3 % беременных, этот показатель достоверно не отличался во II группе исследования и составил 40,0 % (рис. 1).
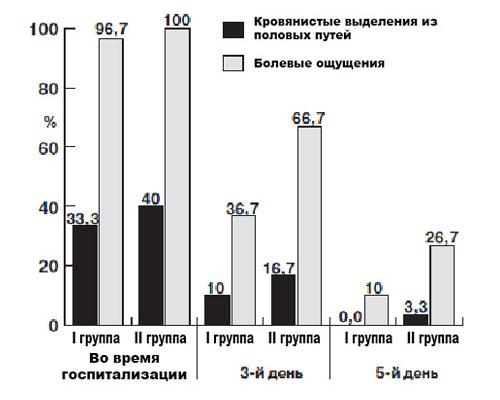
Рисунок 1. Динамика проявлений основных жалоб в группах исследования
В процессе лечения мы наблюдали быстрый регресс клинической симптоматики в I группе исследования. Так, на третьи сутки лечения болевые ощущения отмечали 40 % женщин, в то же время во II группе этот показатель был достоверно выше (р<0,01) и составлял 66,7 %. Полученные результаты мы связываем с быстрым действием сублингвальной, а затем поддерживающим действием вагинальной форм МП, по сравнению с умеренными темпами всасывания масляного прогестерона с ягодичной мышцы. На пятые сутки клиническая симптоматика сохранялась у 10,0 % беременных I группы и 26,7 % пациенток II группы. На седьмые сутки жалобы у пациенток обеих группы отсутствовали.
Воспалительные изменения по результатам общего анализа крови с подсчетом лейкоцитарной формулы и определения СОЭ отсутствовали у всех беременных в обеих группах исследования, значение абсолютного количества лейкоцитов 12,0х109/л считали верхней границей нормы для II-III триместров беременности. Также ни у одной из пациенток мы не наблюдали проявлений воспаления мочевой системы по данным общих анализов мочи. У 16,7 % пациенток I группы и 20,0 % пациенток II группы был диагностирован кандидозный кольпит, этим пациенткам соответственно была назначена местная интравагинальная антимикотическая терапия, которая не совпадала по времени с основным лечением.
Средние уровни концентрации прогестерона на момент госпитализации в обеих группах исследования не имели достоверных различий. Во время лечения была замечена интересная тенденция: уровни прогестерона во II группе на третьи сутки имели меньший прирост, чем в I группе, однако на пятые и седьмые сутки именно во II группе мы фиксировали более высокие уровни концентрации прогестерона в плазме крови (рис. 2).
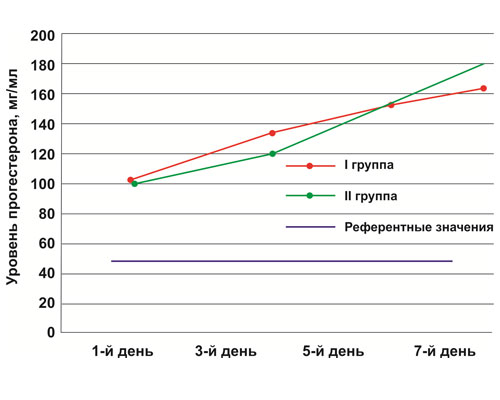
Рисунок 2. Концентрация прогестерона в плазме крови
Полученные результаты можно объяснить более длительным всасыванием масляного прогестерона именно при внутримышечном введении с последующим образованием пиковой концентрации в плазме крови, в то время как вагинальная форма МП обеспечивает первичное прохождение и пиковую концентрацию гормона в матке.
Уровни электролитов Mg++ и Ca++ в сыворотке крови беременных обеих групп не имели достоверных различий и существенно не изменялись в течение всей терапии.
При проведении биохимического исследования крови уровни показателей печеночных проб (АЛТ, АСТ, общий билирубин, непрямой билирубин, общий белок) и коагулограммы (АЧТВ, фибриноген, фибрин, тромбиновое время) в обеих группах исследования находились в рамках референтных значений, а значит можно утверждать, что нарушения функции печени отсутствовали у всех женщин обеих групп.
Во время госпитализации всем беременным было проведено ультразвуковое исследование по вагинальной методике с проведением цервикометрии. Согласно результатам цервикометрии было сформировано три условных диапазона; длина шейки матки более 25 мм и закрытый внутренний зев свидетельствовали об отсутствии органических изменений со стороны шейки матки. В I группе у 56,7 % пациенток наблюдали длину шейки матки менее 25 мм, у 83,3 % пациенток – закрытый внешний зев или диаметр наружного зева менее 3 мм. Эти показатели во II группе не имели достоверных различий и составляли 46,7 % и 90,0 % соответственно. Повышенный тонус матки по данным эхоскопического исследования имели 100 % пациенток обеих групп (табл. 2).
Таблица 2. Результаты УЗ-диагностики в группах исследования
|
УЗ-признак |
Частота проявления УЗ-признака в группах исследования, % |
|||||||
|
I группа, n1 = 30 |
II группа, n2 = 30 |
|||||||
|
На момент госпитализации |
3-и сутки |
5-е сутки |
7-е сутки |
На момент госпитализации |
3-и сутки |
5-е сутки |
7-е сутки |
|
|
Длина шейки матки |
||||||||
|
>25 мм |
56,7 |
50,0 |
50,0 |
50,0 |
46,7 |
33,3 |
26,7 |
26,7 |
|
20-25 мм |
23,3 |
30,0 |
30,0 |
30,0 |
30,0 |
33,3 |
30,0 |
30,0 |
|
15-20 мм |
20,0 |
20,0 |
20,0 |
20,0 |
23,3 |
33,3 |
43,3 |
43,3 |
|
Состояние внутреннего зева |
||||||||
|
Закрыто, d<3 мм |
83,3 |
80,0 |
80,0 |
80,0 |
90,0 |
80,0 |
73,3 |
73,3 |
|
d>3 мм |
16,7 |
20,0 |
20,0 |
20,0 |
10,0 |
20,0 |
26,7 |
26,7 |
|
Тонус миометрия |
|
|
|
|
|
|
|
|
|
N |
0 |
46,7 |
73,3 |
100,0 |
0 |
30,0 |
50,0 |
100,0 |
|
ˆ |
100,0 |
53,3 |
26,7 |
0 |
100,0 |
70,0 |
50,0 |
0 |
Результаты наружного акушерского и вагинального исследований у пациенток обеих групп при госпитализации полностью совпадали с результатами УЗИ и характером жалоб беременных.
Основными УЗ-признаками эффективности проведенной терапии считали отсутствие прогрессирования укорочения шейки матки, увеличение диаметра внутреннего зева и исчезновение гипертонуса матки. В I группе на третьи сутки у 6,7 % пациенток длина шейки матки уменьшилась до 20-25 мм, а у 3,3 % диаметр внутреннего зева увеличился > 3 мм. Во II группе эти показатели были несколько хуже, так у 13,4 % длина шейки матки составила менее 25 мм, а у 10,0 % шейка матки стала короче 20 мм. На пятые и седьмые сутки мы не наблюдали прогрессирования клинической симптоматики в I группе пациенток, однако во II группе количество женщин с длиной шейки матки 15-20 мм увеличилась еще на 10,0 %. Более высокую эффективность и более быстрый эффект лечения в I группе можно объяснить уникальным свойством именно вагинальной формы МП накапливаться непосредственно в тканях, противодействовать сокращению матки и сохранять структуру шейки матки.
Темпы восстановления нормального тонуса миометрия в I группе также были более быстрыми, чем во II.
Во время дальнейшего наблюдения было установлено, что у женщин I группы роды в сроке 37 недель и более произошли у 83,3 %, в частности, в сроке 40–42 недель у 16,7 %. Из них у 16,7 % беременных родоразрешение осуществлялось путем кесарева сечения в связи с дистрессом плода в родах – 10 %, преждевременным отслоением нормально расположенной плаценты – 3,35 %, дистоцией шейки матки в родах – 3,35 %. Преждевременный разрыв плодных оболочек (ПРПО) наблюдали в 20,0 % случаев.
Во II группе роды в сроке доношенной беременности произошли у 53,3 %, родоразрешение путем кесарева сечения произошло у 10 % в связи с дистрессом плода в родах. ПРПО наблюдали в 23,3 % случаев.
По шкале Апгар на первой минуте новорожденные I группы имели оценку 6,4 ± 1,6, II группы – 6,1 ± 1,9; на пятой минуте новорожденные I группы имели оценку 7,5 ± 1,5 балла, II группы – 7,0 ± 1,8 балла.
Преждевременные роды в I группе наблюдали у 16,7% женщин в сроках 32–37 недель, роды протекали консервативно, новорожденные были оценены на 1-й минуте в 5,0 ± 1,0 балла и на 5-й минуте – 6,0 ± 1,0 балла по шкале Апгар. Во II группе преждевременные роды наблюдали достоверно чаще (р<0,05) у 46,7% пациенток, в сроках 30–37 недель у 26,7 % женщин роды были проведены консервативно, оперативное родоразрешение проведено в связи с преждевременным отслоением плаценты в 2 случаях. Новорожденные были оценены на 1-й минуте в 4,0 ± 1,0 балла и на 5-й минуте – 6,0 ± 1,0 балла по шкале Апгар.
Полученные результаты свидетельствуют о лучших перинатальных перспективах у пациенток, получавших комбинированную терапию угрозы преждевременных родов сублингвальной и вагинальной формами МП, по сравнению с беременными, получавшими внутримышечные инъекции 2,5 % масляного раствора прогестерона.
В ходе исследования благодаря высококвалифицированной работе медицинского персонала мы не наблюдали побочных эффектов и осложнений терапии в обеих группах исследования.
ВЫВОДЫ
- Использование сублингвальной формы микронизированного прогестерона и препаратов магния в период выраженной клинической симптоматики угрозы преждевременных родов позволяет получить максимально быстрый терапевтический эффект и предотвратить дальнейшее прогрессирование структурных изменений со стороны шейки матки.
- Комплексная терапия угрозы преждевременных родов с использованием сублингвальной и вагинальной форм микронизированного прогестерона, препаратов магния, нестероидных противовоспалительных препаратов обладает высокой эффективностью терапевтического действия и может быть рекомендована для широкого использования в родовспомогательных учреждениях.
- Применение вагинальной формы МП в терапии угрозы преждевременных родов и в качестве вторичной профилактики преждевременных родов у женщин с укороченной шейкой матки (менее 20,0 мм) достоверно уменьшает долю преждевременных родов и улучшает перинатальные исходы.
СПИСОК ЛИТЕРАТУРЫ:
- Инструкция по применению препарата Лютеина.
- Каминский В.В. Токолитическая терапия: новые возможности/В.В. Каминский, С.И. Жук // Жіночий лікар. – 2008. – № 6. – С. 3.
- Майоров М.В. Гестагены в акушерско-гинекологической практике//Провизор. – 2004. – № 7. – С. 26-29.
- Приказ Минздрава Украины от 31.12.2004 года № 676 «Об утверждении клинических протоколов по акушерской и гинекологической помощи» раздел «Преждевременные роды» и изменения к нему №624 от 03.11.2008 г.
- Goldenberg R.L., lams J.D., Mercer B.M. et al. The preterm prediction study: the value of new vs. standard risk factors in predicting early and all spontaneous preterm births // Am. J. Public. Health. – 1998. – Vol. 88. – P. 233-238.
- Goldenberg RL, Culhane JF, lams JD, Romero R. Epidemiology and causes of preterm birth, The Lancet, 2008:371 (9606); 75-84.
- Management of preterm labor. Practice Bulletin No. 127. American College of Obstetricians and Gynecologists. Obstet Gynecol 2012;119:1308-13.
- Maternal mortality in 2005: estimates developed by WHO, UNICEF, UNFPA, and The World Bank. Geneva: World Health Organization; 2007.
- Romero R., Nicolaides K., Conde- Agudelo A. et al. Vaginal progesterone in women with an asymptomatic sonographic short cervix in the midtrimester decreases preterm delivery and neonatal morbidity: a systematic review and metaanalysis of individual patient data // Am. J. Obstet. Gynecol. – 2012. – Vol. 206, № 2. – P. 124.e1-19.
- Saigal S, Hoult LA, Streiner DL et al. School difficulties at adolescence in a regional cohort of children who were extremely low birth weight // Pediatrics. 2000. – Vol. 105, № 2. – P. 325-331.
- Tyson JE, Prarikh NA, Langer J et al. Intensive care for extreme prematurity: moving beyond gestational age // N. Engl. J. Med. – 2008. – Vol. 358, № 16. – P. 1672-1681.
- Use of progesterone to reduce preterm birth/American College of Obstetricians and Gynecologists. Obstet Gynecol 2008; 112: 963-5.
- Vaginal progesterone reduces the rate of preterm birth in women with a sonographic short cervix: a multicenter, randomized, double-blind, placebo-controlled trial. S.S. Hassan, R. Romero, D. Vidyadhari et al. Ultrasound in Obstetrics & Gynecology. – July 2011. Vol. 38, Is. 1. – P. 18-31.







