Семинары
Уважаемые коллеги!
На свидетельстве участника семинара, который будет сгенерирован в случае успешного выполнения Вами тестового задания, будет указана календарная дата Вашего он-лайн участия в семинаре.
Семинар "ЗАБОЛЕВАНИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ: ФОКУС НА ПОЛИФЕРМЕНТНУЮ ТЕРАПИЮ"
Автор: Успенский Ю.П., Вологжанин Д.А., Фоминых Ю.А.
Проводит: Республиканский Медицинский Университет
Рекомендован по специальностям: Гастроэнтерология, Семейная медицина/Терапия, Эндокринология
Просмотров: 3 279
Дата проведения: с 02.06.2015 по 02.06.2016
Согласно литературным данным, частота хронического панкреатита (ХП) среди заболеваний органов пищеварения составляет до 20%, при этом прослеживается общемировая тенденция к увеличению заболеваемости (в 2 раза за последние 30 лет). Распространенность ХП в России среди взрослых за последние 10 лет увеличилась в 3 раза, среди подростков – в 4 раза. При этом в 15-25% случаев заболевание носит тяжелый деструктивный характер и сопровождается различными осложнениями, которые являются основной причиной летального исхода. Летальность при панкреонекрозе остается крайне высокой и по данным различных авторов составляет от 15 до 90%.
Доказано, что основным этиологическим фактором развития панкреатита является алкоголь. У лиц, употребляющих более 100 г этанола в сутки, риск развития ХП повышен в 11 раз по сравнению с непьющими. Вместе с тем, определить пороговую дозу, превышение которой чревато развитием ХП, не удается, что указывает на различную индивидуальную чувствительность к алкоголю и возможную роль других факторов в развитии алкогольного ХП (Lin Y. et al., 2001). В отличие от алкогольной болезни печени хронический и даже острый панкреатит может развиться при употреблении так называемых «социально приемлемых» доз алкоголя. В результате, в 75-90% случаев ХП алкоголь является ведущим этиологическим фактором (M.W. Buchler et al, 2004).
По данным исследований, заболевание существенно «помолодело»: средний возраст пациента снизился на 11 лет – с 50 до 39. Тревожными выглядят данные, полученные В.П. Новиковой (2014), согласно которым среди учащихся 5–7 классов 52% опрошенных уже пробовали алкоголь, среди школьников 8–9 классов с алкоголем были знакомы уже 91%, а среди учеников 10–11 классов – 100%.
Значительная распространенность панкреатита определяется:
1. Центральной ролью поджелудочной железы (ПЖ) в организации полостного пищеварения. Гидролазы поджелудочной железы расщепляют 80% полисахаридов, 85% протеинов, практически все липиды.
2. Интенсивностью метаболических потребностей органа, поддерживающихся непосредственным влиянием ряда ключевых гормонов (инсулин, глюкагон, соматостатин и др.).
3. Низкой пролиферативной активностью поджелудочной железы (Герловин Е.Ш., 1978).
4. Сложностью эффективной регуляции работы органа в связи с объединением экзокринной и эндокринной функций.
5. Высокой чувствительностью поджелудочной железы к действию алкоголя. Важно отметить, что опасная доза для поджелудочной железы в 2 раза меньше, чем для печени (табл. 1) (Bujanda L., 2000).
Таблица 1. Дозы алкоголя, связанные с риском повреждения печени
|
Безопасные дозы алкоголя |
210 мл этанола (530 мл водки) в неделю |
|
Опасные дозы алкоголя |
80-160 мл этанола (200-400 мл водки) в сутки |
|
Очень опасные дозы алкоголя |
>160 мл этанола (>400 мл водки) в сутки |
Определение. Патогенез. Факторы хронизации воспалительного процесса поджелудочной железы.
Хронический панкреатит – хроническое метаболически детерминированное заболевание с акцентом на локальные вазоспастические реакции, ведущие к очаговой гипоксии и последующему аутолитическому разрушению органа. Несоответствие возможностей сосудистого русла органа обеспечить необходимую интенсивность синтетических процессов оказывается особенно выраженной при неадекватных нагрузках железы обильным приемом пищи и алкоголя. Сравнительно трудную адаптацию поджелудочной железы к внезапным переменам питания в количественном и качественном отношении (обильная и жирная пища, алкоголь) экспериментально доказал И.П. Павлов.
Повреждение органа запускает общие и местные компенсаторные противовоспалительные механизмы: синтез ингибитора трипсина (тучные клетки), орозомукоида, С-реактивного пептида; происходит перераспределение кровотока, снижение двигательной активности желудка и кишечника. Недостаточность компенсаторных реакций, направленных в первую очередь на ликвидацию гипоксии, приводит к панкреонекрозу, при адекватности компенсаторных реакций очаг альтерации локализуется и замещается соединительной тканью.
В качестве причин хронизации альтернативных процессов в железе рассматриваются следующие факторы:
А – патология сосудов, гипоксия.
1. Гипертензия сосудов поджелудочной железы в результате нарушения вегетативной регуляции висцерального кровотока. Для заболевания характерны вегетативные кризы, сопровождаемые спазмами артерий железы. На фоне криза формируются инвагинаты артерий мышечного и мышечно-эластического типа, вызывающие локальную острую ишемию. Зоны некроза и гипоксии ткани в процессе реабилитации замещаются соединительной тканью. Повторные кризы формируют фиброз органа.
2. Ишемическая болезнь сосудов брюшной полости (артериосклероз, атеросклероз чревного ствола и мезентериальных артерий) – развивается гипотрофия и фиброз поджелудочной железы с явлениями секреторной недостаточности. В случае тромбоза артерии следует фульминантное разрушение органа.
Б – мембранная метаболическая патология, связанная с повреждением клеточных мембран и последующим разрушением клетки.
1. Экологические факторы (консерванты, тяжелые металлы, пестициды, вещества бытовой химии, электромагнитные излучения) оказывают влияние на формирование клеточных мембран, в связи с чем возникает вероятность повреждения органа.
2. Токсикомания (алкоголизм, детергенты, химикаты, лекарственные препараты).
3. Наследственная мембранная патология.
В – патология протоковой системы поджелудочной железы (происходит постепенная склеротическая инволюция органа, как правило, не затрагивающая его островковый аппарат).
1. Связанная с внешними причинами, ухудшающими отток панкреатического сока (дискинезия двенадцатиперстной кишки (ДПК), желчнокаменная болезнь, опухоли железы и фатерова соска, фиброз органа).
2. Собственно протоковая (муковисцидоз, камнеобразование в протоках, воспалительные поражения протоков восходящей инфекцией).
Г – недостаточность ингибиторов протеаз (характерно рецидивирующее течение заболевания с формированием функциональной недостаточности органа).
1. Системная (общее истощение, патология печени).
2. Внутриорганная (нарушение синтеза и накопления ингибиторов органом – проблема мало изучена).
3. Наследственная.
Аутоиммунный механизм хронизации повреждения поджелудочной железы, несмотря на имеющиеся в литературе данные экспериментальных исследований (Канаян А.С., Пермяков Н.К., Титова Г.П., с соавт., 1984), не получил убедительного клинического подтверждения, напротив, использование глюкокортикоидов могло способствовать обострению заболевания.
Экзокринная функция поджелудочной железы.
Протеолитическая активность пищеварительного сока поджелудочной железы находится на сравнительно высоком уровне уже с первых месяцев жизни, достигая максимума к 4–6 годам. Липолитическая активность увеличивается в течение первого года ребенка. Активность поджелудочной амилазы к концу первого года жизни возрастает в 4 раза, достигая максимальных значений к 9 годам.
Амилаза секретируется не только поджелудочной железой, но и слюнными железами. Обе ее формы имеют приблизительно одинаковую активность и участвуют в расщеплении крахмала и гликогена. Амилаза слюнных желез может переварить крахмал еще до его поступления в тонкую кишку и контакта с панкреатической амилазой. Амилаза гидролизует ?1,4-гликозидные связи крахмала и гликогена, но не в состоянии расщеплять ?1,6-связи, которые гидролизуются ферментами интестинальной щеточной каемки.
Панкреатическая липаза катализирует расщепление триглицеридов пищи до двух жирных кислот и моноглицерида. Свое действие она осуществляет вместе с желчными кислотами.
При поступлении пищи в желудочно-кишечный тракт поджелудочная железа секретирует в тонкую кишку панкреатические ферменты и бикарбонаты, нейтрализующие соляную кислоту и поддерживающие щелочную среду в двенадцатиперстной кишке, необходимую для нормального функционирования энзимов.
В физиологических условиях поджелудочная железа образует в сутки от 50 до 1500 мл секрета. Панкреатический сок представляет собой бесцветную жидкость щелочной реакции (рН = 7,8–8,4). Он содержит органические вещества (белки) и неорганические компоненты (бикарбонаты, электролиты, микроэлементы), а также слизь выводящих протоков.
Ферментная часть секрета образуется в ацинарных клетках, а жидкая (водно-электролитная) – муцин и бикарбонаты – в эпителии протоков. С помощью панкреатических ферментов (липазы, амилазы и протеаз), играющих ключевую роль во внешнесекреторной функции поджелудочной железы, происходит расщепление пищевых веществ (табл. 2).
Таблица 2. Пищеварительные ферменты поджелудочной железы
|
Фермент поджелудочной железы |
Мишень |
|
Амилаза |
a1,4-гликозидные связи крахмала, гликогена |
|
Липаза |
триглицериды |
|
Фосфолипаза А |
фосфатидилхолин |
|
Карбоксиэстераза |
эфиры холестерина, эфиры жирорастворимых витаминов, три-, ди-, моноглицеридов |
|
Трипсин* |
внутренние связи белка (основные аминокислоты) |
|
Химотрипсин* |
внутренние связи белка (ароматические аминокислоты, лейцин, глутамин, метионин) |
|
Эластаза* |
внутренние связи белка (нейтральные аминокислоты) |
|
Карбоксипептидаза А и В* |
наружные связи белка, включая ароматические и нейтральные алифатические аминокислоты (А) и основные аминокислоты (В) с карбоксильного конца |
* образуются в поджелудочной железе в неактивной форме (проферменты) и активируются в двенадцатиперстной кишке.
В активной форме секретируются липаза, амилаза и рибонуклеаза. Большинство ферментов находятся в неактивной форме в виде проэнзимов, которые активируются в двенадцатиперстной кишке энтерокиназой (рис. 1).
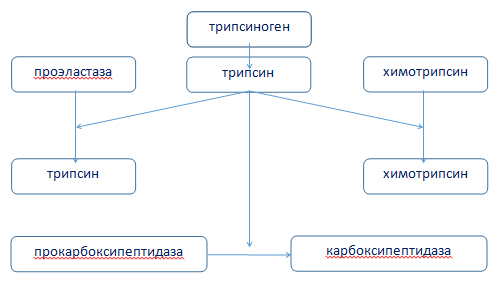
Рисунок 1. Механизм активации панкреатических пептидаз
Синдром экзокринной недостаточности поджелудочной железы.
Синдром экзокринной недостаточности поджелудочной железы обусловлен уменьшением массы ее функционирующей экзокринной паренхимы в результате атрофии, фиброза, неоплазии, либо нарушением оттока панкреатического секрета в двенадцатиперстную кишку (ДПК) в силу обтурации выводных протоков ПЖ конкрементом, опухолью, густым и вязким секретом.
Наряду с первичной панкреатической недостаточностью, связанной с уменьшением объема функционирующей паренхимы поджелудочной железы, выделяют так называемую вторичную панкреатическую недостаточность, при которой панкреатические ферменты либо не активируются, либо инактивируются в кишечнике (табл. 3). Как правило, это состояние, характеризующиеся снижением интрадуоденального уровня рН менее 5,5; моторной дисфункцией двенадцатиперстной кишки; быстрым транзитом кишечного содержимого; избыточным бактериальным ростом в тонкой кишке; дефицитом желчи и энтерокиназы и др.
Таблица 3. Причины панкреатической недостаточности
|
Первичная панкреатическая недостаточность |
Вторичная панкреатическая недостаточность |
|
Хронический панкреатит |
Заболевания слизистой оболочки тонкой кишки (уменьшение секретиновой и холецистокининовой стимуляции на ПЖ) |
|
Муковисцидоз |
Гастринома (инактивация ферментов ПЖ) |
|
Липоматоз ПЖ взрослых (при ожирении) |
Анастомоз по Бильрот II (плохое перемешивание пищевого комка с ферментами ПЖ) |
|
Резекция ПЖ, панкреатэктомия |
Врожденная недостаточность энтерокиназы |
|
Изолированная недостаточность липазы |
Недостаточность поступления белков с пищей |
|
Синдром Швахмана |
Желчнокаменная болезнь |
|
Синдром Йохансона-Близзарда |
Постхолецистэктомический синдром, циррозы печени (дефицит желчных кислот, асинхронизм поступления в ДПК желчи и панкреатического сока) |
|
Агенезия, гипоплазия ПЖ |
Избыточный бактериальный рост в тонкой кишке |
|
Рак ПЖ |
|
|
Инфильтративный рост с субтотальным замещением функционирующей паренхимы без нарушения оттока |
|
|
Локальное поражение ПЖ с развитием блока (прорастание, сдавление) главного панкреатического протока |
Развитие экзокринной недостаточности ПЖ зависит от ряда вторичных факторов, включающих особенности гастроинтестинальной моторики, желудочной, билиарной и тонкокишечной секреции, абсорбции, секреции гормонов и последствий абдоминальной хирургии (состояние после резекции желудка и гастрэктомии, холецистэктомиия и др.). Однако, несмотря на широкий спектр причин экзокринной недостаточности поджелудочной железы, самой частой причиной развития данного синдрома является именно хронический панкреатит.
По мере увеличения длительности течения ХП секреция ферментов уменьшается, однако снижение активности ферментов происходит неодинаково.
1. Установлено, что в первую очередь снижается панкреатическая секреция липазы, а снижение секреции амилазы и протеаз происходит несколько позже.
2. Дефицит липазы, по сравнению с уровнем снижения секреции протеаз, более выражен, так как недостаточность панкреатических протеаз может быть компенсирована кишечными протеазами и пептидазами, панкреатической амилазы – амилазами слюны и кишечника, а компенсаторные возможности слюнной и желудочной липазы относительно других панкреатических ферментов существенно ниже.
3. Снижение секреции бикарбонатов, наблюдаемое при экзокринной недостаточности поджелудочной железы, приводит к падению рН в двенадцатиперстной кишке. При рН ниже 5,0 липаза разрушается быстрее, чем другие ферменты. На фоне низкого интрадуоденального рН также снижается преципитация жирных кислот и происходит нарушение формирования мицелл, что в свою очередь также выражается нарушением всасывания жиров.
Таким образом, развитие стеатореи при ХП обусловлено нарушением панкреатического липолиза в результате снижения синтеза панкреатической липазы, нарушением секреции бикарбонатов с ацидификацией ДПК и преципитацией желчных кислот.
Клинические проявления поражения поджелудочной железы
В отличие от острого панкреатита, который проявляется приступами интенсивной боли опоясывающего характера в эпигастрии, болевой абдоминальный синдром при хроническом панкреатите может варьировать. Чаще всего мы наблюдаем у пациентов боль в собственно эпигастральной и околопупочной областях, тупую и постоянного характера или ощущение распирания и дискомфорта по всему эпигастрию. Абдоминалгия усиливается после употребления алкоголя, приема жирной пищи, переедания. Необходимо отметить суточный ритм болей: до обеда они беспокоят мало, после обеда либо появляются, либо постепенно нарастают к вечеру.
Известно, что компенсаторные возможности поджелудочной железы весьма велики, в связи с чем нарушение панкреатической секреции проявляется лишь при тяжелом ее поражении. В частности, стеаторея и креаторея у взрослых развиваются при снижении секреции панкреатической липазы и трипсина более чем на 90%.
Клиническими признаками экзокринной (внешнесекреторной) недостаточности поджелудочной железы являются:
– диарея;
– метеоризм;
– боли в животе;
– стеаторея;
– тошнота;
– рецидивирующая рвота;
– снижение аппетита;
– общая слабость;
– похудание;
– снижение физической активности;
– отставание в росте (при тяжелых формах мальдигестии).
Ряд клинических проявлений у пациентов с ХП обусловлен нутриционными нарушениями (табл. 4).
Таблица 4. Симптомы нарушения пищеварения и всасывания и механизмы их развития у больных ХП
|
Клинические признаки |
Механизм развития |
|
Парестезии, боль в костях, тетания, остеопороз |
Снижение всасывания Са и витамина D |
|
Мышечные судороги |
Избыточная потеря К и Мg |
|
Геморрагический синдром |
Снижение всасывания витамина К |
|
Глоссит, стоматит, хейлит |
Дефицит витамина В12, фолиевой кислоты и др. витаминов группы В |
|
Акродерматит |
Дефицит цинка |
Поражение поджелудочной железы иногда приводит к нарушению островкового аппарата и эндокринной функции. Иногда наблюдается клиническая картина нетяжелого сахарного диабета.
Диагностика патологии поджелудочной железы.
Для верификации именно алкогольного генеза панкреатита известен ряд биохимических маркеров злоупотребления алкоголем (Chik J, Kemppainen E., 2007). Данные биохимического анализа крови позволяют оценить такие показатели, как АЛТ и АСТ, а также их соотношение АСТ/АЛТ – коэффициент де Ритиса (в норме составляет 1,33±0,42 или 0,91-1,75). Если полученный показатель более 2, это свидетельствует о злоупотреблении алкоголем с сопутствующей патологией печени. Наиболее достоверным маркером регулярного употребления алкоголя является активность гаммаглютамилтранспептидазы (ГГТП) (табл. 5). Вместе с тем, данный показатель повышается лишь в 2/3 случаев. При этом необходимо помнить о возможности получения ложно-положительных результатов теста на ГГТП, что может быть связано с вирусными заболеваниями печени, беременностью, приемом антидепрессантов, противосудорожных препаратов, статинов. Еще одним маркером злоупотребления алкоголем считают также карбогидратдефицитный трансферрин (CDT). Определяют процентное соотношение карбогидратдефицитного трансферрина к общему трансферрину крови (T). Известно, что трансферрин имеет карбогидратный компонент. Но он исчезает, если пациент употреблял более 60 г этанола в день в предшествующие 3 и более недель. CDT может быть повышен у алкоголиков при нормальном показателе ГГТП. Кроме того, определяется средний объем эритроцита (MCV), который повышается у 1/3 пациентов, злоупотребляющих алкоголем.
Таблица 5. Биохимические тесты для объективизации приема алкоголя (по J. Chik et al., 2007)
|
Тест |
Актуальность теста после приема алкоголя |
|
T |
3 недели |
|
ГГТП |
3 недели |
|
MCV |
4 недели |
|
АСТ/АЛТ > 2 |
3 недели |
Копрологическое исследование кала является самым доступным методом, способным подтвердить наличие внешнесекреторной недостаточности поджелудочной железы. Дефицит или снижение активности панкреатических ферментов прежде всего отражается на внешнем виде каловых масс:
1) возникает полифекалия (стул становится более объемным);
2) каловые массы приобретают сероватый оттенок и «сальный» вид;
3) у экскрементов появляется зловонный, гнилостный запах.
Выделяют следующие патологические признаки:
1) стеаторея – наличие в каловых массах нейтрального жира (стеаторея 1-го типа); наличие жирных кислот, мыл (стеаторея 2-го типа); того и другого вместе (стеаторея 3-го типа);
2) креаторея – большое количество мышечных волокон ( или );
3) амилорея – появление в кале большого количества крахмальных зерен, свидетельствующих о нарушении расщепления углеводов.
Наиболее ранним признаком экзокринной панкреатической недостаточности является стеаторея, креаторея появляется значительно позже, амилорея наблюдается редко.
Содержание жиров в стуле можно также оценить качественным (добавление к калу суданового красителя) и количественным, наиболее информативным, методом. Он позволяет суммарно определить общее количество жира в фекалиях с учетом жира экзогенного (пищевого) происхождения. В норме с калом выделяется не более 10 % от жира, введенного с пищей. При заболеваниях поджелудочной железы его количество может увеличиваться до 60 %.
Определение эластазы-1 в кале является «золотым стандартом» в диагностике и оценке экзокринной функции поджелудочной железы.
Панкреатическая эластаза (эластаза-1) синтезируется в поджелудочной железе и экскретируется в виде проэластазы вместе с другими ферментами в 12-перстную кишку, где под действием трипсина превращается в эластазу. Эластаза-1 не деградирует в кишечнике, поэтому ее содержание в кале используют как показатель экзокринной функции поджелудочной железы.
Тест специфичен для человеческой панкреатической эластазы-1, поэтому поступление экзогенной эластазы (животного происхождения) не влияет на результаты исследования, нет необходимости прерывать лечение перед проведением исследования.
Диагностическая чувствительность и специфичность теста, которые превышают 90%, а также его удобство для пациента делают этот метод почти идеальным тестом, «золотым стандартом» диагностики нарушений экзокринной функции поджелудочной железы.
В норме активность эластазы-1 в стуле у детей старше 1 мес. и взрослых составляет более 200 мкг/г кала. Легкая степень экзокринной недостаточности поджелудочной железы соответствует содержанию эластазы-1 на уровне 200-500 мкг в 1 г кала; средняя степень – < 200 мкг в 1 г кала; тяжелая степень – < 100 мкг в 1 г кала. Важно помнить, что результаты теста на эластазу влияют на подбор дозы полиферментного препарата, поскольку по полученным показателям оценивается ферментативная активность поджелудочной железы. Таким образом, этот тест, помимо диагностического, имеет и терапевтическое значение.
Инструментальные методы
Ультразвуковое исследование поджелудочной железы позволяет выявить:
– увеличение размеров органа;
– изменение эхоплотности (отек, уплотнение);
– наличие эхоплотных включений;
– оценить состояние вирсунгова протока.
Метод используется для контроля за течением заболевания, а также для выявления осложнений.
С.И. Полякова и соавт. разработали методику ультразвукового исследования поджелудочной железы с использованием пищевой нагрузки, которая позволяет с большей точностью (на 23%), чем традиционное обследование, выявить патологию поджелудочной железы, а также проводить ультразвуковой мониторинг эффективности терапии. Стандартное ультразвуковое исследование проводится натощак, повторное – через 90–120 мин после физиологического завтрака. Затем по уровню коэффициента «рабочей гиперемии» органа диагностируется реактивный или хронический панкреатит.
Рентгенологический метод позволяет выявить косвенные (смещение, деформация желудка; дискинезия двенадцатиперстной кишки; разворот петли двенадцатиперстной кишки и т.д.) и прямые признаки заболевания поджелудочной железы (обнаружение камней по ходу панкреатических протоков, обызвествление паренхимы, увеличение поджелудочной железы).
В настоящее время все чаще используются комбинированные методы рентгенологического исследования, в том числе в комбинации с релаксационной зондовой дуоденографией.
Эндоскопическая ретроградная панкреатохолангиография
С помощью этой методики возможно выявление расширения и деформации главного панкреатического протока, обнаружение стриктур и отложений кальция на стенках протоков, обызвествление паренхимы поджелудочной железы. При исследовании также выявляются изменения желчевыводящей системы: стенозирующий папиллит, холедохолитиаз, аномалии развития желчных протоков и желчного пузыря и т.д.
Показаниями к проведению эндоскопической ретроградной панкреатохолангиографии являются:
– рецидивирующий хронический панкреатит;
– тупая травма живота с выраженным болевым синдромом;
– дуоденостаз;
– желтуха неясной этиологии;
– хронический калькулезный холецистит;
– предоперационное обследование больных.
Компьютерная томография (КТ) и магнитно-резонансная холангиопанкреато-графия (МРТ)
Показаниями к проведению этих исследований являются:
– осложненное течение острого и хронического панкреатита;
– подозрение на объемный процесс в поджелудочной железе и смежных органах.
Функциональные методы оценки эндокринной функции поджелудочной железы включают:
– определение уровня сахара в крови натощак;
– глюкозотолерантный тест (определение резервных возможностей инсулярного аппарата поджелудочной железы).
Таким образом, для диагностики патологии поджелудочной железы используются различные инструментальные методы, лабораторные и функциональные тесты, чувствительность и специфичность которых представлена в табл. 6.
Таблица 6. Чувствительность и специфичность методов диагностики хронического панкреатита (Лопаткина Т.Н., Авдеев В.Г., 2003)
|
Диагностические методы |
Чувствительность, % |
Специфичность, % |
|
УЗИ |
48–90 |
75–90 |
|
УЗИ с пищевой нагрузкой |
93 |
82 |
|
КТ |
59–95 |
85–90 |
|
ЭРХПГ |
68–93 |
89–97 |
|
Эндоскопическое УЗИ |
88–100 |
90–100 |
|
Эластаза – 1 в кале |
50–93 |
62–93 |
Подходы в терапии пациентов с заболеваниями поджелудочной железы
Основными целями в терапии панкреатита алкогольного генеза являются:
1. Элиминация причинного фактора заболевания.
2. Купирование болевого абдоминального синдрома;
3. Коррекция экзокринной недостаточности поджелудочной железы.
4. Коррекция эндокринной недостаточности органа.
Первый подход в успешной терапии реализуется путем категорического отказа от алкоголя.
Второй подход в терапии связан с купированием абдоминалгии, для чего используются диетотерапия, фармакотерапия, действие которой направлено на ингибирование панкреатической секреции (Маев И.В., Кучерявый Ю.А., Свиридова А.В., 2007).
Диета является одной из составляющих терапии при хроническом алкогольном панкреатите. Без применения диетотерапии трудно рассчитывать на достаточный лечебный эффект у таких больных. Для уменьшения болевого синдрома она не должна оказывать существенного влияния на продукцию панкреатического сока. При этом необходимо соблюдать два основных диетических принципа: дробный прием пищи (5-6 раз в день) и ограничение потребления стимуляторов панкреатической секреции (механически и химически щадящая пища). Важно помнить, что содержания жира должно быть уменьшено до 80 г/сут, количество жира должно быть равномерно распределено в течение дня, жиры в чистом виде из рациона исключаются, используются растительные жиры; ограничение в рационе квоты углеводов (до 350 г/сут), преимущественно за счет простых сахаров (не более 30 г/сут); ограничение поваренной соли (до 6-8 г/сут). Уменьшению боли способствует включение в рацион среднецепочечных триглицеридов и гидрализованных пептидов.
В клинической практике используются ингибиторы панкреатической секреции, такие как соматостатин, энкефалины. Кроме того, для создания функционального покоя поджелудочной железы необходимо назначение антисекреторных средств. Учитывая максимальную кислотосупрессию наиболее часто применяются ингибиторы протонной помпы, при необходимости в парентеральной форме. В случаях ишемии ПЖ, периневрального воспаления и фиброза зачастую используются ненаркотические анальгетики и спазмолитические препараты. Из числа последних назначаются как неселективные (дротаверин), так и селективные спазмолитики (гиосцина бутилбромид, мебеверин, пинаверия бромид).
В последние годы для купирования боли панкреатического происхождения особое внимание уделяется эффективному использованию ферментных препаратов. Полиферментные препараты – это комбинированные многокомпонентные лекарственные средства, преимущественно животного происхождения, основным действующим субстратом которых является панкреатин в чистом виде или в комбинации с дополнительными компонентами (желчными кислотами, гемицеллюлазой, пеногасителем симетиконом, адсорбентами и др.).
Полиферментные препараты, в зависимости от комбинации входящих в их состав компонентов, можно разделить на несколько групп:
• Экстракты слизистой оболочки желудка, основным действующим веществом которых является пепсин (абомин, пепсидил, ацидинпепсин). Применение данных ферментов у больных панкреатитами показано только при сочетании тяжелой внешнесекреторной недостаточности ПЖ и атрофического гастрита.
• Панкреатические энзимы, в состав которых входит амилаза, липаза и трипсин (панкреатин).
• Комбинированные препараты, содержащие помимо панкреатина компоненты желчи, гемицеллюлозу, симетикон, растительные желчегонные (куркума) средства и др. Желчные кислоты, введенные в состав препарата, увеличивают панкреатическую секрецию и холерез, стимулируют моторику кишечника и желчного пузыря. В условиях микробной контаминации кишечника происходит их деконъюгация, что может приводить к активации цАМФ энтероцитов с последующим развитием осмотической и секреторной диареи. В связи с этим, ферментные препараты, содержащие желчные кислоты категорически противопоказаны больным с отечными и болевыми формами ХП.
• Комбинированные ферменты, содержащие животные ферменты (панкреатин) в сочетании с растительными энзимами, витаминами, комбицин (панкреатин и экстракт рисового грибка).
• Собственно растительные энзимы, представленные папаином, грибковой амилазой, протеазой, липазой и другими ферментами (пепфиз, ораза).
• Ферменты, содержащие лактазу.
Наиболее универсальными средствами, нормализующими пищеварение при синдромах мальдигестии и мальабсорбции, являются препараты панкреатина, не оказывающие влияния на функцию желудка, печени, моторику билиарной системы и кишечника. Эти ферменты обеспечивают достаточный спектр пищеварительной активности и способствуют купированию таких клинических признаков, как тошнота, урчание в животе, метеоризм, стеато-, креато- и амилорея. Входящая в полиферментный комплекс амилаза расщепляет преимущественно внеклеточные полисахариды до простых сахаров – сахарозы и мальтозы, практически не участвуя в гидролизе растительной клетчатки. Протеазы в препаратах панкреатина преимущественно представлены химотрипсином и трипсином. Липаза участвует в гидролизе нейтрального жира.
Противоболевой эффект препаратов, содержащих панкреатин, проявляется за счет механизма обратного торможения выработки ферментов поджелудочной железой при их поступлении в двенадцатиперстную кишку, т.е. создавая физиологической покой органа, мы назначаем ферментные препараты в качестве ингибиторов панкреатической секреции (рис. 2).

Рисунок 2. Физиологическая регуляция (по механизму обратной связи) выработки собственных ферментов поджелудочной железы
В ряде исследований были продемонстрированы данные, показывающие уменьшение выраженности болевого абдоминального синдрома на фоне приема полиферментных препаратов (Охлобыстин А.В., 2001; Stermer E., 2002). Научно-обоснованной является точка зрения, что преимущества в купировании абдоминалгии панкреатического происхождения, поскольку активация содержащихся в них энзимов начинается непосредственно в проксимальном отделе двенадцатиперстной кишки, способствуя максимально быстрому созданию функционального покоя поджелудочной железы и стиханию абдоминальной боли, имеют таблетированные полиферментные препараты (Stead R.J. et al., 1988, Suzuki A. et al., 1999, Greenberger N.J., 1999). Кроме того, алгоритм лечения хронического панкреатита с болевым синдромом, предложенный в 1998 г. Американской Гастроэнтерологической Ассоциацией (AGA), ориентирует врача на использование именно таблетированных ферментных препаратов (AGA Medical Position Statement, 1998).
В то время как возможности энтеросолюбильных микросферических ферментных препаратов в купировании болевого синдрома панкреатического происхождения по сравнению с таблетированными препаратами, проявляются в меньшей степени. Известно, что главную роль в торможении панкреатической секреции по механизму обратной связи (инактивации холецистокинин-рилизинг-пептида) играют протеазы, в частности трипсин. При этом важно наличие высоких концентраций протеаз именно в проксимальном отделе двенадцатиперстной кишки, а энтеросолюбильные ферментные препараты достигают максимальной активности в дистальном отделе последней, обладая при этом меньшей эффективностью в инактивации холецистокинин-рилизинг-пептида (Sherlock S., 1992; Stermer E., 2002).
Кроме того, ферментная терапия необходима при наличии у пациента экзокринной недостаточности поджелудочной железы. В данном случае мы проводим заместительную терапию панкреатическими ферментами.
Показаниями для заместительной ферментной терапии при ХП с внешнесекреторной недостаточностью являются:
1) стеаторея, при потере с калом более 15 г жира в сутки;
2) прогрессирующая нутриционная недостаточность;
3) стойкий диарейный синдром и диспептические жалобы.
Основная цель заместительной терапии панкреатическими ферментами заключается в обеспечении достаточной активности липазы в ДПК, что сопряжено с рядом трудностей.
Во-первых, воздействие соляной кислоты на панкреатические ферменты приводит к разрушению до 90% их количества. Использование препаратов, содержащих кислотоустойчивые ферменты растительного и грибкового происхождения, не нуждающихся в кислотозащитной оболочке, не дало ожидаемого результата. Было показано, что эффективность кислотоустойчивый липазы грибкового происхождения значительно уступает препаратам панкреатина. По данным A. Suzuki et al. в экспериментах на собаках бактериальная липаза оказалась в 75 раз слабее: 240 мг бактериального фермента по своей активности оказались эквивалентны 18 мг фермента свиного происхождения.
Решением данной проблемы явилось создание галенических форм полиферментных препаратов в кислотоустойчивой оболочке. Использование препарата, имеющего такую оболочку, увеличивает всасывание жиров в среднем на 20% по сравнению с сопоставимой дозой панкреатина без оболочки.
Если постпрандиальный рН в желудке зависит как от индивидуальных особенностей секреции, так и от количества пищи и времени ее нахождения в желудке, то интрадуоденальный рН зависит от остаточной секреции бикарбонатов ПЖ, секреции бикарбонатов тонкой кишкой, от разведения объемом, а также от количества соляной и желчных кислот. Поэтому при использовании панкреатических ферментов с кислотоустойчивой оболочкой интрагастральный рН не должен превышать 5, так как в этом случае ферменты будут освобождаться от энтеросолюбильной оболочки уже в желудке. Если это произойдет, то часть ферментов у пациентов с нарушенной моторной функцией будет необратимо разрушена при реацидификации. С другой стороны, внутрижелудочное высвобождение панкреатических ферментов может сдвигать баланс защиты слизистой оболочки желудка в сторону усиления факторов агрессии, провоцируя эрозивно-язвенные поражения. Этот механизм часто реализуется у пациентов с дуоденогастральным рефлюксом, являющимся самостоятельным агрессивным фактором за счет негативного влияния желчных кислот, лизолицетина и фосфолипаз на слизистую желудка. В то же время, интрадуоденальный рН должен быть не ниже 5,5 для адекватного высвобождения ферментов в ДПК.
Другим фактором, затрудняющим проведение эффективной заместительной ферментной терапии, является асинхронный гастродуоденальный транспорт ферментных препаратов и пищевого комка, что наблюдается при нарушениях пассажа, имеющем место при ряде состояний (сахарный диабет, стеноз привратника, состояние после ваготомии, автономные нейропатии и т.д.), а также при применении ферментных препаратов сравнительно большого размера. Известно, что из желудка одновременно с пищей могут эвакуироваться твердые частицы, диаметр которых составляет не более 2 мм при оптимальном размере 1,4 мм. Более крупные частицы, в частности ферментные препараты в таблетках или драже, эвакуируются в межпищеварительный период, когда пищевой химус отсутствует в ДПК. В результате препараты не смешиваются с пищей и недостаточно активно участвуют в процессах пищеварения. При длительном нахождении таблетки или драже в желудке их энтеросолюбильная оболочка разрушается, а находящиеся внутри ферменты инактивируются.
Известно, что максимальное физиологическое постпрандиальное поступление панкреатической липазы составляет приблизительно 140000 ЕД/час в течение 4 часов после еды, а мальабсорбция не развивается, если в двенадцатиперстную кишку попадает более 5% от нормальной максимальной продукции фермента. Таким образом, для коррекции стеатореи необходимо обеспечить поступление около 28000 ЕД липазы в течение 4 часов постпрандиального периода. Соответственно, для коррекции стеатореи необходимо использовать препараты только с высоким содержанием липазы. Применение для этой цели ферментных препаратов, содержащих от 3500 до 6000 Ед липазы, представляется проблематичным, поскольку в этом случае необходимо назначить 5-8 таблеток одновременно, а если учесть инактивацию или отсутствие активации большей части липазы при вторичной панкреатической недостаточностью, то следует говорить о приеме 20–30 таблеток сразу! Поэтому совершенно очевидно, что применение для лечения экзокринной недостаточности ПЖ энтеросолюбильных таблетированных полиферментных препаратов панкреатина в традиционных дозах практически бесполезно.
Для обеспечения быстрого и гомогенного смешивания ферментов с пищевым химусом, предотвращения внутрижелудочной инактивации и адекватного пассажа из желудка в ДПК были созданы ферментные препараты панкреатина нового поколения в виде минитаблеток, диаметр которых не превышает 2 мм. Препараты покрыты энтеросолюбильными оболочками и заключены в желатиновые капсулы. При попадании в желудок желатиновые капсулы быстро растворяются, микросферы или микротаблетки смешиваются с пищей и постепенно поступают в ДПК. При рН дуоденального содержимого выше 5,5 оболочки растворяются, и ферменты начинают действовать на большой поверхности. При этом практически воспроизводятся физиологические процессы пищеварения, когда панкреатический сок выделяется порциями в ответ на периодическое поступление пищи из желудка.
Эволюция ферментных препаратов начиная с XIX века прошла путь от порошков до микросфер, а в настоящее время и до минитаблеток, демонстрируя инновационный подход к увеличению эффективности терапии. При производстве нового ферментного препарата в виде минимаблеток была использована угикальная технология «Eurand Minitabs® Technology» . Технология заключается в многократном прессовании субстанции, сверхточной лазерной резке плотных частиц размером 2?2 мм, которые названы мини-таблетками. В каждой капсуле содержится стандартизированное количество мини-таблеток, содержащих 500 ЕД липазы.
Применение полимеров типа Eudragit (инновационное галеновое решение) дало возможность получить мини-таблетки с функциональной мембраной и энтеросолюбильным покрытием, обеспечивающим модифицированное (пролонгированное) высвобождение липазы (рис. 3).
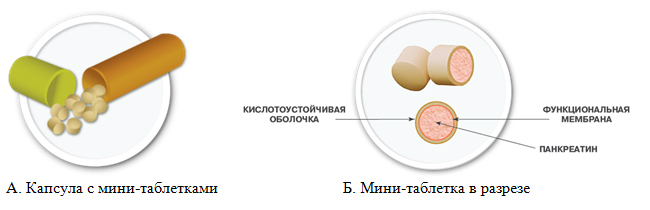
Рисунок 3. Технология с использованием мини-таблеток
Благодаря быстрому (одновременно с пищей) поступлению мини-таблеток в двенадцатиперстную кишку и высвобождению из них ферментов, а также высокому содержанию липазы в этих препаратах, они обладают наиболее существенным терапевтическим эффектом.
Преимущества мини-таблетированной формы панкреатических ферментов заключаются:
– в равномерном распределении в пище;
– быстром и гомогенном смешивании с химусом (в отличие от таблетированных препаратов);
– синхронном попадании вместе с пищевым комком в тонкую кишку – отсутствие различий с микросферическими препаратами в гастроинтестинальном транзите (рис. 4);
– быстроте действия (при pH > 6,0 в течение 30 мин высвобождается 97 % ферментов);
– высокой интестинальной биодоступности препарата (100 %).
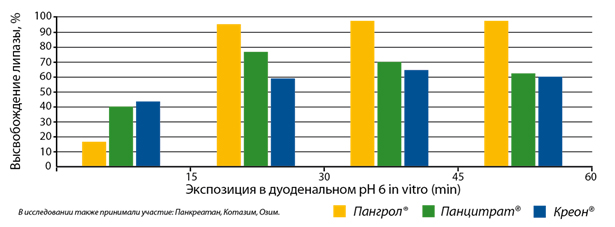
Рисунок 4. Пассаж мини-таблеток с химусом из желудка в 12-перстную кишку
Инновационная технология позволяет обеспечить более полное высвобождение липазы из минитаблеток (? 95%) и пролонгированное действие в кишечнике по сравнению с аналогами (рис. 5).
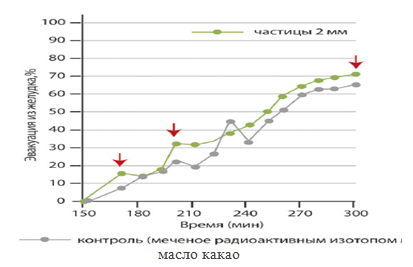
Рисунок. 5 Экспозиция ферментных препаратов в дуоденальном рН in vitro
Препараты, содержащие панкреатические ферменты в виде мини-таблеток, могут применяться как постоянно, в качестве заместительной терапии, так и однократно, при пищевой нагрузке. Доза подбирается индивидуально и зависит от степени выраженности клинико-лабораторных показателей экзокринной функции поджелудочной железы. О достаточности дозы судят по клиническим (нормализация частоты, характера стула, купирование метеоризма, диспепсических жалоб, прибавка веса) и лабораторным показателям (исчезновение стеатореи и креатореи в копрограмме, нормализация триглицеридов в липидограмме стула) (рис. 6).
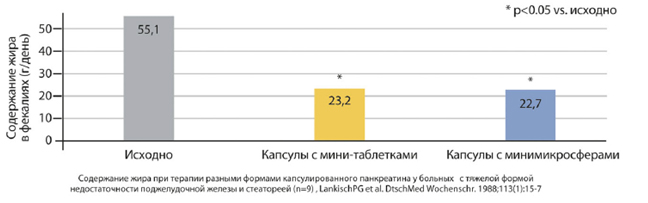
Рисунок 6. Содержание жира в кале спустя 5 суток заместительной ферментной терапии препаратами в форме мини-таблеток и мини-микросфер
Таким образом, проблема поражения поджелудочной железы является актуальной как для взрослой, так и для педиатрической клинической практики. Терапия пациентов данной категории должна быть комплексной. Ферментная терапия относится к числу облигатных ее составляющих для купирования болевого абдоминального синдрома и коррекции внешнесекреторной недостаточности поджелудочной железы. Эволюция ферментных препаратов дает нам возможность использовать в клинической практике новые формы в виде мини-таблеток, которые благодаря быстрому (одновременно с пищей) поступлению в двенадцатиперстную кишку и высвобождению из них ферментов, а также высокому содержанию липазы, обладают наиболее значительным терапевтическим эффектом.









